
- •3. Основные закономерности химических процессов.
- •3.1 Основные понятия и законы химической термодинамики
- •Однородная система – одинаковые химические и физические свойства во всех частях системы.
- •Термическое равновесие (все части системы находятся при одинаковой температуре) есть необходимое условие термодинамического равновесия.
- •3. 2. Характеристические функции
- •3.3. Критерии возможности и направленности самопроизвольного процесса и условия равновесия
- •3.4. Основные термодинамические функции индивидуальных веществ
- •3.5. Термодинамические функции реакций
- •3.5.1. Зависимость теплового эффекта реакции от температуры
- •3.7. Энергия Гиббса смеси. Химический потенциал компонента
- •3.8. Термодинамический закон действующих масс (тздм)
- •3.9. Направление протекания химической реакции. Использование термодинамического закона действующих масс для расчета состава равновесной смеси
- •3.10. Влияние температуры и давления на химическое равновесие
- •3.11. Химическое равновесие в гетерогенных системах.
- •3.12. Химическая кинетика
- •3.13. Константы скоростей химических реакций
- •3.14. Теория (модель) активированного комплекса
- •3.15. Химическая кинетика в гетерогенных системах
- •Выделяют следующие стадии гетерогенного катализа:
3.5.1. Зависимость теплового эффекта реакции от температуры
можно получить, если формулу (3.29) с T0 = 298,15 К подставить в формулу (3.28):
|
(3.31)
|
Дифференциальная форма температурной зависимости энтальпии реакции носит название уравнения Кирхгоффа
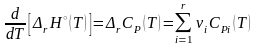 .
(3.32)
.
(3.32)
Если в данном температурном интервале rCР > 0, то при повышении температуры энтальпия возрастает, и наоборот.
Ранее определив другую важнейшую функцию – энтропию, мы уже привели формулу (3.24), которая определяет стандартное ее значение по данным о теплоемкости и энтальпиям trH фазовых и полиморфных превращений.
Заменив
букву H
буквой S
вместо формул (3.27) и (3.28) для энтальпии
получаем пропорциональное координате
реакции изменение энтропии системы,
выраженное через энтропию
реакции
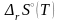 .
.
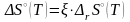 ,
,
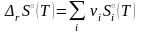 ,
(3.28')
,
(3.28')
В отличие от энергетических функций, 3-й закон термодинамики однозначно определяет нулевой уровень отсчета энтропии для каждого «нормального» вещества при 0 К.
Наконец, стандартные энтальпия и энтропия составляют стандартную энергию Гиббса реакции – её важнейшую термодинамическую характеристику: rG = rH – TrS. (3.33)
3.6. Энтропия идеального газа и идеальной газовой смеси.
Подставив
дифференциал мольного объема
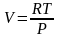 идеального
газа
идеального
газа
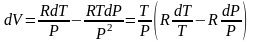 в основное термодинамическое соотношение
TdS
= CV
dT +
РdV
и использовав связь (3.20) CV =
CP – R
получаем
в основное термодинамическое соотношение
TdS
= CV
dT +
РdV
и использовав связь (3.20) CV =
CP – R
получаем
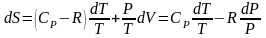 .
Интегрирование от T1
и P1
до Т
и Р
даёт
.
Интегрирование от T1
и P1
до Т
и Р
даёт
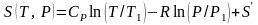 .
.
Энтропийная постоянная идеального газа S′ при конкретизированных T1 = 1 К, P1 = P = 101325 Па = 1 атм – это энтропия 1 моля газа при стандартном давлении P и температуре 1 К может быть вычислена методами статистической термодинамики по молекулярным постоянным. Т. о. абсолютная энтропия моля идеального газа
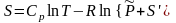 ,
(3.35)
,
(3.35)
где
стоящие под знаком ln
T =
T/1К
и
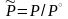 - безразмерные величины.
- безразмерные величины.
|
В стеклянный цилиндр, разделенный перегородками, поместим по ni молей разных газов. P и T во всех отсеках одинаковы.
|
S(до
смешения)
=
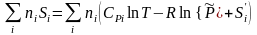 (3.36)
(3.36)
После
разрушения перегородок и необратимого
(диффузионного) смешения каждый из газов
займет весь объем. При этом температура
останется неизменной, поскольку
внутренняя энергия газа не зависит от
объема. Одинаковое и равное давление P
после разрушения перегородок становится
общим давлением
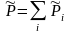 ,
которое по закону Дальтона складывается
из парциальных
,
которое по закону Дальтона складывается
из парциальных
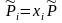 ,
где
,
где
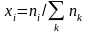 - мольная доля i-го
компонента в смеси.
- мольная доля i-го
компонента в смеси.
Энтропия системы после смешения газов равна
S(после
смешения)
=
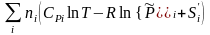 .
(3.37)
.
(3.37)
Изменение энтропии в результате смешения газов называют энтропией смешения Sсм = S(после смешения) – S(до смешения) :
Sсм =
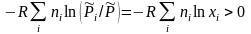 .
(3.38)
.
(3.38)
Оказывается, что это выражение определяет энтропию смешения не только газовых, но и жидких и твердых идеальных растворов. При смешении компонентов энтропия системы необратимо возрастает.
3.7. Энергия Гиббса смеси. Химический потенциал компонента
в растворе
Определение основных понятий химической термодинамики и получение общих соотношений продолжим на примере идеально газовой системы.
Энтальпию i-го компонента при (необязательном) условии постоянства Cp легко получить из её определения (3.19):
Hi = CРiT + H0i , (3.39)
где H0i = U0i – внутренняя энергия моля идеального газа при 0 К.
Составим
из
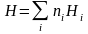 и S
(3.37) энергию Гиббса G
= H
– TS
=
и S
(3.37) энергию Гиббса G
= H
– TS
=
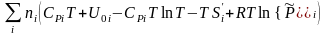 .
Объединив все слагаемые
.
Объединив все слагаемые
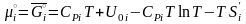 ,
которые зависят от природы i‑го
вещества и температуры, но не зависят
от состава смеси, получаем
,
которые зависят от природы i‑го
вещества и температуры, но не зависят
от состава смеси, получаем
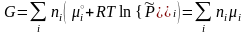 ,
(3.40)
,
(3.40)
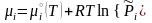 .
(3.41)
.
(3.41)
Величина
μi
называется химическим
потенциалом i‑го
компонента в газовой смеси.
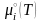 - стандартный химический потенциал
компонента при парциальном давлении
- стандартный химический потенциал
компонента при парциальном давлении
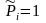 .
.
Используя
определение парциального давления
,
из (3.41) получаем другую форму химического
потенциала
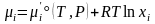 (
(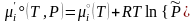 ),
(3.41')
),
(3.41')
которую можно применять уже не только к газовым, но и к конденсированным смесям.
При протекании химических процессов происходит изменение состава реакционной смеси. Соответствующее изменение G:
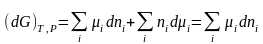 ,
(3.42)
,
(3.42)
Можно
показать, что
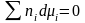 ,
а из (3.42) следует фундаментальное
определение химического потенциала
,
а из (3.42) следует фундаментальное
определение химического потенциала
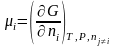 (3.41'').
(3.41'').
Являясь важнейшей характеристикой вещества в растворе, химический потенциал i‑го вещества - это, прежде всего, частная производная от энергии Гиббса по его мольному количеству в растворе.


