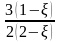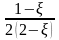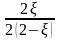- •3. Основные закономерности химических процессов.
- •3.1 Основные понятия и законы химической термодинамики
- •Однородная система – одинаковые химические и физические свойства во всех частях системы.
- •Термическое равновесие (все части системы находятся при одинаковой температуре) есть необходимое условие термодинамического равновесия.
- •3. 2. Характеристические функции
- •3.3. Критерии возможности и направленности самопроизвольного процесса и условия равновесия
- •3.4. Основные термодинамические функции индивидуальных веществ
- •3.5. Термодинамические функции реакций
- •3.5.1. Зависимость теплового эффекта реакции от температуры
- •3.7. Энергия Гиббса смеси. Химический потенциал компонента
- •3.8. Термодинамический закон действующих масс (тздм)
- •3.9. Направление протекания химической реакции. Использование термодинамического закона действующих масс для расчета состава равновесной смеси
- •3.10. Влияние температуры и давления на химическое равновесие
- •3.11. Химическое равновесие в гетерогенных системах.
- •3.12. Химическая кинетика
- •3.13. Константы скоростей химических реакций
- •3.14. Теория (модель) активированного комплекса
- •3.15. Химическая кинетика в гетерогенных системах
- •Выделяют следующие стадии гетерогенного катализа:
3.8. Термодинамический закон действующих масс (тздм)
Для
химической реакции общего вида
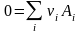 (для реагентов i < 0)
изменению состава компонентов
(для реагентов i < 0)
изменению состава компонентов
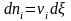 при постоянных Т
и
Р,
согласно (3.42), соответствует дифференциальное,
а затем и конечное изменение энергии
Гиббса.
при постоянных Т
и
Р,
согласно (3.42), соответствует дифференциальное,
а затем и конечное изменение энергии
Гиббса.
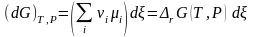 ,
,
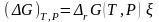 . (3.43)
. (3.43)
По химическим потенциалам и стехиометрическим коэффициентам νi компонентов, аналогично энтальпии (3.28) и энтропии (3.28'), определена энергия Гиббса реакции
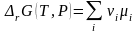 . (3.44)
. (3.44)
Равновесие в изобарно-изотермическом процессе, в соответствии условием (3.17), определяется нулевой скоростью изменения энергии Гиббса (3.43) в точке её минимума:
 . (3.45)
. (3.45)
Это общее условие равновесия конкретизируем для газофазной реакции, подставив в него химические потенциалы (3.41) участников:
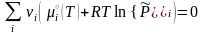 ,
, 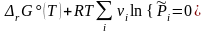 , (3.45')
, (3.45')
где
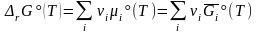 (3.44')
(3.44')
- стандартная энергия Гиббса реакции.
Преобразование и эспоненцирование (3.45') приводит к уравнению:
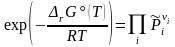 (3.46)
(3.46)
Не зависящая от состава реакционной смеси его левая часть называется стандартной константой равновесия:
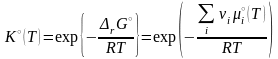 .
(3.47)
.
(3.47)
Правую
часть (3.46)
 назовем
стехиометрическим
произведением концентраций.
В данном случае оно выражено через
равновесные значения безразмерных
парциальных давлений.
назовем
стехиометрическим
произведением концентраций.
В данном случае оно выражено через
равновесные значения безразмерных
парциальных давлений.
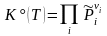 (
,
νi
< 0 для
реагентов).
(3.49)
(
,
νi
< 0 для
реагентов).
(3.49)
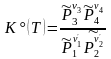 ('1A1+
'2A2
=
3A3 +
4A4).
(3.49')
('1A1+
'2A2
=
3A3 +
4A4).
(3.49')
Уравнение, отражающее условие равновесия химической реакции, называется термодинамическим законом действующих масс (ТЗДМ). Форма (3.49) - для реакции общего вида, (3.49') - для 4-х компонентного уравнения реакции в обычной записи.
Поскольку
состав системы можно характеризовать
разными концентрационными единицами,
то различные, в общем случае размерные
правые части ТЗДМ, слева должны
уравниваться соответствующими константами
равновесия. Подстановка связи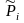 с
соответствующей
концентрацией в (3.49) позволяет для каждой
формы ТЗДМ выразить соответствующую
константу равновесия через стандартную
К°(Т).
с
соответствующей
концентрацией в (3.49) позволяет для каждой
формы ТЗДМ выразить соответствующую
константу равновесия через стандартную
К°(Т).
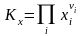 ,
,
,
, 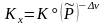 ; (3.50х)
; (3.50х)
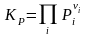 ,
, 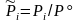 ,
, 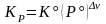 ; (3.50Р)
; (3.50Р)
 ,
, 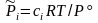 ,
, 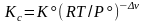 . (3.50с)
. (3.50с)
Здесь = i = 3 + 4 – '1 – '2 – изменение числа молей в реакции, Kx, KP, Kc – константы равновесия, соответствующие использованию мольных долей xi, парциальных давлений Pi (атм) и концентраций ci (моль/м3).
3.9. Направление протекания химической реакции. Использование термодинамического закона действующих масс для расчета состава равновесной смеси
Относительные парциальные давления компонентов реакции до момента их взаимодействия, т.е. в исходном состоянии, отметим дополнительным нижним индексом «0» и выразим энергию Гиббса реакции (3.44) из ТЗДМ (3.45'):
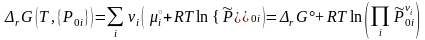 (3.51)
(3.51)
Выражение (3.51) впервые получено Вант-Гоффом, а Де-Донде, исходя из необходимого для самопроизвольного протекания процесса отрицательного значения (см. формулу (3.43) в разделе 3.3) сформулировал:
Если в исходном состоянии энергия Гиббса реакции:
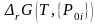 < 0,
то > 0
и реакция потечет слева направо.
< 0,
то > 0
и реакция потечет слева направо.> 0, то < 0 и реакция потечет справа налево.
Текущие концентрации будут изменяться до достижения своих равновесных значений при
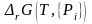 = 0.
= 0.
Расчет равновесного состава при фиксированных Т и Р и при заданной или вычисляемой по энергиям Гиббса веществ константе равновесия сводится к нахождению химической координаты реакции . Для нескольких реакций вместо одного требуется решать уже систему уравнений ТЗДМ с привлечением специализированных компьютерных средств.
Ниже представлено решение для простых, но практически важных реакций. Форма ТЗДМ (3.50х) соответствует мольным долям xi.
Пример 1. Зависимость выхода йодистого водорода от соотношения реагентов.
|
H2 |
+ J2 |
= 2 HJ |
= 0, Kx = K = 45,7 (Т = 718 К) |
n0i : |
m |
n |
0 |
|
ni = n0i + i : |
m– |
n– |
2 |
Σni = m + n |
xi
= ni
/
Σni
;
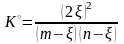 ;
;
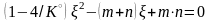 .
.
Для
удобства введены обозначения:
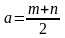 ,
,
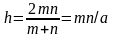 ,
A=1−4/K.◦
Тогда
,
A=1−4/K.◦
Тогда
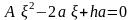
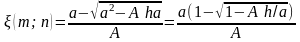
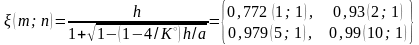
Результаты вычислений при различных исходных количествах йода и водорода (n; m) показывают, что выход по йоду /n можно повысить за счет избытка водорода!
Пример 2. Расчет выхода аммиака и его зависимость от давления.
|
|
3 H2 |
+ N2 |
= 2 NH3 |
= -2, Kx= K(P, атм)2, K= 4,21∙10-5 при Т = 720 К |
|||||
n0i = 'i: |
3 |
1 |
0 |
|
|
|||||
|
ni = n0i + i : |
3–3 |
1– |
2 |
ni=2(2-) |
|||||
|
xi = ni/ni: |
|
|
|
|
|||||
 ,
,
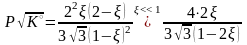
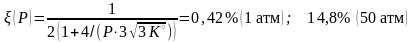 .
.
Приемлемый выход можно достичь только при повышенных давлениях. На практике аммиак с 30 % -м выходом синтезируют при давлениях около 300 атм.