
- •Глава 1. Предмет и задачи медицинской микробиологии и иммунологии
- •Мир микробов. Общие сведения
- •Микробиология — наука о микробах
- •Иммунология — наука об иммунитете
- •Связь микробиологии с иммунологией
- •История развития микробиологии и иммуно тогии
- •Isbn 5-225-04208-2 © Издательство «Медицина»,
- •Глава 1. Предмет и задачи медицинской микробиологии и иммунологии
- •Мир микробов. Общие сведения
- •Микробиология — наука о микробах
- •Связь микробиологии с иммунологией
- •История развития микробиологии и иммуно тогии
- •Глава 2. Классификация и морфология микробов
- •Систематика и номенклатура микробов
- •Классификация и морфология бактерий
- •Строение и классификация простейших
- •Основные методы изучения морфологии микробов
- •Глава 3. Физиология микробов
- •Физиология бактерий
- •Рост и размножение бактерий
- •Особенности физиологии грибов и простейших
- •Глава 4. Экология микробов
- •Распространение микробов в окружающей среде
- •Микрофлора почвы
- •4 1.2. Микрофлора воды
- •Микрофлора продуктов питания
- •Действие излучения
- •Действие химических веществ
- •Действие биологических факторов
- •Уничтожение микробов в окружающей среде
- •Стерилизация
- •Дезинфекция
- •Асептика и антисептика
- •Санитарная микробиология
- •Микробиологический контроль лекарственных средств
- •Глава 5. Генетика микробов
- •5‘ Конец
- •Фосфат fc-q
- •Особенности генетики вирусов
- •4. Применение генетических методов в диагностике инфекционных болезней
- •Метод молекулярной гибридизации
- •Глава 6. Биотехнология. Генная инженерия
- •Предмет и задачи биотехнологии
- •3. Объекты и процессы в биотехнологии
- •Генетическая инженерия в биотехнологии
- •Глава 7. Противомикробные препараты
- •Химиотерапевтические лекарства
- •Глава 8. Учение об инфекции
- •Понятие об инфекционной болезни
- •Участники инфекционного процесса
- •Стадии инфекционного процесса и его уровни
- •Патогенные и условно-патогенные микробы
- •Роль окружающей среды
- •Характерные особенности инфекционных болезней
- •8 7. Формы инфекционного процесса
- •Глава 9. Учение об иммунитете
- •Виды иммунитета
- •Созревание, размножение, дифферениировка
- •Патология иммунной системы
- •Реакции антиген — антитело и их практическое применение
- •Реакция преципитации
- •Реакция с использованием меченых антител или антигенов
- •Глава 10. Иммунопрофилактика и иммунотерапия болезней человека
- •Вакцины
- •Убитые вакцины
- •Лекарственные формы вакцин
- •Массовые способы вакцинации
- •10.2.7. Производство вакцин и их контроль
- •Бактериофаги
- •Эубиотики
- •Диагностические препараты
- •Классификация микробов по степени их биологической опасности. Номенклатура микробиологических лабораторий
- •112. Санитарно-техническое оснащение лаборатории
- •Правила работы в микробиологической лаборатории
- •Принципы микробиологической диагностики инфекционных болезней
- •11.S. Принципы иммунологической диагностики болезней человека
- •Глава 12. Возбудители кишечных инфекций
- •Возбудители бактериальных кишечных инфекций
- •Возбудители эшерихиозов
- •Возбудители дизентерии
- •Возбудители брюшного тифа и паратифов
- •Возбудители кишечного иерсиниоза и псевдотуберкулеза
- •1.7. Возбудители бруцеллеза
- •Возбудитель хеликобактериоза
- •Возбудители лептоспироза
- •Вирусы энтеральных гепатитов
- •Возбудитель лямблиоза
- •Глава 13 возбудители респираторных инфекционных болезней
- •Возбудители вирусных респираторных инфекций
- •Вирусы гриппа
- •2.2. Вирусы — возбудители других острых респираторных вирусных инфекций
- •Вирус эпидемического паротита
- •Вирус краснухи
- •Вирус оспы обезьян
- •Вирус ветряной оспы и опоясывающего герпеса
- •Глава 14. Возбудители кровяных инфекционных болезней
- •Возбудители бактериальных кровяных инфекций
- •Возбудитель туляремии
- •Возбудители риккетсиозов
- •Глава 15. Возбудители инфекционных болезней наружных покровов
- •Возбудители грибковых инф кций
- •Глава 16. Общие черты зоонозных инфекций
- •Глава 17. Онкогенные вирусы
- •Глава 18. Медленные вирусные инфекции
- •9Теории 210
Рост и размножение бактерий
Жизнедеятельность бактерий характеризуется ростом — формированием структурно-функциональных компонентов клетки иб
Р
а
ис. 3.1. Ультратонкие срезы делящихся бактерий. Электронограмма.а — врастание перегородки деления у стафилококка, б — образование перетяжки у кишечной палочки (указано стрелками).
увеличением самой бактериальной клетки и размножением — самовоспроизведением, приводящим к увеличению количества бактериальных клеток в популяции.
Бактерии размножаются бинарным делением пополам, реже почкованием. Актиномицеты, как и грибы, могут размножаться' спорами. Актиномицеты, являясь ветвящимися бактериями, размножаются также путем фрагментации нитевидных клеток. Грамположительные бактерии делятся путем врастания синтезирующихся перегородок деления внутрь клетки, а грамотрицательные — путем перетяжки в результате образования гантелевидных фигур из которых затем образуются две одинаковые клетки (рис.3.1).
Делению клеток предшествует репликация бактериальной хромосомы по полуконсервативному типу: двунитевая цепь ДНК раскрывается и каждая нить достраивается комплементарной нитью. Это приводит к удвоению молекул ДНК бактериального ядра - нуклеоида. Репликация хромосомной ДНК осуществляется от начальной точки on (от англ. origin — начало). Хромосома бактериальной клетки связана в области ori с цитоплазматической мембраной. Репликация ДНК катализируется ДНК полимеразами. Сначала происходит раскручивание (деспирализация) двойной цепи (нити) ДНК, в результате чего образуется репликативная вилка (разветвленные цепи): одна из цепей, достраиваясь, связывает нуклеотиды от 5'- к З'-концу, другая достраивается посегментно.
Репликация ДНК осуществляется в 3 этапа: инициация, элонгация (рост цепи) и терминация. Образовавшиеся в результате репликации две хромосомы расходятся, чему способствует увеличение размеров растущей клетки: прикрепленные к цитоплазматической мембране или ее производным (например, мезосо-
Рис.
3.2. Фазы размножения бактерий.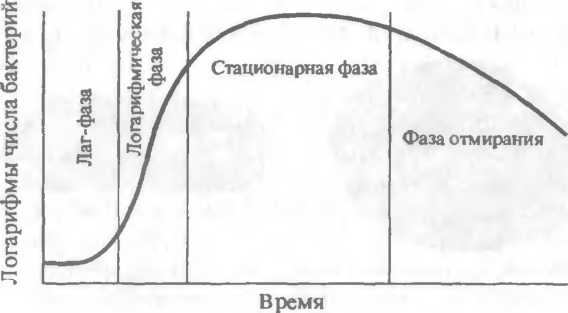
мам) хромосомы по мере увеличения объема клетки удаляются друг от друга. Окончательное их обособление завершается образованием перетяжки (или перегородки) деления. Клетки с перегородкой деления расходятся в результате действия аутоли- тических ферментов, разрушающих сердцевину перегородки. Аутолиз при этом может происходить неравномерно: делящиеся клетки на одном участке остаются связанными частью клеточной стенки в области перегородки деления. Такие клетки располагаются под углом друг к другу, что характерно для дифтерийных коринебактерий.
Размножение бактерий в жидкой питательной среде. Бактерии, засеянные в определенный, но не изменяющийся объем жидкой питательной среды, размножаясь, потребляют питатетьные элементы, что в дальнейшем приводит к истощению питательной среды и прекращению роста бактерий. Культивирование бактерий в такой системе называют периодическим, а культуру — периодической. Если же условия культивирования поддерживаются путем непрерывной подачи свежей питательной среды и оттока такого же объема культуральной жидкости, то такое культивирование называется непрерывным, а культура — непрерывной.
При выращивании бактерий на жидкой питательной среде наблюдается придонный, диффузный или поверхностный (в виде пленки) рост культуры.
Рост периодической культуры бактерий подразделяют на несколько фаз, или периодов: 1) лаг-фаза;
фаза логарифмического роста; 3) фаза стационарного роста, или максимальной концентрации бактерий; 4) фаза гибели бактерий.
Эти фазы можно изобразить графически в виде отрезков кривой размножения бактерий, отражающей зависимость логарифма числа живых клеток от времени их культивирования (рис.3.2).Лаг-фаза (от англ. lag — запаздывание) — период между посевом бактерий и началом их размножения. Продолжительность лаг фазы составляет в среднем 4—5 ч. Бактерии при этом увеличиваются в размерах и готовятся к делению, повышается количество нуклеиновых кислот, белка и других компонентов клетки. Фаза логарифмического (экспоненциального) роста является периодом интенсивного деления бактерий продолжительностью около 5—6 ч. При оптимальных условиях роста бактерии могут делиться каждые 20—40 мин (время генерации — интервал между делениями клетки). Во время этой фазы бактерии наиболее ранимы, что объясняется высокой чувствительностью интенсивно растущей клетки к ингибиторам синтеза белка, нуклеиновых кислот и др. Затем наступает фаза стационарного роста, при которой количество жизнеспособных клеток остается без изменений, составляя максимальный уровень (М-кон- центрация). Ее продолжительность выражается в часах и колеблется в зависимости от вида бактерий, особенностей их культивирования. Рост бактерий завершается фазой гибели, характеризующейся отмиранием клеток в условиях истощения источников питательной среды и накопления в ней продуктов метаболизма бактерий. Продолжительность этой фазы колеблется от десятков часов до нескольких недель. Интенсивность роста и размножения бактерий зависит от многих факторов, в том числе от оптимального состава питательной среды, окислительно-восстановительного потенциала, pH, температуры и др.
Если к бактериям постоянно добавлять питательную среду и одновременно удалять продукты обмена, можно поддерживать бактериальную культуру в логарифмической фазе роста. Для этого применяют хемостат.
Размножение бактерий на плотной питательной среде. Бактерии, растущие на плотных питательных средах, образуют изолированные колонии округлой формы с ровными или неровными краями различной консистенции и цвета, зависящего от пигмента бактерий.
Пигменты, растворимые в воде, диффундируют в питательную среду и окрашивают ее, например синегнойная палочка (Pseudomonas aeruginosa) окрашивает среду в синий цвет. Другая группа пигментов нерастворима в воде, но растворима в органических растворителях. Так колонии «чудесной палочки» имеют кроваво- красный пигмент, растворимый в спирте. И, наконец, существуют пигменты, нерастворимые ни в воде, ни в органических соединениях.
Наиболее распространены среди бактерий такие пигменты, как каротины, ксантофиллы и меланины. Меланины являются нерастворимыми пигментами черного, коричневого или красного цвета, они синтезируются из фенольных соединений. Меланины наряду с каталазой, супероксиддисмутазой и пероксида- зой защищают микробы от воздействия токсичных перекисных радикалов кислорода. Многие пигменты обладают антимикробным, антибиотикоподобным действием.
Вид, форму, цвет и другие особенности колоний на плотной питательной среде (культуральные свойства) учитывают при идентификации бактерий, а также отборе колоний для получения чистых культур.
В промышленных условиях при получении биомассы микроорганизмов с целью приготовления антибиотиков, вакцин, диагностических препаратов и эубиотиков культивирование в основном осуществляют в ферментерах при строгом соблюдении оптимальных параметров для роста и размножения культур (см. главу 6).
1.6. Культивирование бактерий
Бактерии выращивают на естественных и искусственных питательных средах. Естественные среды (молоко, сусло-агар, сиропы и др.) имеют несбалансированное соотношение компонентов, их состав полностью не изучен. Искусственные питательные среды включают вещества в строго определенных соотношениях с учетом потребностей данного вида в питательных веществах, ростовых добавках, солях и т.п.
Питательные среды должны быть стерильными и иметь, помимо необходимых для роста бактерий компонентов, оптимальные значения pH, окислительно-восстановительного потенциала, осмотического давления и т.д. Среды различаются в зависимости от консистенции, состава и назначения: по консистенции — плотные, полужидкие и жидкие; по составу — простые, сложные органические и синтетические (искусственные); по назначению — специальные, элективные и дифференциально-диагностические.
Основой плотной питательной среды являются гелеобразные вещества: агар-агар (2—3 %), желатин (10—15 %) и др. Эти компоненты добавляют к жидким питательным средам, например, к мясопептонному бульону (МПБ), получая таким образом мясопептонный агар (МПА). Эти простые питательные среды применяют для выращивания многих бактерий. Сложные питательные среды включают дополнительные компоненты — сыворотку крови (сывороточный агар), кровь (кровяной агар), сахар (сахарный бульон) и т.д. Их используют для выявления свойств бактерий, т.е. это специальные питательные среды. Например, на кровяном агаре бактерии, продуцирующие гемолизин, обра- зуют колонии с зоной гемолиза.
Определенные виды бактерий выделяют, используя элективные (избирательные) среды. Например, элективной средой для стафилококков является желточно-солевой агар (ЖСА), для холерного вибриона — щелочный МПА, для дифтерийной палочки — свернутая сыворотка
Для выделения некоторых бактерий, рост которых может подавляться сопутствующими микробами, используют среды обогащения. Так, для выделения сальмонелл и шигелл из фекалий применяют селенитовый бульон, подавляющий рост сопутствующей микрофлоры — кишечной палочки.
Дифференциально-диагностические среды (Гисса, Эндо, Левина, Плоскирева и др.) предназначаются для дифференцирования бактерий. Они содержат индикатор, меняющий свой цвет при изменении pH в результате расщепления ферментами углеводов питательных сред.
Имеются питательные среды, сочетающие свойства дифференциально-диагностических и других питательных сред. Так, с помощью среды Плоскирева (как и среды Эндо) можно отличить кишечную палочку от дизентерийной по их действию на лактозу. Кишечная палочка, расщепляя лактозу с кислотообра- зованием, при росте дает колонии красного цвета (цвет индикатора) в отличие от дизентерийной палочки, не расщепляющей лактозу. Наличие же в среде Плоскирева солей желчных кислот способствует преимущественному росту дизентерийной палочки, а бриллиантового зеленого — ведет к подавлению сопутствующих грамположительных бактерий.
Большинство патогенных и условно-патогенных бактерий растет в термостате при температуре 37 °С. Рост на питательных средах обычно учитывают через сутки после посева. Рост некоторых возбудителей (туберкулеза, бруцеллеза) становится видимым через 15—30 дней. Скорость роста бактерий зависит от их биологических свойств и условий культивирования (температура, наличие или отсутствие кислорода, углекислого газа, давление и др.). Аэрация способствует ускоренному росту аэробов С этой целью используют шюттель-аппараты (<встряхиватели»). Для культивирования анаэробов применяют специальные питательные среды (среда Китта—Тароцци, тиогликолевая среда, связывающие кислород), которые перед посевом кипятят для удаления растворенного кислорода
Применяют также физические, химические и биологические методы культивирования анаэробов. Физический метод заключается в удалении из аппарата или эксикатора воздуха и замене его газовой бескислородной смесью. Химический метод основан на применении химических поглотителей кислорода. Биологический метод Фортнера предусматривает одновременный посев на одну половину чашки Петри аэробных и на другую половину — анаэробных бактерий, после чего чашку с посевом герметизируют парафином. При этом аэробы, используя при своем росте кислород, создают условия для дальнейшего роста анаэробов.
Выросшие на питательных средах бактерии идентифицируют по типу колоний на твердых питательных средах и характеру роста на жидких питательных средах. На жидких средах бактерии образуют пленку на поверхности среды, наблюдается придонный рост или равномерное помутнение среды.
Принципы промышленного культивирования бактерий изложены в главе 6.
Особенности культивирования риккетсии и хламидий
Риккетсии и хламидии — грамотрицательные мелкие бактерии, являющиеся, как и вирусы, облигатными внутриклеточными паразитами; размножаются в цитоплазме и ядре инфицированных клеток. Они не растут на искусственных питательных средах, используемых для культивирования обычных бактерий.
Для культивирования риккетсий и хламидий применяют куриные эмбрионы, культуры клеток с пониженным метаболизмом, а также чувствительных животных Риккетсии можно культивировать путем инфицирования ими переносчиков возбудителей инфекций — вшей, блох, клещей.
Выделение чистых культур бактерий
Объекты окружающей среды, включая и материал от больного (гной, мокрота, фекалии и др.), обычно содержат смесь различных микробов. С целью их обнаружения и определения видовой принадлежности (идентификация) применяют бактериологическое исследование (бактериологический метод), которое заключается в посеве проб исследуемого материала на питательные среды для получения (выделения) чистой культуры.
Для выделения чистой культуры, которое производят поэтапно в течение нескольких дней, в начале его используют механическое разобщение бактерий на плотных питательных средах (посев штрихом, шпателем на несколько чашек Петри и др.). На следующий день получают отдельные изолированные колонии. Колония — скопление бактерий, ведущее начало от одной клетки, а поэтому представляющее собой чистую культуру.
После описания культуральных свойств различных типов колоний (размер, цвет, форма, края и др.), выросших на чашке с плотной питательной средой, делают пересев из каждого типа колоний на скошенный агар для накопления чистой культуры. Выросшую на 3-й день чистую культуру (после проверки ее чистоты путем микроскопирования) начинают идентифицировать по различным свойствам — морфологическим, тинктори- альным, ферментативным, антигенным и др
Существуют способы выделения чистых культур, основанные на обработке исследуемого материала с помощью физических или химических факторов, обладающих избирательным действием на определенные бактерии. Для выделения чистых культур используют также способность некоторых бактерий быстро размножаться в организме восприимчивых к ним лабораторных животных.
При выделении чистых культур анаэробов посевы исследуемого материала производят в анаэробных условиях на специальные среды с пониженным редокс-потенциалом, а также используют специальные аппараты (например, анаэростаты), исключающие доступ свободного кислорода к растущей культуре.
