- •Методология исследований при моделировании свойств и качественных характеристик изделия
- •1.1 Словарь основных понятий и определений системного анализа
- •Алгоритм системного анализа технического объекта (изделия)
- •1.4 Суждение как форма экспертного заключения.
- •1.4 Метод расчета точности функционального свойства при анализе технического устройства
- •2 Химические и физические связи реальных тел
- •2.1 Общие сведения о химических связях.
- •2.2 Физико-химические модели структурообразования при кристаллизации и коагуляции синтетических систем.
- •3.1 Отклик на внешнее механическое воздействие
- •1.8 Классификация по физико-механическим и технологическим свойствам
- •4. Деформация реальных твердых тел
- •Общие сведения о твёрдых телах.
- •5. Напряжение и деформация
- •5.1 Теория упругих напряжений
- •5.2 Чистый сдвиг (упругие деформации)
- •5.3 Теория пластичных деформаций
- •4. Упругие материалы
- •4.1. Введение. Определения
- •4.2. Линейные упругие (гуковские) материалы
2 Химические и физические связи реальных тел
Основной вопрос современной научной деятельности человека в нано-технологиях синтеза новых материалов и нанотехнологиях переработки материалов - учение о химической связи. Без него нельзя понять причин многообразия химических соединений, механизма их образования, строения и реакционной способности.
2.1 Общие сведения о химических связях.
В соответствии с атомистическими представлениями физические тела есть совокупность частиц (атомов или молекул), которые удерживаются друг возле друга силами взаимного (межатомного) притяжения.
Химические связи, зависящие от электронной структуры материала, непосредственно определяют структуру реального тела и его свойства. Представленные здесь пять видов связи изображены весьма условно; для большинства материалов характерна комбинация различных видов связи.
Аморфная структура. Пространственное расположение частиц в твёрдом теле может быть полностью или частично беспорядочным, случайным. В соответствии с беспорядочным пространственным расположением частиц направление главных сил взаимодействия также не имеет строго определённой доминирующей направленности. Такие тела называют аморфными; к ним относятся многие стёкла, фарфор, некоторые пластмассы и подобные им материалы. Энергетические силы взаимного притяжения частиц (атомов или молекул), образующих твёрдое тело (кристаллическое или аморфное), "замкнуты" внутри этого тела на соседние атомы или молекулы.
Кристаллическая структура. Пространственное расположение частиц может быть строго упорядоченным, так что мысленно их можно совместить с узлами некоторой воображаемой пространственной системы атомов, в которой главные силы взаимодействия частиц направлены вдоль линий, соединяющих соседние узлы решетки. Такие тела называют кристаллами или кристаллическими, а пространственное расположение частиц в телах – кристаллической решеткой; к ним относятся все металлы и множество минералов.
Можно представить себе, что у частиц, образующих самый внешний поверхностный слой тела, часть этих сил остаётся неиспользованной, нескомпенсированной, так как с внешней стороны частица не имеет соседей. Нескомпенсированная соседями свободная "связь" каждой поверхностной частицы даёт вклад в общую энергию свободной поверхности тела, или в поверхностную энергию. Чем ниже эта нескомпенсированная сила – "связь", тем легче при прочих равных условиях разрушилось бы тело по такой поверхности. Физическую модель разрушения при напряженном состоянии и механизм разрушения для хрупких тел предложил Гриффитс в 1920 году на основе энергетических представлений о хрупком разрушении. Рост трещины сопровождается освобождением упругой энергии напряженного тела.
Гриффитс пришел к выводу, что разрушение произойдет, когда при бесконечно малом удлинении трещины С выделится энергия Q F, т.е. больше чем энергия F новых свободных поверхностей растущей трещины (F – суммарная площадь двух полуповерхностей трещины, - энергия единицы свободной поверхности трещины). Благодаря этому избытку энергии скорость освобождения упругой энергии напряженного тела при росте трещины как раз достаточна, чтобы уравновесить скорости связывания её при образовании новой свободной поверхности трещины. Таким образом, пока избыток энергии напряженного тела существует, возможен процесс самопроизвольного распространения трещины.
Ионная связь. |
Ионная связь образуется между ионами — положительно или отрицательно заряженными атомами: противоположно заряженные ионы притягиваются друг к другу. |
Ковалентная связь |
Ковалентная связь. При ковалентной связи пары атомов имеют общие электроны на внешних оболочках. |
Металлическая связь |
Металлическая связь. В металлах все электроны на внешних оболочках являются общими для всех атомов; они свободно передвигаются в кристаллической решетке, благодаря чему металлы являются хорошими проводниками электрического тока. |
Ван-дер-Ваальсова связь |
Ван-дер-Ваальсова связь характеризуется слабым взаимным притяжением соседних нейтральных атомов или молекул. |
Водородная связь |
Водородная связь. Слабая водородная связь образуется благодаря наличию общего для двух молекул атома водорода. |
|
|
Межмолекулярное взаимодействие. Взаимодействие между электрически нейтральными молекулами или атомами, определяет отличие реальных газов от идеальных, определяет существование жидкостей и молекулярных кристаллов, и проявляется в разнообразных физических явлениях. Межмолекулярное взаимодействие зависит от расстояния r между молекулами и, как правило, описывается потенциальной энергией взаимодействия U(r) т.к. именно средняя потенциальная энергия взаимодействия определяет состояние и многие свойства вещества.
Впервые для объяснения свойств реальных газов и жидкостей Ван-дер-Ваальс предположил, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. На основе этих представлений, даже не рассматривая количественной зависимости межмолекулярного взаимодействия от расстояния, он получил уравнение состояния реального газа:
(P + a/ʋ2) (V – b) = RT |
|
где р - давление газа; Т – его температура; V- объем одного моля вещества; R- универсальная газовая постоянная; a и b – константы, учитывающие отклонение свойств реального газа от свойств идеального.
Компонент уравнения a/V2 , имеющий размерность давления, учитывает притяжение между молекулами газа за счет Ван-дер-ваальсовых сил. Константа b является поправкой на собственный объем молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. Уравнение Ван-дер-Ваальса является приближенным и количественно описывает свойства реальных газов лишь в области высоких температур и низких давлений.
Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания. Эти силы определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От них зависят многие структурные, спектральные и другие свойства веществ.
Основу Ван-дер-ваальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система. Ван-дер-Ваальсовы силы заметно уступают химическому связыванию. Например, силы удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Ориентационное взаимодействие. Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HСl, H2O, NH3 , ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение.
Для взаимодействия двух диполей энергия притяжения между ними (энергия Кеезома) выражается соотношением:
ЕК = -2μё μ2 / 4π ε0 r3, |
|
где μё и μ2 – дипольные моменты взаимодействующих диполей, r – расстояние между ними. Притяжение диполь-диполь может осуществляться только тогда, когда энергия притяжения превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода).
Индукционное взаимодействие. Если рядом с полярной молекулой окажутся неполярные, то она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем полярные молекулы.
Энергия притяжения между постоянным и наведенным диполем (энергия Дебая) определяется выражением:
ЕД = -2 μнав2 γ / r6, |
|
где μнав – момент наведенного диполя.
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться сосредоточенными с одной стороны молекулы, т.е. неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи. Энергия такого взаимодействия (энергия Лондона) определяется через соотношения:
ЕЛ = -2 μмгн2 γ2 / r6, |
|
где μмгн – момент мгновенного диполя.
Лондоновские силы притяжения между неполярными частицами (атомами, молекулами) являются весьма короткодействующими. Значение энергии такого притяжения зависят от размеров частиц и числа электронов в наведенных диполях. Эти связи очень слабые – самые слабые из всех межмолекулярных взаимодействиях. Однако они являются наиболее универсальными, так как возникают между любыми молекулами.
Межмолекулярное отталкивание. Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться. Энергия отталкивания определяется выражением:
Е = + k / rn |
|
где k – постоянная отталкивания, n – принимает различные целые значения (…15). Силы межмолекулярного отталкивания действуют на очень малых расстояниях. Общее уравнение межмолекулярного взаимодействия при постоянной температуре (уравнение Леннарда – Джонсона) в большинстве случаев имеет вид:
ЕМ = - а / r6 + b / r12 |
|
и носит название «потенциала 6-12». Поскольку энергия притяжения пропорциональна 1 /r6 , а энергия отталкивания 1/r12.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное условие устойчивее, чем атомное. Учение о химической связи атомов объясняет механизм образования молекул, а также природу химической связи. Химическая связь образуется за счет валентных электронов, но осуществляется она по-разному. Различают три основных типа химических связей: ковалентную, ионную и металлическую.
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода:
Н + Н = Н2; ΔН= - 436 кДж/моль.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1ѕ-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей). В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение плотности отрицательного заряда благоприятствует сильному возрастанию сил притяжения между ядрами молекулярным облаком.
Особый тип нековалентной связи – водородная связь – имеет в биохимии исключительно важное значение. В образовании водородной связи принимают участие атомы водорода ОН-, NH- и SH- групп (так называемых доноров водородной связи), которые взаимодействуют со свᐾгодной парой электронов атомов-акцепторов (например, - N†или S). Энергия водородной связи составляет 10…40 кДж/моль, что значительно меньше энергии ковалентной связи (>400 кДж/моль). Однако многочисленные водородные связи вносят существенный вклад в стабилизацию структуры макромолекул.
Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образование молекулы Н2) это расстояние составляет 0,074 нм. Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей.
Образование
химической связи между атомами является
результатом взаимопроникновением
(«перекрывания») электронных облаков,
происходящего при сближении
взаимодействуюших атомов. Вследствие
такого взаимопроникновения плотность
отрицательного электрического заряда
в межъядерном пространстве возрастает.
Положительно заряженные ядра атомов
притягиваются к области перекрывания
электронных облаков. Это притяжение
преобладает над взаимным отталкиванием
одноименно заряженных электронов, так,
что в результате образуется устойчивая
молекула. Такая электронная и ядерная
(двухцентровая) связь называется
ковалентной связью. Теория химической
связи разработанная на этой основе
получила название метода валентных
связей (метод ВС). Метод валентных связей
дает теоретическое объяснение важнейших
свойств ковалентной связи, что позволило
понять строение большого числа молекул.
Для обозначения расстояний между атомами
в молекуле используется понятие
ковалентный радиус. Длина простой связи
является величиной аддитивной: она
примерно равна сумме ковалентных
радиусов двух атомов. Двойная связь на
10…20% короче простой связи. В последнее
время атомные радиусы и расстояние
между атомами принято выражать в
пикометрах (пм. 1пм = ![]() м).
Ранее длину связей представляли в
ангстремах (Å, 1 Å == 100пм).
м).
Ранее длину связей представляли в
ангстремах (Å, 1 Å == 100пм).
Межатомное притяжение и отталкивание можно рассмотреть на примере двухатомной молекулы. Такая молекула состоит из двух положительно заряженных ядер и некоторого числа электронов. Устойчивому состоянию молекулы соответствует минимум потенциальной энергии системы. Этот минимум появляется в результате равновесия между отталкиванием двух положительно заряженных ядер и притяжением электронов к ядрам, обусловливающим связь. Отталкивание проявляется на малых расстояниях между ядрами r, но очень быстро растет при дальнейшем уменьшении r. Притяжение слабее зависит от r и действует на больших расстояниях. Результат сложения этих двух сил изображен схематически на рис. 2.1. При стремлении r к бесконечности сила притяжения асимптотически стремится к нулю. За нуль потенциальной энергии принимается потенциальная энергия двух атомов, отстоящих друг от друга на бесконечно большое расстояние. В действительности сила притяжения проявляется лишь на расстоянии в несколько ангстрем (1Å = 10-8 см).
В энергетической модели связи двух атомов системы два атома взаимодействуют так. Один атом жестко закреплен на вертикальной оси, в то время как другой колеблется около положения минимума на кривой, так что межатомное расстояние меняется в соответствии с ходом кривой. Колебательная энергия квантуется: это изображено горизонтальными линиями с колебательным квантовым числом ʋ = 0, 1, 2… .При небольших отклонениях атомов от положения равновесия, определяемых минимумом на кривой, возвращающая сила пропорциональна смещению, и атомы совершают колебания, которые можно рассматривать как простое гармоническое движение по закону Гука. Поэтому нижняя часть кривой имеет форму параболы. При больших колебательных энергиях сжать молекулу становится труднее, чем вытянуть, и кривая уже не является параболой – колебания становятся ангармоническими. При достаточно больших значениях колебательной энергии молекула диссоциирует. Гипотетическое межъядерное расстояние, соответствующее минимуму на кривой, известно как равновесное межъядерное расстояние re. Это определяет структуру и размеры молекул.
Часто, особенно в органической химии, ковалентную связь изображают черточкой (штрихом) (например, Н - Н), которая символизирует пару электронов. Одинарная связь изображается одной черточкой (штрихом), двойная – двумя, тройная – тремя. Черточка между двумя атомами показывает, что у них пара электронов обобщена, в результате чего и образовалась химическая связь. С помощью таких черточек изображают структурные формулы молекул.
Определенную сложность при оценке равновесных межъядерных расстояний имеют соединения с ионными и ковалентными связями. Прежде всего, такие соединения построены из атомов различных элементов. Размеры а следовательно, и вклад этих атомов в межатомные расстояния, также различны. Есть и другие факторы, влияющие на межатомные расстояния. К их числу относятся заряд иона, окислительное число каждого атома, тип кристалла и координационные числа каждого атома, относительные электроотрицательности атомов (способность атома в соединениях притягивать к себе электроны) и степень ионности или ковалентности связи. Большинство ионных кристаллов типа АХ имеют структуру хлористого цезия, (объемноцентрированная кристаллическая решетка) для координационного числа 8, хлористого натрия для координационного числа 6 или цинковой обманки для координационного числа 4. Тип получаемой структуры зависит от величины отношения радиуса катиона к радиусу аниона.
В
зависимости от положения в периодической
системе химические элементы обладают
различной способностью притягивать
дополнительные электроны. Такое свойство
– электроотрицательность – выражается
в условных единицах. Чем выше число
электроотрицательности , тем большей
способностью притягивать электроны
обладает химический элемент. При
взаимодействии двух различных атомов
пара электронов смещается в сторону
более электроотрицательного атома,
образуя поляризованную ковалентную
связь. Мерой поляризуемости химической
связи является величина дипольного
момента (единица измерения: дебай, 1Д =
3,3·![]() Кл·м).
Кл·м).
Среди важных в биохимическом отношении элементов наиболее электроотрицательным является кислород, а наиболее поляризованной – двойная связь карбонильной группы С=О. Образующийся на углеродном атоме частичный положительный заряд облегчает часто встречающиеся в биохимических реакциях нуклефильное замещение по карбонильной группе.
В случае ковалентных соединений следует учитывать также кратность связи. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
Соединения с чисто ковалентными связями встречаются сравнительно редко, так как чисто ковалентные связи реализуются только между атомами одного и того же элемента, например углерода или кремния. Ковалентными кристаллами можно назвать такие соединения, которые имеют полимерную структуру с направленными связями, как в углероде и кремнии. Многие соединения, состоящие из различных элементов, имеют ковалентный характер, в особенности если электроотрицательности элементов отличаются не слишком сильно.
Ионные соединения образуют атомы элементов, резко отличных по электроотрицательности, например атомы элементов главных подгрупп I и II групп с элементами главных подгрупп VI и VII групп. Ионных соединений сравнительно немного. Например, молекулы хлорида натрия NaCl существуют только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из равномерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют.
Ковалентная связь является более общим типом химической связи. Теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владение одного из соединяющихся атомов.
Все вещества, в том числе и инертные газы, переходят в твердое состояние и образуют кристаллы при достаточном понижении температуры. Такие кристаллы, если они образованы из молекул, мягки и являются изоляторами. Температура плавления у них значительно ниже, чем у большинства ионных, ковалентных или металлических твердых веществ.
Возможность полного отверждения этих соединений является доказательством существования особого типа когезионных сил, удерживающих молекулы в определенном положении в кристалле. Очевидно также, что эти силы сами по себе относительно слабы. Наличие таких сил проявляется в том, что все соединения в газообразном состоянии ведут себя как неидеальные газы, и учитывается, в частности, членом a/ʋ2 в уравнении состояния Ван-дер-Ваальса, а силы называют вандер-ваальсовыми.
Учет этих сил более важен при рассмотрении молекулярных твердых соединений, чем жидкостей. Тем не менее они играют чрезвычайно важную роль в процессе образования жидкой конденсированной фазы и ответственны за эффекты поверхностного натяжения.
В молекулярных кристаллах расстояние между ближайшими соседними несвязанными атомами определяется равновесием между силами притяжения Ван-дер-Ваальса и силами отталкивания, возникающими в результате взаимного пепекрывания электронных облаков. Половина такого равновесного межъядерного расстояния между парой одинаковых атомов называется ванн-дер-ваальсовым радиусом данного атома. Таким образом, ванн-дер-ваальсовы радиусы определяют кратчайшее расстояние, на которое могут приблизиться друг к другу атомы без образования химической связи. Ван-дер-ваальсов радиус фактически определяет физические размеры атомов.
Имеются три основных источника ванн-дер-ваальсовых сил: дисперсионные силы; ориентационное, или дипольное, взаимодействие; силы Дебая, или индукционные силы.
Дисперсные силы появляются в результате взаимодействия между мгновенными (наведенными) диполями, но не между постоянными диполями. Пусть в какой-то момент времени возникло неравномерное распределение электронов в молекуле, так что молекула стала обладать диполем и дипольным моментом. Этот диполь индуцирует подобный диполь в соседних молекулах, и отрицательный конец «исходного « диполя будет притягиваться положительным концом диполя в соседней молекуле. Эти силы притяжения составляют дисперсионные силы. В следующий момент времени электронное распределение изменится, так что в среднем электроны в молекуле будут распределены равномерно.
Химические связи биомолекул. Большинство биомолекул - это соединения углерода с водородом, кислородом, азотом или фосфором. Устойчивые ковалентные связи между этими атомами неметаллов образуются в результате перекрывания определенных орбиталей двух атомов и формирования молекулярных орбиталей, на которых располагаются по одному электрону от каждого атома. Так, четыре валентных электрона атома углерода занимают атомные орбитали 2s и 2p.
2s
– Орбиталь имеет форму шара (шаровая
симметрия), а три 2р- орбитали – форму
гантелей вытянутых вдоль осей x, y , z.
Следовало ожидать , что атомы углерода
будут образовывать по крайней мере две
различные молекулярные орбитали. Однако
в действительности все четыре связи
эквивалентны за счет гибридизации
орбиталей. Благодаря суммированию
энергий одной s- и трех р-орбиталей атом
углерода образует черыре равноценные
s![]() -
атомные орбитали направленные по осям
тетраэдра (s
-
атомные орбитали направленные по осям
тетраэдра (s![]() -гибридизация).
Перекрывание таких орбиталейс 1s-
орбиталями атомов водорода приводит к
образованию четырех σ-молекулярных
орбиталей. Это означает, что валентность
атома углерода равна четырем, а в молекуле
метана (C
-гибридизация).
Перекрывание таких орбиталейс 1s-
орбиталями атомов водорода приводит к
образованию четырех σ-молекулярных
орбиталей. Это означает, что валентность
атома углерода равна четырем, а в молекуле
метана (C![]() )
имеются четыре простые (одинарные)
ковалентные связи. По такому принципу
образуются простые связи между другими
атомами. Так, фосфат-анион и катион
аммония также имеют тетраэдрическую
форму.
)
имеются четыре простые (одинарные)
ковалентные связи. По такому принципу
образуются простые связи между другими
атомами. Так, фосфат-анион и катион
аммония также имеют тетраэдрическую
форму.
Встречается
тип связи образованной за счет
гибридизации 2s-орбитали только с двумя
из трех 2р-орбитали (s![]() -гибридизация).
В результате формируются три эквивалентные
гибридные s
-орбитали,
расположенные в одной плоскости под
углом 12
-гибридизация).
В результате формируются три эквивалентные
гибридные s
-орбитали,
расположенные в одной плоскости под
углом 12![]() .
Оставшаяся 2
.
Оставшаяся 2![]() -орбиталь
располагается перпендикулярно плоскости.
При формировании молекулярных орбиталей
такие атомы могут образовывать два
различных типа связей: три s
-орбитали
образуют σ-связи, а электроны двух
2
-орбиталей
от двух атомов, т.е. π-электроны, - вытянутую
молекулярную π-орбиталь над и под
плоскостью, занимаемой σ-связями. Этот
тип связи носит название двойной связи.
Двойные связи состоят из одной σ- и одной
π-связей. Такой тип связи образуется
лишь при наличии s
-гибридизации
у двух атомов , принимающих участие в
ее образовании. В отличие от простой
связи вращение вокруг двойных связей
невозможно, поскольку это должно вызвать
разрушение π-орбиталей. Поэтому атомы
при двойной связи лежат в одной плоскости,
что в свою очередь делает возможным
существование цис- и транс- изомеров.
-орбиталь
располагается перпендикулярно плоскости.
При формировании молекулярных орбиталей
такие атомы могут образовывать два
различных типа связей: три s
-орбитали
образуют σ-связи, а электроны двух
2
-орбиталей
от двух атомов, т.е. π-электроны, - вытянутую
молекулярную π-орбиталь над и под
плоскостью, занимаемой σ-связями. Этот
тип связи носит название двойной связи.
Двойные связи состоят из одной σ- и одной
π-связей. Такой тип связи образуется
лишь при наличии s
-гибридизации
у двух атомов , принимающих участие в
ее образовании. В отличие от простой
связи вращение вокруг двойных связей
невозможно, поскольку это должно вызвать
разрушение π-орбиталей. Поэтому атомы
при двойной связи лежат в одной плоскости,
что в свою очередь делает возможным
существование цис- и транс- изомеров.
Изомерами называются вещества одинакового состава (т.е. имеющие одинаковую суммарную формулу), но, обладающие различными физическими и химическими свойствами. Если изомеры различаются порядком связи атомов, говорят о структурной изомерии (например, цитрат и изоцитрат).
Вращение вокруг двойной связи невозможно; поэтому заместители при атомах связанных двойной связью могут принимать две возможных ориентации. Так, например, карбоксильные группы в соединениях цитратного цикла располагаются по разные стороны от плоскости двойных связей (транс-расположение)- фумаровая кислота. Карбоксильная группа, расположенная по одну сторону от плоскости двойной связи (цис-положение) – малеиновая кислота. Цис-транс-Изомеры различаются по физическим и химическим свойствам, так они имеют различные температуры плавления и константы диссоциации. Переход от одного изомера к другому возможен лишь с помощью химических реакций.
Изомеры, образующиеся за счет свободного вращения вокруг простых связей носят название конформеров. Небольшие молекулы могут принимать в растворе множество конформаций. Макромолекулы, такие как белки и нуклеиновые кислоты, имеют вполне определенные конформации, стабилизированные благодаря внутримолекулярным взаимодействиям.
Ориентационные силы возникают только при взаимодействии молекул, обладающих постоянным диполем или постоянным электрическим мультидиполем. Ориентационные силы являются результатом притяжения разноименных концов двух диполей разных молекул.
Дебаевские, или индукционные, силы возникают тогда, когда постоянный диполь одной молекулы индуцирует диполь в соседней молекуле.
Ван-дер-ваальсовы радиусы накладывают ограничения не только на межмолекулярные контакты, но и на внутримолекулярные контакты. Этот факт имеет особое значение при определении конформации, т.е. относительного расположения в пространстве атомов и целых групп атомов, входящих в состав сложных органических молекул. Валентные углы в первую очередь определяются типом орбиталей, участвующих в образовании связи, но на них оказывает влияние различие электроотрицательностей различных атомов. Например, нормальные тетраэдрические валентные углы, образующиеся при sp3- гибридизации атома углерода, равны 109028ʹ. Однако если атом углерода связан с атомами или группами атомов с сильно отличающимися Ван-дер-Ваальсовыми радиусами, то появляются стерические искажения этого угла. В случае sp2 – гибридизации для атома углерода валентные углы равны обычно 1200. В первом приближении вокруг простой связи возможно свободное вращение.
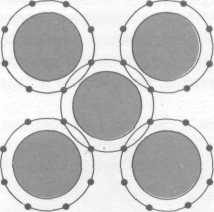
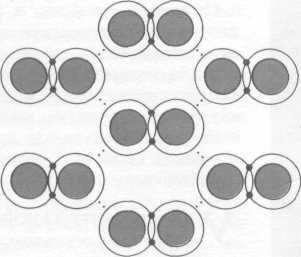
Фазовые контакты образуются при спекании и прессовании порошков, твердении цементов и бетонов, полуводного гипса и др. В фазовых контактах сцепление частиц обеспечивается возникновением нескольких сотен межатомных связей на участке с характерным размером, существенно превышающем линейные размеры (10-6…10-7м) элементарной кристаллической ячейки. Прочность фазовых контактов (10-7Н) превосходит прочность коагуляционных контактов, сопровождается появлением сначала агрегатов частиц и повышением вязкости системы, затем вязкость скачком возрастает на несколько порядков при формировании сплошной структурной сетки.
Возникновение сплошной структуры характеризуется появлением у системы предельного напряжения сдвига. Количественно структурообразование характеризует прочность структуры, которая определяется силой сцепления частиц в контакте, числом контактов в единице объема, дисперсностью, формой частиц – топологией и параметрами образующейся структуры.
Прочность реальных материалов из-за дефектов их кристаллической структуры значительно ниже прочности идеальных монокристаллов. Если диспергировать материал до частиц, размеры которых соизмеримы с размерами дефектов структуры (наноразмеры), то прочность таких высокодисперсных частиц будет близка к прочности идеальных твердых тел.
Отсюда возникла идея о повышении прочности материалов путем их измельчения (диспергирования механически, физически и химически) с последующим уплотнением, спеканием, свариванием дисперсных порошков.
Широкие возможности создания новых материалов открываются на основе композиций из неорганических веществ и полимеров органических соединений. Например, резины, состоящие из вулканизированных каучуков и сажи, масса которой достигает 50% массы резины. Каучук, сажа, сера – это вещества, из которых создается материал определенной структуры. В зависимости от соотношения компонентов и от распределения серы и сажи в каучуке можно получать резины с разнообразными свойствами.
Структурные связи между атомами и молекулами веществ могут быть обратимыми по прочности. Связи самопроизвольно восстанавливаются после разрушения – (тиксотропия), непосредственными атомными контактами в порошках, (сила сцепления 10-7…10-9Н), коагуляционными в суспензиях и эмульсиях, т.е. образующимися в результате сцепления частиц через прослойки жидкой среды (сила сцепления контакта 10-8…10-12 Н), прочными, необратимо разрушающимися (фазовые контакты). Фазовые контакты характерны для дисперсных материалов, получающихся из систем с обратимыми по прочности связями в результате фазовых или химических превращений: кристаллизации из пересыщенных растворов или расплавов, полимеризации, спекания, пластичной деформации и др. Силы связи в фазовых контактах могут меняться.
В 1928 г. П.А.Ребиндер обнаружил, что прочность кристаллов каменной соли и кальцита значительно понижается в водных растворах (ПАВ) по сравнению с их прочностью на воздухе. Так был открыт эффект. Это открытие 1928 года П.А.Ребиндером «Эффекта адсорбционного понижения прочности и облегчения деформации твердых тел» - стал эффектом Ребиндера. Прикладное значение эффекта - присутствие в реологической системе ничтожно малых количеств поверхностно активных веществ (ПАВ) понижает поверхностную энергию при абсорбции. Последние, мигрируя в микротрещины, развивающихся при возникновении в теле растягивающих напряжений, уменьшают поверхностную энергию тела в зоне предразрушения, снижают прочность тела в десятки раз.