
- •1.Гормоны, регулирующие уровень глюкозы в крови. Места образования, химическая природа, особенности механизмов действия.
- •2. Распад гемоглобина в клетках рэс.
- •4.Витаминоподобные вещества: биофлавоноиды (витамин р), парааминобензойная к-та, липоевая к-та, карнитин. Биологическая роль.
- •6.Изобразите схематически метаболические процессы, приводящие к депонированию жира и жировой ткани после приема пищи.
- •1. Гормоны. Классификация........
- •2. Обтурационная желтуха. Диагностика. Причины.
- •3. Биологическая роль и диагностическое значение некоторых белков плазмы крови...
- •4. Витамин д (кальциферол, антирахитический).
- •6.Белки как источники энергии...
- •3. Индикаторные ферменты крови и их диагностическое значение:
- •4. Витаминоподобные вещества.
3. Индикаторные ферменты крови и их диагностическое значение:
Фермент |
Орган |
Заболевание |
АлАТ |
печень, скелетные мышцы |
паренхиматозные заболевания |
АсАТ |
печень, скелетные мышцы, сердце, почки, эритроциты |
ИМ, паренхиматозные заболевания печени, мышц |
Альдолаза |
скелетные мышцы, сердце |
болезни мышц |
Кислая фосфатаза |
предстательная железа, эритроциты |
рак предстательной железы |
Щелочная фосфатаза |
печень, костная ткань, слизистые оболочки, плацента, почки |
заболевания костной ткани, печени |
Амилаза |
слюнные железы, поджелудочная железа, яичники (активность повышена на высоте острого панкреатита) |
заболевания поджелудочной железы |
Холинэстераза |
печень |
отравление фосфорорганическими инсекцидами, болезни печени |
Креатинкиназа |
скелетные мышцы, ГМК, мозг, сердце |
ИМ, заболевания мышц |
ГлутаматДГ |
печень (митохондрии) (свидетельствует о глубоком поражении клеток) |
паренхиматозные заболевания печени |
-глутаматтраспептидаза |
печень, почки ( при холестазе) |
заболевания печени, алкоголизм |
лактатДГ |
сердце, печень, скелетные мышцы, эритроциты, л.у. |
ИМ, гемолиз, паренхиматозные заболевания печени |
4. витамин В2(Рибофлавин)
Суточная потребность-1,7 мг,в пожилом возрасте и при тяжёлой физ нагрузге потребность увеличиваетья.
ПИЩЕВЫЕ ИСТОЧНИКИ.хлеб из иуки грубого помола,семена злаков,яйца,кислое молоко,мясо,свежие овощи,творог, печень, почки.
Витамин В2 входит в состав флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД) - простетических групп флавиновых ферментов.
Его биологическая функция в организме - участие в окислительно-восстановительных реакциях в составе флавопротеидов (ФП).
Авитаминоз- воспалительные процессы слизистой оболочки языка,губ, особенно уголков рта,эпителия кожи.Наиболее характерно изменения со стороны глаз:кератиты,катаракта.Также развиваеться мышечная слабость и лабость ердечной мышцы.
5. После 3 суток. Увеличена активность гормонов чувствительной липазы, растёт высвобождение жирных кислот и глицерола.
6. первопричина квашиоркора явл дефицит белка из-за отсутствия его в пище или наруш всасывания. Отек имеет место вследствие сниж онкот давл в кровеносных сосудах(гипоальбуминемия). А при ожирении печени имеет место низкое содержание белка в пище, как правило сочет с высоки потребл углеводов, маразм отсутствует.
Билет №9
1.Рецептор инсулина: гликопротеин, 1-TMS-рецептор на поверхности клеток-мишеней. Гетеродимер, состоит из двух субъединиц – α и β. Инсулин связывается с α-субъединицей, β-субъединица преобразует полученный сигнал (обладает тирозинкиназной активностью и содержит участок аутофосфорилирования).
Г + рецептор изменение конформации α-субъединиц активация тирозинкиназной активности β-субъединицы активация инсулинорецепторного субстрата (IRS) запуск:
а) фосфатидилинозитолкиназный путь ДАГ + ИФ3 активация 50 ферметов обмена углеводов, липидов, белков, активация движения GLUT4.
б) МАП-киназный путь (митогенактивируемая протеинкиназа) факторов транскрипции синтез белков, стимуляция деления кл.ф
в) активация RAS-белка, связанного с рецептором фактора роста.
Влияние инсулина на метаболизм белков: усвоение белка, усиливая утилизацию АК, стимулирует синтез, уменьшает распад (на уровне трансляции мРНК).
Нарушение при сахарном диабете: повышенный катаболизм белков повышенное содержание АК в плазме, потеря азота с мочой.
Влияние инсулина на метаболизм углеводов:
1) на транспорт глюкозы через мембрану: облегчает диффузию гл в клетки, кроме печеночных за счет увеличения числа переносчиков GLUT4. В печеночных кл: индукция глюкокиназы гл в гл-6-ф концентрация свободной гл поддерживается на низком уровне гл проникает в кл путем простой диффузии по градиенту концентрации.
2) на утилизацию гл: усиливает гликогенез (например, повышает активность гликогенсинтазы)
3) на образование гл: ингибирует глюконеогенез (ингибирует синтез ФЕПКК).
4) на метаболизм гл: содержание гл в крови.
Расстройство метаболизма углеводов при диабете: 1) гипергликемия из-за а) пониженного проникновения гл в клетки б) утилизации гл различными тканями в) глюконеогенеза в печени 2) снижение гликогенеза.
. Влияние инсулина на метаболизм липидов:
1) стимулирует липогенез в жировой ткани (за счет притока ацетил~КоА и НАДФН для синтеза ВЖК, поддержания нормального уровня ацетил~КоА-карбоксилазы, притока глицерола) 2) мощный ингибитор липолиза в печени и жировой ткани (ингибирование гормон-чувствительной липазы)
Расстройство метаболизма углеводов при диабете: повышенный липолиз содержание в плазме СЖК кетогенез, кетонурия, кетонемия .
2. Hb – хромопротеин, т.к. его небелковая часть окрашена (гемопротеин). Глобин синтезируется как обычный белок, в синтезе гема – ряд стадий. Все клетки, содержание ядро, могут синтезировать гем, но наиболее интенсивно его синтез идет в печени и костном мозге:
1) сукцинил~КоА + глицин КоА~SН + СО2 + -аминолевулиновая кислота (-АЛК) (под действием 1--аминолевулинатсинтазы)
2) 2 -АЛК H2О + порфобилиноген (ПБГ) (под действием 2--аминолевулинатдегидрогеназы)
3) 4 ПБГ -------- протопорфирин IX (через ряд промежуточных стадий)
4) протопорфирин IX + Fe2+ гем (под действием 3-гемсинтазы, или феррохелатазы, + вит. В12, Сu2+)
5) гем + глобин гемоглобин
Регуляция синтеза гема.
Ключевой фермент - 1--аминолевулинатсинтаза. Ингибируется избытком гема по принципу обратной связи, а активируется стероидными гормонами.
2--аминолевулинатдегидрогеназа и 3-гемсинтаза ингибируются гемом в меньшей степени. 3-гемсинтаза очень чувствительна к свинцу, а 2--аминолевулинатдегидрогеназа – ко всем тяжелым металлам.
Нарушением биосинтеза порфиринов являются порфирии.
Порфирии — это группа наследственных заболеваний, в основе которых лежит нарушение биосинтеза гема, приводящее к избыточному накоплению в организме порфиринов и их предшественников, а именно, порфобилиногена (ПБГ) и δ-аминолевулиновой кислоты (АЛК). Избыток этих веществ оказывает токсическое воздействие на организм и обуславливает характерную клиническую симптоматику. Причиной подобного нарушения является мутация гена, ответственного за активность одного из ферментов, участвующих в многостадийном синтезе гема.
3. Гемокоагуляция – цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеаз на фосфолипидных матрицах (тромбопластинах), заканчивающаяся превращением растворимого фибриногена в нерастворимый фибрин. Внешний механизм – тромбопластин приходит извне из поврежденных тканей.
Общие этапы: начиная со 2-ого (образование тромбина)
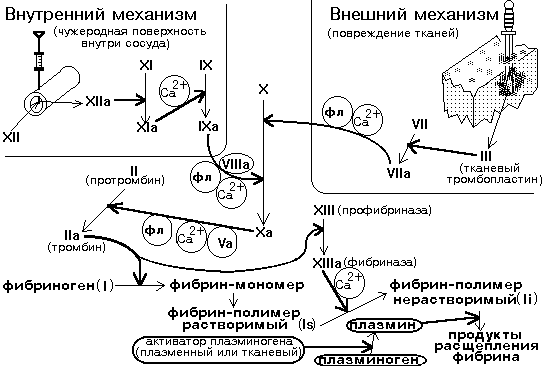
Факторы свёртывания крови:
ф.I – фибриноген, ф.II – протромбин, ф.III – тканевой тромбопластин, ф.IV – ионы кальция, ф.V – проакцелерин, ф.VII – проконвертин (антифибринолизин),
ф.VIII – антигемофильный глобулин А, ф.IX – антигемофильный глобулин В (Кристмаса), ф.X – Стюарта-Прауэра, ф.XI – Розенталя, ф.XII – Хагемана, ф.XIII – фибринстабилизирующий.
Фазы гемокоагуляции:
1) 1-ая фаза – образование протромбиназы (активного тромбопластина крови): 4 мин 50 с – 6 мин 50 с.
2) 2-ая фаза – образование тромбина: 2-5 с.
3) 3-ая фаза - образование фибрина: 2-5 с.
4) 4-ая фаза, посткоагуляционная, - ретракция, т.е. образование гемостатически полноценного сгустка: 55-85 мин.
4.

Витамин В1( тиамин, антиневритный).
Химическая природа – два кольца – пиримидиновое и тиазоловое, объединенные метиленовой связью.
Коферментные формы: тиаминмонофосфат, тиаминтрифосфат (редко), тиаминпирофосфат (ТПФ, тиаминдифосфат, кокарбоксилаза) (встречается наиболее часто).
Участие в метаболизме. В форме ТПФ является составной частью четырех ферментов:
1)пируватдегидрогеназного комплекса
2)альфа-кетоглутаратдегидрогеназного комплекса
3)фермента транскетолазы (участвует в переносе гликольальдегидного радикала от кетосахаров на альдосахара)
4) фермента дегидрогеназы γ-оксикетоглутаровой кислоты.
ТПФ также участвует в окислительном декарбоксилировании глиоксиловой кислоты и α-кетокислот, образующихся при распаде АК с разветвленной боковой цепью.
Явления недостаточности: 1. Гиповитаминоз. Ранние проявления: снижение аппетита,тошнота, нарушение периферической чувствительности, ощущение ползания «мурашек», невралгии. Характерна забывчивость. Слабость сердечной мышцы проявляется тхикардией даже при небольших нагрузках. При значительном дефиците тиамина возникает болезнь бери- бери( отмечается тяжесть в ногах и скованность походки – «поступь овцы» - симптом симметричного опускания стоп). Болезнь имеет 2 формы: сухую(нервно- паралитическую) и отечную( сердечную). Существуют врожденные нарушения обмена тиамина, наиболее распространенным из которых является синдром Вернике- Корсакова: потеря памяти, частичный паралич, нарушение координации движений, зрительной функции, спутанностью сознания.2. Гипервитаминоз не описан. Избыток принятого витамина быстро выводится с мочой.
Пищевые источники: пшеничный хлеб из муки грубого помола, оболочка семян хлебных злаков, соя, фасоль, горох, дрожжи, картофель, морковь, капуста, печень, нежирная свинина,почки, мозг, яичный желток.
Суточная потребность: 1,1- 1,5 мг/сутки.
5. Основная функция жировой ткани - запасание энергоносителей в форме триацилгли-церолов. Под влиянием инсулина ускоряется транспорт глюкозы в адипоциты. Повышение

Рис.Пути использования основных энергоносителей в абсорбтивном периоде( сразу после приема пищи). 1 - биосинтез гликогена в печени; 2 - гликолиз; 3 - биосинтез ТАГ в печени; 4 - биосинтез ТАГ в жировой ткани; 5 - биосинтез гликогена в мышцах; 6 - биосинтез белков в разных тканях, в том числе в печени.
внутриклеточной концентрации глюкозы и активация ключевых ферментов гликолиза обеспечивают образование ацетил-КоА и глицерол-3-фосфата, необходимых для синтеза ТАГ. Стимуляция пентозофосфатного пути обеспечивает образование NADPH, необходимого для синтеза жирных кислот. Однако биосинтез жирных кислот de novo в жировой ткани человека протекает с высокой скоростью только после предшествующего голодания. При нормальном ритме питания для синтеза ТАГ используются в основном жирные кислоты, поступающие из ХМ и ЛПОНП под действием ЛП-липазы (см. раздел 8). Вместе с тем при увеличении отношения инсулин/глюкагон гормончувствительная ТАГ-липаза находится в дефосфорилированной неактивной форме, и процесс липолиза тормозится.
6. Маразм - форма проявления белково- энергетической ( БЭН) недостаточности с преобладанием энергетической недостаточности. В основном наблюдается у детей до 1 года.
Первопричина: неадекватное потерям поступление белка или использование в питании неполноценных белков. Приводит к проявлениям белковой недостаточности: остановке роста, отрицательному азотистому балансу, снижению уровня альбумина в крови, отекам, понижению иммунитета.
Важным в развитии БЭН являются изменения гормональной регуляции. Поступление большого количества углеводов поддерживает высокий уровень инсулина, а при маразме комбинация низкого уровня инсулина и высокого уровня кортизола способствует катаболизму белков мышц, поэтому при маразме больше всего страдают мышцы.
Проявления: сухая кожа, свободные складки кожи, свисающие на бедрах, под мышками и т.д. Атрофия мышц и подкожной клетчатки, возможно также чередующиеся полосы пигментированных и депигментированных волос, пятна на коже, вызванные шелушением. Больной часто раздражен и ненасытно голоден.
Билет №10
1. Сахарный диабет- группа эндокринных заболеваний, развивающихся вследствие абсолютной или относительной недостаточности гормона инсулина, в результате чего развивается гипергликемия. Метаболизм глюкозы в инсулиннезависимых тканях:
1) глюкоза проникает в клетку сорбитол (с помощью альдозоредуктазы и НАДФН+Н+)фруктоза (под действием сорбитолДГ). В норме этот путь происходит в клетках артериальных стенок, клетках Шванна, в эритроцитах, в хрусталике и сетчатке глаза, в семенниках
2) глюкоза связывается с аминогруппами белков (гликозилирование), что изменяет строение белков и нарушает их функции. Может быть гликозилирование гемоглобина, белков базальных мембран изменение капилляров, утолщение базальных мембран.
Восстановительный путь обмена глюкозы при сахарном диабете – образование сорбитола: глюкоза проникает в клетку сорбитол (с помощью альдозоредуктазы и НАДФН+Н+). Это наиболее интенсивно протекает в артериальных стенках, кл Шванна и т.д. Сорбитол вызывает осмотическое набухание клеток и нарушение их функций.
Основной механизм повреждения тканей при сахарном диабете - гликозилирование белков - не ферментативная реакция глюкозы со свободными аминогруппами белковой молекулы (лиз, арг). При этом нарушаются функции белков в результате изменения заряда белковой молекулы, ее конформации или блокирования активного центра, что приводит со временем к ангиопатиям (повреждениям базальных мембран сосудов).
Недостаток инсулина мобилизация жиров заполнение кровеносного русла СЖК и ТАГ ингибирование синтеза ВЖК катаболические пути не справляются с избытком образующегося ацетил-КoA в печени из ацетил-КoA синтезируются кетоновые тела накопление в крови (кетоз), т.к. скорость их образования превышает возможности клеток по их использованию метаболический ацидоз.
Биохимическая диагностика сахарного диабета:
1) качественное и количественное двукратное определение гл в крови по глюкозооксидазному методу.
2) тест на толерантность к глюкозой (пробу с нагрузкой глюкозой).
3) метод Хагедорна-Йенсена - количественный метод определения уровня сахара в крови, основанный на способности сахаров восстанавливать в щелочной среде красную кровяную соль в желтую; о содержании сахара судят по избытку красной кровяной соли, определяемому титрометрией.
4) качественное и количественное определение сахара в мочи (качественные реакции: Тромера, Фелинга, количественные реакции: глюкозооксидазный метод).
Клинико-диагностические значения оценки гликемических кривых:
1) у больных с разными формами диабета: нарастание гликемической кривой происходит медленнее, в большинстве случаев отмечается глюкозурия. Чем тяжелее заболевание, тем позже достигается максимум гликемии и тем он выше. Понижение кривой происходит очень медленно, чаще оно растягивается на 3-4 ч.
2) гиперфункция щитовидной железы: гликемические кривые с более быстрым, чем в норме, подъемом, что вызвано более интенсивным обменом веществ и возбуждением симпатического отдела ВНС
3) аденома островков Лангерганса, гипотиреоз (микседема), болезнь Аддисона: низкий исходный уровень кривой, низкая ее вершина и высокий постгликемический коэффициент.
2. Печень играет центральную роль в обмене белков. Она выполняет следующие основные функции( АК используются для):
1) синтеза белков плазмы крови (альбуминов, глобулинов, факторов свертывания – протромбин, фибриноген, факторы V, VII, IX, X, XI, XII, ферментов (липопротеинлипаза, холинэстераза)
2) образования α-кетокислот
3) глюконеогенеза из глюкогенных АК
4) кетогенеза из кетогенных АК
5) получения энергии (в ЦТК)
6) синтез креатина, холина, мочевой кислоты.
3. Фибриноген – белок, вырабатываемый в печени и превращающийся в нерастворимый фибрин – основу сгустка при свертывании крови. Физиологические концентрации: норма – 2-4 г/л, у новорожденных – 1,25-3 г/л, у беременных – до 6 г/л.
Переход фибриногена в фибрин происходит по схеме:

Фибрин S называется растворимым ( soluble). Тромб из такого (“недополимеризованного”) фибрина легко растворяется плазмином и потому не может обеспечить полноценный гемостаз. Это нередко бывает причиной кровоточивости и плохого заживления ран. Полноценным, то есть устойчивым к фибринолизину, он может стать лишь под действием фибриназы (фактора XIIIa). Образовавшийся после этого воздействия фибрин называется нерастворимым фибрином (фибрин I, insoluble).
4. Витамин B5 (витамин PP, никотиновая кислота, ниацин, никотинамид, антипеллагрический)
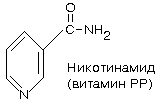
Химическая природа: соединение пиридинового ряда, содержащее амидную группу.
Коферментные формы: НАД и НАДФ (входит в состав коферментов никотинамидных дегидрогеназ).
Участие в метаболизме: 1) входит в состав коферментов большого числа обратимо действующих в окислительно-восстановительных реакциях дегидрогеназ
2) НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами.
Проявления гиповитаминоза: симптомокомплекс «трех Д»: дерматит, диарея, деменция. Так проявляется заболевание пеллагра. В основе заболевания лежит нарушение пролиферативной активности и энергетики клеток. Симптомы: дерматит, глоссит, гингивит, стоматит, тошнота, отсутствие аппетита, боли в животе, диарея, головокружение, головные боли, депрессия, тугодумие, психозы. Такие симптомы чаще всего проявляются у лиц с недостатком белка в диете.
Пищевые источники: печень, мясо, рис, хлеб, картофель, молоко, яйца.
Суточная потребность: 15-25 мг/сутки.
5. Глюкоза – главный энергетический субстрат, использующийся нервной тканью в норме. Запасы гликогена в мозге незначительны ( 0,1 % от массы мозга). Гликоген сосредоточен главным образом в астроглии. Высокая потребность в энергии при низких запасах гликогена ставит нервные клетки в прямую зависимость от доставки глюкозы из крови. Потребность в глюкозе довольно высокая. В спокойном состоянии мозг потребляет около 5 мг глюкозы в 1 мин на 100 г массы мозга. В обычных условиях эта потребность удовлетворяется, однако гипогликемия вызывает нарушения функции клеток мозга. При голодании, в первые часы происходит мобилизация глюкозы из депо, затем уровень глюкозы в крови поддерживается благодаря глюконеогенезу. В поздние сроки ( 1 неделя) голодания в качестве источника энергии нервные клетки могут использовать кетоновые тела.
6. Волокнистые полисахариды пищи, или пищевые волокна (неусвояемые неперевариваемые углеводы, клетчатка, балластные вещества) - представляют собой вещества различной химической природы (все они являются полимерами моносахаридов и их производных), которые не расщепляются в тонкой кишке, а подвергаются бактериальной ферментации в толстой кишке.
Функции пищевых волокон в организме человека разнообразны и многогранны.
Пищевые волокна отличаются по составу и по своим свойствам. Разные виды ПВ выполняют разные функции.
Растворимые волокна лучше выводят тяжелые металлы, токсичные вещества, радиоизотопы, холестерин.
Нерастворимые волокна лучше удерживают воду, способствуя формированию мягкой эластичной массы в кишечнике и улучшая ее выведение.
Целлюлоза абсорбирует воду, помогает вывести из организма токсины и шлаки и регулировать уровень глюкозы.
Лигнин помогает удалять холестерин и желчные кислоты, находящиеся в желудочно-кишечном тракте.
Билет №11
1. Вазопрессин. Хим.природа: пептид, построенный из 8 аминокислот.
Механизм действия: вазопрессин + 7-TMS рецептор Gq-белок ФЛ С ДАГ + ИФ3 Ca2+ 1) вазоконстрикция 2) усиливает реабсорбцию воды в нефроне.
2. При распаде гемоглобина непрямой билирубин (свободный) поступает в кровь и связывается с альбуминами плазмы. Затем он поступает в печень, где связывается с 2 молекулами УДФ-глюкуроновой кислоты под действием УДФ-глюкуронилтрансфреразы с образованием билирубиндиглюкуронида – прямого (связанного) билирубина. Свободный билирубин, в отличие от связанного, не дает цветную реакцию с диазореактивом Эрлиха, пока белки плазмы крови не осаждены спиртом.
Физиологическая концентрация билирубина у здорового человека 3,4 – 22,2 мкмоль/л.
3. Фазы гемокоагуляции:
1) 1-ая фаза – образование протромбиназы (активного тромбопластина крови): 4 мин 50 с – 6 мин 50 с.
2) 2-ая фаза – образование тромбина: 2-5 с.
3) 3-ая фаза - образование фибрина: 2-5 с.
4) 4-ая фаза, посткоагуляционная, - ретракция, т.е. образование гемостатически полноценного сгустка: 55-85 мин.
Внутренний механизм свертывания крови запускается а) контактом крови с измененной или чужеродной поверхностью, по смачиваемости отличной от эндотелия (поврежденная стенка сосудов или измененная вследствие васкулитов, атеросклероза, интоксикации) б) иммунными комплексами, адреналином, жирными кислотами, холестеролом, бактериальными липопротеинами.
4. Фолиевая кислота. Состоит из 3-х компонентов: гетероциклического остатка птеридина, парааминобензойной кислоты. Которая может самостоятельно регулировать рост многих бактерий, и глутаминовой кислоты (несколько остатков). Витамин В9, всасываясь в тонком кишечнике, восстанавливается в энтероцитах до тетрагидрофолиевой кислоты (ТГФК) – коферментной формы фолиевой кислоты, которая необходима для мобилизации и использования в реакциях метаболизма одноуглеродных функциональных групп. ТГФК может приобрести одноуглеродную группу из различных источников. Важнейшими реакциями с участием одноуглеродных фрагментов, связанных с ТГФК, являются: 1) доноры соответствующих одноуглеродных радикалов при синтезе пуриновых нуклеотидов;
2) участие в переносе метильной группы в реакциях синтеза дезокси-ТМФ и метионина;
3) ТГФК вовлекается в метаболизм АК: серина, глицина,и метионина.
Гиповитаминоз: мегалобластичекая макроцитарная анемия; слабость, гол. боль, обмороки, бледность кожи, красный саднящий язык, диарея, больные раздражительны, враждебны, у них плохая память, паранойя. Пищевые источники: лиственные овощи, например шпинат, салат, Капуста, томаты, земляника, печень, мясо, яичный желток. Сут. потребность: 150-200 мкг.
5. В печени после приёма пищи ингибируется распад гликогена.Ключевой фермент – гликогенфосфорилаза.
 гликоген
гликоген
гликогенфосфорилаза
г л-1-ф
Инсулин фосфоглюкомутаза
Гл-6-ф
Протеинфосфатаза
Н2О

 Ф
Ф
Н екативнаят форма активная форма – Ф
Активируется синтез гликогена. Кл. фермент – гликогенсинтетаза.
Инсулин

 Ф Н2О
Ф Н2О
А кт. форма неакт. форма Ф
Активация гликолиза кл. фермент ФФК1
-Активатор инсулин
Фр-6-ф
 АДФ
АДФ
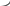

 ФФК1 ФФК-1-Ф
ФФК1 ФФК-1-Ф
АТФ
Ф Н2О
Фр-1,6-фф протеинфосфатаза
инсулин
гл-6-ф ДГ
активатор – инсулин
активируется синтез ЖК
-цитратлиаза (индуктор инсулин)
-ацетил-КоА-карбоксилаза (активирует цитрат)
6. Потребность в белке – это количество белка, которое обеспечивает все метаболические потребности организма. При этом обязательно учитывается физиологическое состояние организма с одной стороны, а с другой стороны, свойства самих пищевых белков и пищевого рациона в целом. Потребность в белке состоит из двух компонентов. Первый должен удовлетворить потребность в общем азоте, обеспечивающем биосинтез заменимых аминокислот и других азотсодержащих эндогенных биологически активных веществ. Собственно потребность в общем азоте и есть потребность в белке. Второй компонент определяется потребностью организма человека в незаменимых аминокислотах, которые не синтезируются в организме. Это специфическая часть потребности в белке, которая количественно входит в первый компонент, но предполагает потребление белка определенного качества, т.е. носителем общего азота должны быть белки, содержащие незаменимые аминокислоты в определенном количестве.
Качество пищевого белка определяется наличием в нем полного набора незаменимых аминокислот в определенном количестве и в определенном соотношении с заменимыми аминокислотами.
Потребление возрастает при росте, беременности, лактации, травмах, операции, ожогах.
Билет №12
1. Классификация рецепторов:
1. Мембранные рецепторы
а) 7-TMS рецепторы, взаимодействующие с гетеротримерными G-белками
б) 1-TMS рецепторы со свойствами гуанилатциклазы, тирозинкиназы, протеинфосфатаз, сер/тре протеинкиназ, взаимодействующие с тирозинкиназой.
в) ионные каналы (лиганд-зависимые, потенциал-зависимые, щелевые контакты)
2. Внутриклеточные
1 класс - ядерные и цитозольные ассоцииров. с hsp
2 класс – ядерные и цитозольные неассоц. c hsp
Функциональное назначение G-белка: 1) Gsa – активация АЦ, 2) Gia – ингибируют АЦ, 3) Gqa – реагируют с ФЛ С и активируют ее 4) Goa – открывают Ca2+-каналы.
G- белок передаёт сигнал с 7-TMS рецептора на вторичный посредник.
Рецепторы гормонов являются крупными белками, и каждая восприимчивая к гормону клетка может иметь от 2000 до 100000 таких рецепторов. Рецепторы высокоспецифичны для конкретного гормона, что предопределяет тип гормона, который сможет оказать влияние на определенную ткань. Гормоном активирует только те ткани, которые располагают специфическим к нему рецептором.
Локализация различных типов рецепторов гормонов обычно следующая.
1. Внутри клеточной мембраны или на ее поверхности (рецепторы к гормонам белковой и полипептидной природы, катехоламинам).
2. В цитоплазме клетки (рецепторы к различным стероидным гормонам).
3. В клеточном ядре (рецепторы к гормонам щитовидной железы, которые предположительно связаны с одной или более хромосомами).
Типы G-белков: известно около 20 видов
G0 – активирует кальциевые каналы
Gi – ингибирует АЦ
Gs- акт. АЦ и т.д.
G-белок: -гетеродимер
-3 субъединицы
- ассоциир. с ГДФ
Л иганд+ R замена ГДФ на ГТФ ГТФ в Gальфа диссоциация G -белка альфа
АЦ
А ТФ цАМФ
Патологическое функционирование G-белка:
Х олерный токсин Gальфа s в энтероцитах угнетение ГТФазной активности цАМФ образуется постоянно потеря воды энтероцитами
2. Роль печени в обмене липидов (их депонировании):
а) синтез, распад, удлинение, укорочение ЖК
б) распад, синтез и модификация СЖК
в) синтез большинства ЛПНП и 90% ХС в организме
г) из ХС синтезируются желчные кислоты, входящие в состав желчи.
Жировая дистрофия печени:
-в энтероцитах накапливаются липиды
-развивается как ответ на острую или хроническую интоксикауию
Причины:
- накопление высших ЖК
- недостаток АК
- алкоголизм, следовательно нарушение синтеза апо-белков
- недостаток фосфолипидов
3. Антитромбин 3 – ГП, синтезируется в печени, необратимо ингибирует тромбин, Ф9, Ф11, Ф12, калликреин.
Протеин С разрезает Ф5а, Ф8а до пептидов.
АТ 300
Ф12 Ф 12а
Ф11 Ф 11а
 ФХ
ФХ
Ф9 Ф9а/ Р3/ионы кальция/Ф8а фибриноген
Ф2 (проторомбин) Р3/ионы кальция/Ф5а/ф10а Ф2а
Фибрин моном.
РФМК
Протеин С Ф S
ФI
4. витамин В 12. Структура: кобальт связан координационной связью с 4-мя атомами азота, входящими в состав порфириноподобной структуры и с атомом азота 5,6-диметилбензимидазола.
Коферментные формы: метилкобаламин, дезоксиаденозилкобаламини. Содержащийся в пище витамин В12 в желудке связывается с вырабатываемым обкладочными клетками белком – гликопротеином, получившим название «внутренний фактор Касла». Одна молекула этого белка избирательно связывает одну молекулу витамина; далее в подвздошной кишке этот комплекс взаимодействует со специфическими рецепторами мамбран энтероцитов и всасывается путём эндоцитоза.
Гиповитамино:злокачественная мегоалобластическая анемия Аддисона-Бирмера; поражаются задние и боковые столбы спиннго мозга вследствие нарушения синтеза миелина; нарушение кроветворения. Источники: печень, мясо, морские продукты, молоко, яйца. Сут. потребность: 3 мкг.
5. интенсивный гликолиз
Активируется синтез ЖК
Активируется ПФП
Ингибируется окисление ЖК
Ингибируется глюконеогенез
В качестве источника Е исп. АК
Увелич. образование мочевины
6. Квашиоркор – одна из форм проявлений белково-энергетической недостаточности.
Основные проявления:отёк, сухие кожа и волосы, жировая печень
М еханизм:Снижение белка мало АК снижение синтеза альбумина, трансферина, апоВ100, гипоальбуминеимя отёк живота и конечностей
У вел. углеводов увелич. предшественников ТАГ ожирение печени гепатомегалия
Билет №13
1. Механизи действия гормонов, взаимодействующих с с внутриклеточными рецепторами:
Кальцитриол, ретиноевая кислота, стероидные и тереоидные гормоны взаимодействуют с внутриклеточными рецепторами (они свободно диффундируют через плазматическую мембрану). Эти рецепторы делятся на цитозольные: рецепторы стероидных гормонов ( глюкокортикоидов, минералокортикоидов, андрогенов, исключ- эстрогены) и ядерные: рецепторы тиреоидных гормонов, кальцитриола, ретиноевой кислоты, эстрогенов. Цитозольные рецепторы образуют комплексы с белками теплового шока, которые присоединяются к рецептору таким образом, что закрывают его ДНК- связывающий домен. Когда гормон взаимодействует с рецептором, то белок- ингибитор отделяется от рецептора, в результате чего рецептор активируется. Активированный гормон- рецепторный комплекс перемещается в ядро, где он взаимодействует со строго определенными гормон- узнающими элементами ДНК.
Ядерные рецепторы находятся в связанном с хроматином состоянии. После взаимодействия с гормоном изменяется конформация рецепторов, что повышает его сродство к ДНК, т.е рецептор может связываться со специфическими генами в ядре, регулируя их экспрессию.
2.

3.

4. ПАНТОТЕНОВАЯ КИСЛОТА (сут. потребность 10-15 мг)Источники: практически во всех продуктах питания, много в пчелином маточном молочке, дрожжах, печени животных, яичном желтке, гречихе, овсе, бобовых.
В кишечнике продуцируется E. coli.
Акт. форма – 4-фосфопантотеин – простетическая группа коэнзима А (HS-КоА) и ацилпереносящего белка (АПБ) в составе ацилсинтазы жирных кислот
Биологическая роль - активирование и перенос ацилов:
Участие в цикле Кребса (ацетил-КоА, сукцинил-КоА)
Окисление и синтез ж.к., ТАГ, сложных липидов, ХС, кетоновых тел, гема
Ацетилирование холина, гексозаминов, ксенобиотиков
Авитаминоз практически не встречается (синтез м/ф кишечника)
Вторичная недостаточность - при многих хронических заболеваниях, длительном применении диуретиков и алкоголизме.
5. В печени после приёма пищи ингибируется распад гликогена.Ключевой фермент – гликогенфосфорилаза.
гликоген
гликогенфосфорилаза
гл-1-ф
Инсулин фосфоглюкомутаза
Гл-6-ф
Протеинфосфатаза
Н2О
Ф
Н екативнаят форма активная форма – Ф
Активируется синтез гликогена. Кл. фермент – гликогенсинтетаза.
Инсулин
Ф Н2О
А кт. форма неакт. форма Ф
Активация гликолиза кл. фермент ФФК1
-Активатор инсулин
Фр-6-ф
АДФ
ФФК1 ФФК-1-Ф
АТФ
Ф Н2О
Фр-1,6-фф протеинфосфатаза
инсулин
гл-6-ф ДГ
активатор – инсулин
активируется синтез ЖК
-цитратлиаза (индуктор инсулин)
-ацетил-КоА-карбоксилаза (активирует цитрат)
6. Питательные вещества (нутриенты) – это компоненты пищи, обеспечивающие организм строительным и энергетическим материалом
Основные категории питательных веществ:
Макронутриенты. Энергодающие (углеводы, липиды и белки)
Микронутриенты. Витамины и минеральные вещества
Пищевые волокна. Неперевариваемые полисахариды
Незаменимый фактор питания – вещество, поступающее в организм с пищей, поскольку в самом организме оно не может образовываться в достаточном количестве
Незаменимые факторы питания для человека:
вода
источники энергии (углеводы, жиры и белки)
8-10 незаменимых аминокислот
2 незаменимые жирные кислоты
14 витаминов
20 минеральных веществ
Углеводы – основной источник энергии.
Структурный компонент нуклеиновых кислот, гликопротеинов, гликолипидов, глюкозаминогликанов. Пищевые углеводы: 60-80% полисахариды
(крахмал, гликоген, пищевые волокна), 20-30% дисахариды (сахароза, лактоза, мальтоза),
моносахариды (глюкоза, фруктоза, пентозы).
Олиго- и полисахариды (за исключением фибриллярных компонентов) расщепляются до моносахаридов, которые затем окисляются дихотомически (2 АТФ или 30-32 АТФ)
БЕЛКИ – основные источники азота для организма. Потребность в белке: для взрослого – 0,8 г/кг/сутки, для новорождённого – 2 г/кг/сут, для подростков – 1,0 г/кг/сут.
Потребость в белке увеличивается у растущего организма, при беременности (950 г нового белка прибавляется у матери) и лактации, при травмах, операциях, ожогах, сепсисе и других заболеваниях.
ЛИПИДЫ ПИЩИ.
Являются источником энергии (9,1 ккал/г)
Источники незаменимых жирных кислот
Носители жирорастворимых витаминов
Придают пищи вкус и обеспечивают чувство сытости
В среднем человеку необходимо около 1 г жиров на 1 кг собственной массы в сутки. Из этого количества 1/4 должны составлять растительные жиры
Билет №14
1. На примере инсулина
Рецептор инсулина-тирозинкиназа-1-ТМС рецептор; имеет 4 домена: внеклеточный (связывает гормон), трансмембранный, внутриклеточный с тирозинкиназной активностью, внутриклеточный регуляторный. Присоединение инсулина вызывает аутофосфорилирование киназного домена (R). При этом ускоряется фосфорилирование остатков тирозина в особом белке — IRS-1 (инсулин-рецепторный субстрат). Активный IRS-1 включает целый каскад реакций, усиливающих гормональный сигнал. Это протеинкиназные реакции с участи-ем, в первую очередь, МАП-киназ (митоген-активируемые протеинкиназы). МАП-киназы изменяют активность многих ферментов путём их фосфорилирования.
В передаче сигнала с участием 1-TMС-(R) есть свои выключатели. Это Ras-белки, относящиеся к се-мейству мономерных ГТФ-аз. Ras-белки могут быть активными, если к ним присоединяется ГТФ, и становиться неактивными при замене ГТФ на ГДФ. Однако Ras-белки катализируют гидролиз ГТФ очень медленно. Существует специальный белок, ускоряющий гидролиз ГТФ, — БАГ
(белок, активирующий ГТФ-азу). Другой специальный белок — SOS-белок (фактор, высвобождающий гуаниловые нуклеотиды) — препятствует этому гидролизу, заменяя ГДФ на ГТФ, поэтому он оказывает активирующий эффект на Ras-белок.
Влияние инсулина на метаболизм углеводов:
1) на транспорт глюкозы через мембрану: облегчает диффузию гл в клетки, кроме печеночных за счет увеличения числа переносчиков GLUT4. В печеночных кл: индукция глюкокиназы-> гл в гл-6-ф -> концентрация свободной гл поддерживается на низком уровне-> гл проникает в кл путем простой диффузии по градиенту концентрации.
2) на утилизацию гл: усиливает гликогенез (например, повышает активность гликогенсинтазы)
3) на образование гл: ингибирует глюконеогенез (ингибирует синтез ФЕПКК).
4) на метаболизм гл: сниж. содержание гл в крови.
Влияние инсулина на метаболизм липидов:
1) стимулирует липогенез в жировой ткани (за счет притока ацетил~КоА и НАДФН для синтеза ВЖК, поддержания нормального уровня ацетил~КоА-карбоксилазы, притока глицерола) 2) мощный ингибитор липолиза в печени и жировой ткани (ингибирование гормон-чувствительной липазы)
Влияние инсулина на метаболизм белков: повыш. усвоение белка, усиливая утилизацию АК, стимулирует синтез, уменьшает распад (на уровне трансляции мРНК).
2. Печень играет центральную роль в обмене веществ. Масса печени у взрослого человека составляет ≈ 1,5 кг, при этом на долю воды приходится 70–75 % . Из сухого остатка более 50 % составляют белки. 90 % этих белков — глобулины. В печени много ферментов, липидов, гликогена. Функции:
1. Гомеостатическая. Поддерживает постоянный состав крови (гомеостаз). Питательные вещества в желудочно-кишечном тракте всасываются периодически. Их концентрации в портальном кровотоке в разные периоды времени существенно различаются, но благодаря гомеостатической функции печени концентрации важнейших метаболитов в большом круге кровообращения практически постоянны.
2. Роль печени в обмене белков. Освобождающиеся в процессе пищеварения аминокислоты попа-дают с током крови в печень и используются для:
•синтеза белков плазмы крови (альбуминов, глобулинов, факторов свёртывания крови);
•образования α-кетокислот путём трансаминирования или окислительного дезаминирования амино-кислот;
•глюконеогенеза;
•синтеза кетоновых тел;
•получения энергии, подвергаясь превращениям в цикле трикарбоновых кислот;
•синтеза мочевины;
•синтеза креатина, холина.
3. Роль в обмене липидов. Печень играет ключевую роль в метаболизме липидов:
•в ней синтезируются, распадаются, удлиняются и укорачиваются жирные кислоты, поступающие с пищеили образующиеся при распаде простых и сложных липидов;
•распадаются и синтезируются триацилглицеролы;
•синтезируется большинство липопротеинов и 90 % из общего количества холестерола в организме;
•в печени из холестерола синтезируются желчные кислоты, которые входят в состав желчи, необхо-димой для переваривания липидов в кишечнике;
•печень — единственный орган, в котором синтезируются кетоновые тела;
•в печени синтезируются витамин А и 25-гидроксихолекальциферол (предшественник витамина D3), запасается (!) витамин В12.
4. Роль печени в обмене углеводов. Основная роль печени в метаболизме углеводов — это поддержа-ние нормальной концентрации глюкозы в крови благодаря тому, что в печени имеются:
•ферменты синтеза и распада гликогена;
•ферменты глюконеогенеза;
•ферменты, превращающие другие гексозы (галактозу и фруктозу) в глюкозу.
5. Антитоксическая функция. Поступающие в организм ксенобиотики (чужеродные вещества) и обра-зующиеся в самом организме токсичные или непригодные для дальнейших превращений продукты метаболиз-ма обезвреживаются в печени следующими способами:
•метилированием (никотиновая кислота);
•ацетилированием (сульфаниламидные препараты);
•окислением (алкоголь, ароматические углеводороды, катехоламины, биогенные амины);
•восстановлением (нитробензол);
•путём синтеза мочевины (аммиак);
•конъюгацией, т. е. связыванием с сильно полярными, отрицательно заряженными молекулами — ак-тивными формами глюкуроновой или серной кислот — УДФ-глюкуроновой кислотой и ФАФС (фосфоаденоз-инфосфосульфатом). Так метаболизируются стероидные гормоны, билирубин, продукты гниения белков в ки-шечнике, фенолы, желчные кислоты;
•с помощью микросомной системы монооксигеназ (лекарственные препараты и канцерогены) и ре-дуктаз (кетоны, альдегиды, красители);
•с помощью ферментов пероксисомного окисления — оксидаз и каталаз (мочевая кислота, аминокис-лоты, лактат, пероксид водорода).
6. Роль печени в обмене желчных пигментов. Эритроциты живут приблизительно 120 дней, а затем разрушаются, главным образом, в печени, селезёнке и костном мозге, при этом разрушается и гемоглобин. Рас-пад гемоглобина протекает в клетках макрофагов, в частности, в звёздчатых ретикулоэндотелиоцитах, а также в гистиоцитах соединительной ткани любого органа.
7. Синтез гемоглобина. Гемоглобин — сложный белок, состоящий из белка глобина и небелковой ча-сти — гема. Глобин синтезируется как обычный белок, а синтез гема представляет собой сложный многоста-дийный процесс, поэтому мы выделим в нём только основные этапы. Все клетки, имеющие ядро, могут синте-зировать гем, но в количественном плане наиболее интенсивно синтез гема протекает в печени и костном мозге.
8. Экскреторная функция. Из печени различные вещества эндо- и экзогенного происхождения или поступают в желчные протоки и выводятся с желчью (более 40 соединений), или попадают в кровь, откуда выводятся почками.
3. Гемостаз – все процессы, направленные на сохранение крови в кровеносном русле, препятствующие кровоточивости и обусловливающие восстановление кровотока в случае обтурации сосуда тромбом.
Механизмы гемостаза: а) сосудисто-тромбоцитарный (микроциркуляторный, первичный, клеточный) б) коагуляционный (макроциркуляторный, плазменно-тромбоцитарный, вторичный).
Основные структурно-функциональные компоненты гемостаза: 1) стенка кровеносного сосуда 2) клетки крови (преимущественно тромбоциты, также эритроциты, лейкоциты) 3) система свертывания крови.
4. Витамин Н (биотин, антисеборрейный). Суточная потребность: 150–200 мкг. Пищевые источники: синтезируется микрофлорой кишечника, это в значительной мере удовлетворяет потребности орга-низма в нем; бобовые, цветная капуста, грибы, печень, почки, молоко, яичный желток.
Химическое строение и свойства: состоит из имидазольного и тетрагидротиофенового колец, боковая цепь представлена валериановой кислотой. Плохо растворяется в воде, хорошо в спирте. Устойчив при нагревании. Биотин способен образовывать с авидином – гликопротеином белка куриного яйца - прочный комплекс, который не может расщепляться пищеварительными ферментами. Поэтому при частом употреблении сырых яиц прекращается всасывание присутствующего в пище биотина.
Биохимические функции:
Коферментная форма – биотин (карбоксибиотинлизин – в тканях, карбоксибиотин – в крови).
Витамин Н способствует усвоению тканями ионов бикарбоната (но не СО2) и активирует реакции карбоксилирования и транскарбоксилирования в составе следующих карбоксибиотинил-ферментов:
1. Пируваткарбоксилазы – фермента, катализирующего АТФ-зависимое образование
оксалацетата из пирувата и НСО3- (ключевого митохондриального фермента глюконеогенеза)
пируват ЩУК + AДФ + Фн
2. Ацетил-КоА-карбоксилазы – первого фермента в реакциях биосинтеза жирных кислот. ацетил-КоА + АТФ + СО2 + Н2О = малонил-КоА + АДФ + Фн
3. Пропионил-КоА-карбоксилазы – фермента, участвующего в окислении жирных кислот с нечетным числом атомов угле-рода.
пропионил-КоА + АТФ + СО2 + Н2О метилмалонил-КоА + АДФ + Фн сукцинил-КоА (в результате изомеризации при участии витамина В12)
Гиповитаминоз.Проявляется дерматитом, жирной себореей, алопецией (очаговым облысением), сонливостью, усталостью, болями в мышцах.
5.
6. В чём заключаются сходства и принципиальные различия квашиоркора и маразма?
Клинические формы |
Квашиоркор (ранний период после тяжелых травм, ожогов, обширных хирургических вмешательств) |
Маразм (например, при онкологических заболеваниях) |
Первопричина |
Дефицит белка из-за отсутствия его в пище или нарушения всасывания |
Общая нехватка источников энергии |
Отек |
Имеет место вследствие снижения онкотического давления в кровеносных сосудах (гипоальбуминемия) |
Отсутствует |
Гипоальбуминемия |
«Низкий альбумин» в плазме крови — основной симптом. В печени сокращается продукция альбумина, чтобы сохранить потерю белка |
Отсутствует |
Ожирение печени |
Имеет место низкое содержание белка в пище, как правило, сочетается с высоким потреблением углеводов |
Отсутствует |
Уровень инсулина в крови |
Поддерживается на нормальном уровне |
Низкий — в организме преобладают катаболические процессы, направленные на извлечение энергии из любых оставшихся депо |
Уровень адреналина в крови |
Нормальный |
Высокий |
Потеря мышечной массы |
Отсутствует или слабая |
Да — может быть выраженной вследствие катаболизма белков |
Жировые запасы |
Некоторая потеря |
Их нет |
Характер течения в зависимости от времени |
Острое — выраженный катаболический ответ в короткий период времени |
Постепенно — нерезкий катаболический ответ на голодание (может занимать длительный период времени) |
Сниженная пигментация |
Может иметь место — для пигментации нужны аминокислоты (тирозин). Бледный вид |
|
Билет №15
1. Комплекс нарушений, вызванных недостаточностью функций инсулина, называется сахарным диабетом. Виды: инсулинозависимый сах.д-т(1 типа), не зависимый от инсулина(2 тип).Основные причины диабета-уменьшение поступления глюкозы в клетки, увеличение выхода свободной глюкозы в кровоток из печени. Жировая ткань: усиление поступления глюкозы в адипоциты, синтеза глицеролфосфата, образования триацилглицеролов, повышение синтеза жк. Мышечная ткань:усиление поступления глюкозы в миоциты,образования гликогена, поступления ак, синтеза белка на рибосомах.Печень: снижение кетогенеза,усиление синтеза белков и липидов, уменьшение высвобождения глюкозы. . Биохимическая диагностика сахарного диабета:1) качественное и количественное двукратное определение гл в крови по глюкозооксидазному методу.
2) тест на толерантность к глюкозой (пробу с нагрузкой глюкозой).
3) метод Хагедорна-Йенсена - количественный метод определения уровня сахара в крови, основанный на способности сахаров восстанавливать в щелочной среде красную кровяную соль в желтую; о содержании сахара судят по избытку красной кровяной соли, определяемому титрометрией.
4) качественное и количественное определение сахара в мочи (качественные реакции: Тромера, Фелинга, количественные реакции: глюкозооксидазный метод).
2. Антитоксич. ф-ция печени изуч. с помощь. Нагрузочных тестов. Например проба Квика-Пытеля: после приема пациентом бензоата натрия в моче определяют кол-во образовавшейся гиппуровой к-ты.При поражении паренхимы печени её синтез снижается и в моче опред-ся меньшее её кол-во.Введение красителей и определение скорости их элиминации: бромсульфталеин.По кол-ву животного индикана-конъюгата окисленного идола и ФАФС-в моче после приёма белковой пищи.
3. Бикарбонатная буферная система крови – наиболее важный буфер организма (10% буферной емкости крови). Поддерживаемая рН ~ 7,40. Компоненты: Н2СО3/NaHCO3.
Механизм действия:
1) Н+ + HCО3- Н2СО3 (слабо диссоциирующая). Последующее снижение концентрации угольной кислоты достигается в результате гипервентиляции легких и ускоренном выведении СО2.
2) OH- + H2CO3 H2O + HCО3-. При этом реализуется гиповентиляция легких для сохранения в плазме СО2
Гемоглобиновая и оксигемоглобиновая буферные системы крови – самые мощные в организме (более 75 всей буферной емкости крови), функционирует только в сочетании с гидрокарбонатной. Компоненты: KHb/HHb (гемоглобиновая буферная система), KHbO2/HHbO2 (оксигемоглобиновая буферная система).
Механизм действия:
HbO2- + Н+ ННbO2 ННb + O2
HHbO2 + OH- HbO2- + H2O
HHb + OH- Hb- + H2O
Hb- + H+ HHb
4. Вит.А.Биол.роль: структурн.компонент клет.мембран,регул.рост и диф-ку клеток эмбриона и молодого ор-ма,участвует в фотохим.акте зрения,компонент антиоксидантной защиты ор-ма,стимулирует р-ции клет.им-та,антиканцероген.Гиповитаминоз :куриная слепота(сниж.темновой адаптации),поражение эпит.тканей(язвы,бронхиты,фолликулярн.гиперкератоз) Гипервитаминоз: восп. Роговицы глаза,гиперкератоз,боли в суствах,увелич.печени.Пищ.источники:печень и жир морских рыб и млекопит,желток яиц,цельное молоко.Сут.потребность: 1.5-2 мг.
5. Фруктозо-2,6-дифосфат-аллостерический активатор фосфофруктокиназы-1-ключевого фермента гликолиза, синтезируется бифункциональным ферментом-фосфоруктокиназой-2.
6. Основной путь получения энергии - только аэробный распад глюкозы по ГБФ-пути. Глюкоза является почти единственным энергетическим субстратом, поступающим в нервную ткань, который может быть использован ее клетками для образования АТФ. Источники глюкозы.1. Поступление с пищей. 2. Распад гликогена печени (гликогенолиз)3. Образование из белков и липидов (глюконеогенез)
Билет №16
1. Гормон роста (соматотропный гормон, СТГ) синтезируется в ацидофильных клетках передней доли гипофиза. СТГ человека состоит из 191 аминокислоты и содержит 2 дисульфидные связи; N- и C-концевые аминокислоты представлены фенилаланином. СТГ усиливает биосинтез белка, ДНК, РНК и гликогена , способствует мобилизации жиров из депо и распаду высших ЖК и глюкозы в тканях, активирует процессы ассимиляции, стимулирует рост скелета, координирует и регулирует скорость протекания обменных процессов. Многие эффекты осуществляются через особый белковый фактор. Существует две теории, объясняющие механизм действия ГР: теория прямого воздействия и теория соматомедина (опосредованного воздействия). Согласно первой из теорий, свободные молекулы соматотропина могут воздействовать непосредственно на клетки, связываясь с рецепторами гормона роста на их поверхности. Вторая теория гласит, что гормон роста оказывает свое действие на организм посредством промежуточного вещества. Было установлено, что таким веществом является именно инсулиноподобный фактор роста.
2. В углеводном обмене: 1.нагрузочная проба галактозой.в норме выведение гал. в моче не более 8% через 12 ч.2. нагруз.проба глюкозой натощак.потом сравнивают с сахарн.кривыми. в норме конц. Глюк. повыш.в течение часа на 50-80%,через 2,5-3 ч возвр. в норму.
3. Гепарин-антикоагулянт прямого действия.Он синтезируется и накаплив. В гранулах тучных клеток и гранулоцитах крови.Эффективность действия зависит от степени сульфатирования молекулы.Цитрат нашёл широкое применение пр и заготовке крови для переливания.Он связывает ионы кальция.
4. Витамин К. Принимает участие в синтезе протромбина в печени через ферментную систему. Стимулятор биосинтеза в печени белков-ферментов: факторов II, VII, IX, X. Витамин К синтезируется микроорганизмами кишечника. Дополнительные источники — листья люцерны, свиная печень, рыбная мука и растительные масла, шпинат, цветная капуста, плоды шиповника, зелёные томаты. Считается достаточным количество около 1 мг. Недостаточность витамина К типична для новорождённых. У взрослых возникает на фоне основного заболевания. Проявления недостаточности витамина К:• Геморрагический синдром (носовые, желудочно-кишечные кровотечения, кровотечения из дёсен, внутрикожные и подкожные кровоизлияния), обычно сопровождающий основное заболевание. • При механической желтухе геморрагический синдром обычно появляется на 4-5-й день. • У новорождённых детей, находящихся на грудном вскармливании (грудное молоко содержит мало витамина К) и не получающих адекватные дозы витамина, могут возникать внутричерепные кровоизлияния или другие проявления геморрагического синдрома. Потребность – приблизительно 0,1 мг/сутки.
5. Адипоциты сразу после приёма пищи.
гликолиз
Глюкоза ---------- ФДА------глицерол 3-Ф---------ЖК----ТАГ
6. Квашиоркор - вид тяжёлой дистрофии на фоне недостатка белков в пищевом рационе. Болезнь обычно возникает у детей 1-4 лет, хотя бывает, что она возникает и в старшем возрасте. Один из симптомов — вздутость животов детей, часто возникающая у детей бедных районов Африки, объясняется тем, что клубни маниокa содержат лишь небольшое количество белка (1.2 %) и очень немногие незаменимые аминокислоты. При питании, основанном на маниоке, эти факторы приводят к детской пеллагре (квашиоркор). Из-за недостатка важных аминокислот внутренние органы накапливают воду. В связи с этим рекомендуется употребление также и листьев маниоки, содержащих большое количество белка, в качестве овоща.
Билет №17
1. простые : окситоцин, вазопрессин, тиреотропин, соматостатин .В их состав входит менее 20 аминокислот
сложные: кортикотропин- , соматотропин, пролактин, инсулин, глюкагон,кальцитонин.В составе более 20 АК
Пример действия простого белка: вазопрессин + 7-TMS рецептор Gq-белок ФЛ С ДАГ + ИФ3 Ca2+ 1) вазоконстрикция 2) усиливает реабсорбцию воды в нефроне.
Вазопрессин вырабатывается в задней доле гипофиза преимущестенно в нейронами супраоптического ядра. Способен повышать артериальное давление , сохранение воды в организме, и т.д.
2. Метаболизм этанола осуществляется тремя ферментативными системами: 1) алкогольдегидрогеназной (80%) 2) микросомальной этанолокисляющей системой (МЭОС – 15%) 3) каталазой (5%).
1) Алкогольдегидрогеназа наиболее активно метаболизирует этанол в печени, преимущественна локализована в цитозоле клеток (только 10% - в ЭПС и митохондриях). Катализирует реакцию образования ацетальдегида: этанол + НАД+ ацетальдегид + НАДН+Н+.
2) МЭОС катализирует реакцию: этанол + НАДФН+Н+ + О2 ацетальдегид + 2 Н2О.
3) каталаза катализирует реакцию: этанол + Н2О2 ацетальдегид + 2 Н2О.
Образующийся ацетальдегид далее окисляется ацетальдегиддегидрогеназой в уксусную кислоту, которая превращается в ацетил-КоА и 1) вступает в ЦТК или 2) идет на синтез ВЖК и холестерола. В сутки в тканях человека образуется и окисляется 1-9 г этанола.
Механизм развития жировой инфильтрации и дегенерации печени: избыточное потребление этанола увеличение содержания в гепатоцитах ВЖК и холестерола в печени происходит интенсивные распад и синтез фосфолипидов из компонентов нейтрального жира, однако для данного процесса необходимы неорганические фосфаты и так называемые липотропные факторы (холин) липотропные факторы не поступают или поступают в малом количестве накопление нейтральных жиров в гепатоцитах жировая инфильтрация печени и ее дегенерация.
3.
Компоненты: а) плазмин и его профермент – плазминоген
б) активаторы плазминогена (тканевой активатор плазминогена, урокиназа)
в) проактиваторы плазминогена
г) ингибиторы плазмина (α2-антиплазмин, α2-макроглобулин, α1-антитрипсин)
д) ингибиторы активаторов плазминогена (ПАИ-1, ПАИ-2, ПАИ-3, ПАИ-4).
Фибринолитическая система организма функционально направлена на естественный лизис фибрина, образующегося в процессе перманентного локального гемостаза на разных этапах формирования фибринового остова тромба: от фибрин-мономера, РКМФ и до фибрина I. Исследование показателей, характеризующих гемостаз, имеет большое значение в диагностике различных заболеваний (сердечно-сосудистая, акушерская, генетическая патология, системные заболевания, заболевания системы крови и др.), а также в профилактике осложнений после оперативных вмешательств и многое другое, что объясняет широкое применение данного вида обследования в современной медицине.
4. Гиповитаминоз представляет собой комплекс нарушений, возникающий в организме при недостаточном поступлении тех или иных витаминов. Крайней степенью витаминной недостаточности является авитаминоз. При чрезмерном употреблении некоторых витаминов возникают патологические состояния, называемые гипервитаминозами.
Причины:
1 Недостаток витамина в пище
2 Повышенные физические и психические нагрузки.
3 Применение антибиотиков широкого спектра действия и химиопре- паратов
4 Условия внешней среды.
5 Нарушение всасывания витаминов
6 Повышенная потеря витаминов с мочой при заболеваниях почек, применении мочегонных средств
7 Заболевания печени
Причины гипервитаминозов:
1. Употребление витаминных препаратов с лечебно-профилактическими целями (чаще)
2. Употребление больших количеств продуктов, богатых данным витамином (реже)
3. Случайные отравления
5.
6. При прохождении по кишечнику формируют матрикс фиброзного или аморфного характера по типу "молекулярного сита", физико-химические свойтсва которого обусловливают водоудерживающую способность, катионообменные и адсорбционные свойства, чувствительность к бактериальной ферментации в толстой кишке.
Наличие у них гидроксильных и карбоксильных групп способоствует, кроме гидратации, ионообменному набуханию.
Способность к набуханию, то есть удержанию и последующему выведению воды из организма, в большей степени выражена у аморфных .
способоствуют ускоренному кишечному транзиту, увеличению влажности и массы фекалий и снижению напряжения кишечной стенки
В желудке под их влиянием замедляется эвакуация пищи, что создает более длительное чувство насыщения, ограничивает потребление высокоэнергезированной пищи и способствует снижению избыточной массы тела.
Лигнины способны ингибировать переваривание оболочки кишечными микроорганизмами, поэтому наиболее насыщенные лигнином продукты (отруби и др.) плохо перевариваются в кишечнике.поэтому они хорошо очищают кишечник от различных шлаков действуя как губка.
Билет №18
1. Глюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению глюкагон является пептидным гормоном.
Молекула глюкагона состоит из 29 аминокислот и имеет молекулярный вес 3485 дальтон
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена (гликогенолиза). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ. Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.Глюкагон также активирует глюконеогенез, липолиз и кетогенез в печени.
2. Паренхиматозная желтуха (печеночная) – возникает в результате поражения и гибели гепатоцитов. Причины: гепатиты, рак печени.
Лабораторная диагностика.
а) гибель гепатоцитов увеличение прямого билирубина в крови и появление его в моче, увеличение АлАТ, АсАТ. Печень больна, поэтому непрямой билирубин не успевает превращаться в прямой увеличение в крови непрямого билирубина.
б) т.к. прямой билирубин выходит в кровь, в кишечник с желчью его попадает мало в моче и кале мало стеркобилина кал светлый.
в) печень поражена не разрушается уробилиноген повышение уровня уробилина в крови появление уробилина в моче моча темная.
3. Гипоксия – кислородное голодание – состояние, возникающее при недостаточном снабжении тканей организма кислородом или нарушении его утилизации в процессе биологического окисления.
I. Гипоксия вследствие понижения PО2 во вдыхаемом воздухе (экзогенная гипоксия) – возникает а) при подъеме на высоту б) при авариях в шахтах, неполадках на подводных лодках и т.п. Характеризуется развитием гипоксемии – уменьшением PО2 в артериальной крови и снижением насыщения гемоглобина кислородом.
II.Гипоксия при патологических процессах, нарушающих снабжение тканей кислородом при нормальном его содержании в окружающей среде.
а) дыхательный (легочной) тип – из-за альвеолярной гиповентиляции вследствие а) обструкции дыхательных путей (воспаление, отек, спазм) б) уменьшения дыхательной поверхности легких (отек легкого, пневмония). Часто к гипоксии присоединяется гиперкапния.
б) сердечно-сосудистый (циркуляторный) тип – при нарушения кровообращения, приводящего к недостаточному кровоснабжению органов и тканей.
в) кровяной (гемический) тип – в результате уменьшения кислородной емкости крови 1) при анемиях из-за а) уменьшения эритроцитов б) снижения содержания Hb в эритроцитах 2) при отравлениях угарным газом 3) при действии на Hb сильных окислителей (образование метгемоглобина)
г) тканевой (гистотоксический) тип – из-за нарушения способности ткани поглощать кислород из крови из-за 1) угнетения биологического окисления ингибиторами типа цианида, блокирующего цитохромоксидазу 2) нарушения синтеза ферментов 3) повреждения мембранных структур клетки.
4. Биологичечкое значение: Образование коллагена, серотонина из триптофана, образование катехоламинов, синтез кортикостероидов. Аскорбиновая кислота также участвует в превращении холестерина в желчные кислоты.
Витамин С необходим для детоксикации в гепатоцитах при участии цитохрома P450. Витамин С сам нейтрализует супероксид-анион радикал до перекиси водорода.
Восстанавливает убихинон и витамин Е. Стимулирует синтез интерферона, следовательно, участвует в иммуномодулировании. Переводит трёхвалентное железо в двухвалентное, тем самым способствует его всасыванию.
Тормозит гликозилирование гемоглобина, тормозит превращение глюкозы в сорбит.
Принято считать, что среди симптомов нехватки в организме витамина С находятся слабость иммунной системы, кровоточивость дёсен, бледность и сухость кожи, замедленное восстановление тканей после физических повреждений (раны, синяки), потускнение и выпадение волос, ломкость ногтей, вялость, быстрая утомляемость, ослабление мышечного тонуса, ревматоидные боли в крестце и конечностях (особенно нижних, боли в ступнях), расшатывание и выпадение зубов; хрупкость кровеносных сосудов приводит к кровоточивости дёсен, кровоизлияниям в виде тёмно-красных пятен на коже
Физиологическая потребность для взрослых — 90 мг/сутки (беременным женщинам рекомендуется употреблять на 10 мг больше, кормящим — на 30 мг)
Наиболее богаты аскорбиновой кислотой плоды свежего шиповника (650 мг/100 г), болгарского красного перца (250 мг/100 г),чёрной смородины и облепихи (200 мг/100 г), яблоки содержат (165 мг/100 г), перец зелёный сладкий и петрушка (150 мг/100 г),брюссельская капуста (120 мг/100 г), укроп и черемша (колба) (100 мг/100 г), земляника садовая (60 мг/100 г), цитрусовые (38—60 мг/100 г).[10], недозрелые плоды грецкого ореха, хвоя сосны и пихты[11]
5.
6. Пищевые волокна не являются источниками энергии. У человека они могут только частично расщепляться в толстой кишке под действием микроорганизмов. Так целлюлоза расщепляется на 30-40%, гемицеллюлоза - на 60-84%, пектиновые вещества - на 35%. Практически всю освобождающуюся при этом энергию бактерии кишечника используют на собственные нужды. Большая часть моносахаридов, образующихся при разложении пищевых волокон, превращается в летучие жирные кислоты (пропионовую, масляную и уксусную) и газы, необходимые для регуляции функции толстой кишки (водород, метан и др.).
Эти вещества могут частично всасываться через стенки кишечника, но в организм человека поступает лишь около 1% питательных веществ, образованных при расщеплении пищевых волокон. В энергетическом обмене эта доля ничтожна, и обычно этой энергией пренебрегают при изучении энергозатрат и калорийности рационов. Лигнин, которого довольно много в клеточных оболочках растительных продуктов, в организме человека совершенно не расщепляется и не усваивается.
Функции пищевых волокон в организме человека
Растворимые волокна лучше выводят тяжелые металлы, токсичные вещества, радиоизотопы, холестерин.
Нерастворимые волокна лучше удерживают воду, способствуя формированию мягкой эластичной массы в кишечнике и улучшая ее выведение.
Целлюлоза абсорбирует воду, помогает вывести из организма токсины и шлаки и регулировать уровень глюкозы.
Лигнин помогает удалять холестерин и желчные кислоты, находящиеся в желудочно-кишечном тракте.
Пектин предотвращает попадание в кровь избыточного холестерина и желчных кислот.
играют первостепенную роль в формировании каловых масс.
Билет №19
1. По хим природе:1)Белки(СТГ) и пептиды(АКТГ, гормоны гипоталамуса)2)Производные аминокислот( тир- Т3, Т4, катехоламины, три- серотонин, мелатонин;гис-гистамин)3)Производные холестерола( кортикостероиды,половые гормроны, витамин Д)4)Производные жирных кислот(эйкозаноиды ретиноевая кислота)
О собенности
синтеза инсулина и стероидных гормонов.
Стероидные гормоны синтезируются из
холестерола, не депонируются,генетически
не запрограммированы. Холестерол
образуется из ацетил-КоА. 1-я реакция:
превращение холестерола в прегненолон
после отщепления 6С-фрагмента от боковой
цепи (фермент С20-22 десмолаза). Десмолаза-
ключевой фермент в биосинтезе стероидов.
Его фосфорилирование стимулирует АКТГ.
2-я р-я:окисление и изомеризация
прегненолона в прогестерон. Прегненолон
явл. Предшественником всех стероидных
гормонов. В желтом теле(в яичниках)
синтез стероидов останавливается на
этапе образования прогестерона. Во всех
других стероидпродуцирующих тканях
прогестерон-промежуточный продукт. В
них прогестерон подвергается
гидроксилированию в положениях С-17 или
С-21 , в результате чего образуются
различные функциональные классы
стероидов.Гидроксилирование в положении
С-21 или С-11 приводит к образованию
минералокортикоидов, в С-17-глюкокортикоидов.
собенности
синтеза инсулина и стероидных гормонов.
Стероидные гормоны синтезируются из
холестерола, не депонируются,генетически
не запрограммированы. Холестерол
образуется из ацетил-КоА. 1-я реакция:
превращение холестерола в прегненолон
после отщепления 6С-фрагмента от боковой
цепи (фермент С20-22 десмолаза). Десмолаза-
ключевой фермент в биосинтезе стероидов.
Его фосфорилирование стимулирует АКТГ.
2-я р-я:окисление и изомеризация
прегненолона в прогестерон. Прегненолон
явл. Предшественником всех стероидных
гормонов. В желтом теле(в яичниках)
синтез стероидов останавливается на
этапе образования прогестерона. Во всех
других стероидпродуцирующих тканях
прогестерон-промежуточный продукт. В
них прогестерон подвергается
гидроксилированию в положениях С-17 или
С-21 , в результате чего образуются
различные функциональные классы
стероидов.Гидроксилирование в положении
С-21 или С-11 приводит к образованию
минералокортикоидов, в С-17-глюкокортикоидов.
Схема синтеза
Биосинтез инсулина осуществляется в бета-клетках панкреатических островков(по законам синтеза секретируемых белков). Исходным предшественником инсулина является
п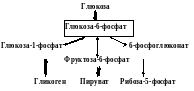 репроинсулин,содержащий
кроме проинсулина,его сигнальную
последовательность на N-конце,
состоящую из 23 остатков аминок-т,при
образовании проинсулина этот сигнальный
пептид отщепляется специальной
пептидазой. Проинсулин представлен
одной полипептидной цепью,содержащей
84 аминок-х остатка,неактивен,он
синтезируется во фракции микросом в
бета-клетках панкреатических островков.
Превращение неактивного проинсулина
в активный инсулин происх при перемещении
проинсулина от рибосом к секреторным
гранулам путем частичного
протеолиза(отщепление от С-конца полипепт
цепи пептида,содержащего 33 аминок-х
остатка и получившего название
соединяющего пептида,или С-пептида)
репроинсулин,содержащий
кроме проинсулина,его сигнальную
последовательность на N-конце,
состоящую из 23 остатков аминок-т,при
образовании проинсулина этот сигнальный
пептид отщепляется специальной
пептидазой. Проинсулин представлен
одной полипептидной цепью,содержащей
84 аминок-х остатка,неактивен,он
синтезируется во фракции микросом в
бета-клетках панкреатических островков.
Превращение неактивного проинсулина
в активный инсулин происх при перемещении
проинсулина от рибосом к секреторным
гранулам путем частичного
протеолиза(отщепление от С-конца полипепт
цепи пептида,содержащего 33 аминок-х
остатка и получившего название
соединяющего пептида,или С-пептида)
2. Поступающие в организм чужеродные в-ва (ксенобиотики) обезвреж в печени следующими способами:
1)метилирование(пиридин,кокаин) 2)ацетилирование(сульфаниламидные в-ва,изониазид),3)окисление(алкоголь,катехоламины,биоген амины,аром углеводы 4)восстановление(нитробензол) 5)путем синтеза мочевины 6)путем конъюгации с полярными молекулами УДФ-глюкуроновая к-та и ФАФС,т.к. из организма могут выводиться только водорастворимые соедин(стероидные горм,билирубин,снотворные,фенолы и проч.) 7) с помощ микросомного комплекса ферментов обезвреж лекарственные препараты,альдегиды ,кетоны,красители,канцерогены(некот из них становятся еще канцерогеннее) 8)с участием фермент пероксисомного окисления:оксидазы аминок-т,каталазы9)с помощ цистеин богатого б –металлотионеина, он связ с тяжел Ме :кадмий,медь,цинк,ртуть10)путем гидролиза-горм белково-пептид природы,аспирин.
3.кальций-зависимые факторы свертывания( ф.Х)??? роль кальция в гемокоагуляции:1)стабилизация сруктуры тромбопластинов2)связывание на тромбопластинах вит К-зависимых факоров гемокоагуляции( Ф II , фVII, ф IX, ф Х)3) активирование некоторых факторов свертывания ХIIIа 4)участие в ретракции тромба Концентрация= 1-1,3 ммоль/л . Кальцитонин, паратгормон
4. антивитамины делят на 2 группы:1)антивитамины,имеющие структуру, сходную со строением нативного витамина,и оказывающие действие ,основанное на конкурентных взаимоотношениях с ним; 2)антивитамины,вызывающие модификацию химической природы витаминов или затрудняющие их всасывание,транспорт,что приводит к снижению или потере биологического эффекта витаминов. Структуроподобные антивит –это антиметаболиты,которые при взаимодействии с апоферментом образуют неактивный ферментный комплекс.(развитие истинных авитаминозов). Антивит биологического происхождения(в т. Ч. Ферменты и белки),вызывающие расщепление или связывание молекул витам, лишая их физиологич действия(тиаминазы I и II,вызыв распад вит В1, аскорбатоксидаза-разруш вит С)
В медиц использ: дикумарол,варфарин и тромексан(антагонисты вит К)-антисвертывающие препараты
Окситиамин, пири- и неопиритиамин- антаг тиамина, рибофлавин-атербин,акрихин,галактофлавин(конкуренты В2), пиридоксин –дезоксипиридоксин,циклосерин,изониазид-против микобактерии туберкулеза; фолиевой- амино- и амитоптерины, вит В12 – производные 2-аминометилпропанол-В12, РР-изониазид, парааминобензойной –сульфаниламидные препараты, все они использ в качестве противоопухолевых или антибактериальных средств.
5. в адипоцитах увеличивается активность гормон-чувствительной липазы, усиливается высвобождение жирных кислот(исп в качестве источника энергии) и глицерола( фосфодиоксиацетон…используется для глюконеогенеза)
6. лептин-это гормон насыщения,продуцируется клетками подкож жировой клетчатки,чем >масса жир ткани,тем выше содержание лептина в крови. Он действует на свои рецепторы в гипоталамусе,блокир синтез/секрецию нейропептида У=>угнетение аппетита;действую через СНС ,ч/з бета3-Адренорецепторы,угнетает протеинкиназу А => увеличение разобщающего белка. Ген оb-ген ожирения,его дефект приведет к развитию ожирения из-за исчезновения чувства насыщения и накопления
Билет №20
1. Гормоны коры надпочечников – производные холестерола (стероидные гормоны): минералокортикоиды (альдостерон), глюкокортикоиды (кортизол, кортикостерон), андрогены (дегидроэпиандростерон и андростендион).
Механизм действия:
Рецепторы расположены в цитоплазме, состоят из трех частей:
1) домен АF1 – активатор транскрипции 2) ДНК-связывающий домен (имеет цинковые пальцы, закрытые белком – ингибитором hsp) 3) гидрофобный карман.
Гормон + гидрофобный карман сброс белка теплового шока (hsp) освобождение цинковых пальцев димеризация рецепторов (гомодимер) связь с ДНК запуск транскрипции.
Влияние на метаболизм:
альдостерона: 1) реабсорбция натрия почками, слюнными и др.железами; 2) секреции К+ и Н+ почками.
Конечный эффект действия глюкокортикоидных гормонов – повышение уровня глюкозы в крови при голодании и при снижении уровня инсулина.
Под влиянием глюкокортикоидов происходит:
Активирование катаболизма белков в мышечной и лимфоидной тканях, способствующее увеличению высвобождения аминокислот – основных субстратов глюконеогенеза.
Усиление механизмов распада аминокислот с образованием α-кетокислот из гликогенных аминокислот (индукция и активирование аминотрансфераз).
Увеличение скорости глюконеогенеза (активирование и индукция ключевых ферментов глюконеогенеза совместно с глюкагоном).
«Пермиссивное действие» на другие гормоны, позволяющее им стимулировать ключевые метаболические процессы, в том числе глюконеогенез, с максимальной эффективностью.
Снижение потребления глюкозы во внепеченочных тканях.
липолиза
клеточный иммунный ответ и рост костей
модулирует ЦНС
Андрогены надпочечников участвуют в синтезе белка, оказывая анаболическое действие, а также влияют на проявление некоторых вторичных мужских половых признаков.
2. Б/х показатели роли печени в белковом обмене:
А) Исследование белкового спектра крови.
альбуминово-глобулиновый коэффициент А/Г = 1,5-1,7 в норме. При острых поражениях А/Г за счет уменьшения уровня альбуминов, при хронических – за счет повышения глобулинов.
Б) .Исследование дезаминирования в печени. Если остаточный азот повышен за счет азота АК, это значит, что страдает дезаминирование АК в печени, если увеличение остаточного азота происходит за счет мочевины, это скорее свидетельствует о нарушении азотовыделительной функции почек.
В) Исследование мочевинообразовательной функции.
Азот мочевины / остаточный азот = 0,5 в норме, при поражениях печени снижается.
Г)Исследование активности ферментов плазмы крови, характеризующих печеночный обмен.
При заболеваниях паренхимы в крови резко увеличен уровень органо-специфического фермента – фруктозо-1-фосфат альдолазы, а также возрастает активность АлАТ и в меньшей степени АсАТ. Увеличена активность ЛДГ5, резко снижена активность холинэстеразы.
3. Механизмы транспорта углекислого газа кровью: HHbО2
Механизмы транспорта углекислого газа кровью.
а) часть СО2 переносится в физически растворенном виде (~ 6-7% всего СО2)
б) в карбаминовой форме (СО2, присоединенный к гемоглобину посредством карбаминовой связи) (~ 3-10% всего СО2)
3) в форме бикарбоната (более 80% всего СО2):
1. KHbO2O2 + KHb (в периферических капиллярах большого круга кровообращения, кислород поступает при этом в ткани из эритроцитов).
2. В обмен на кислород из тканей в эритроцит поступает СО2. В эритроците: СО2+ H2OH2CO3 (под действием карбоангидразы), КHb + H2CO3K+ + HCO3- + HHb.
3. Гидрокарбонат ионы выходят из эритроцитов в плазму, взамен в эритроцит поступают анионы хлора, для которых проницаема мембрана эритроцита. Для катионов натрия мембрана эритроцита не проницаема, они остаются в плазме и повышают содержание в ней NaHCO3 (восстанавливает щелочной резерв крови).
4. В легочных капиллярах: НHb + О2HHbО2, HHbО2 + K+ + HCO3-KHbO2 + H2CO3.
5. H2CO3 СО2 + H2O (под действием карбоангидразы). Углекислый газ диффундирует при этом в легкие.
6. Т.к. в эритроцитах снижается концентрация гидрокарбонат ионов, в них из плазмы поступают новые порции гидрокарбонат ионов, а в плазму выходят хлорид ионы.
