
- •1.Потенциал парного взаимодействия (Потенциал Леннарда - Джонса).
- •2. Агрегатное состояние вещества.
- •3. Жидкости и особенности их структуры.
- •4. Основные свойства жидкостей
- •5. Кристаллические и аморфные тела
- •6. Кристаллические тела и их структуры.
- •7. Дефекты кристаллического строения металлов
- •8. Точечные дефекты.
- •9. Межузельные пустоты в гцк решетке.
- •10. Межузельные пустоты в оцк и гп решетках.
- •12. Искажение решетки вокруг точечных дефектов.
- •13. Термодинамика точечных дефектов
- •14. Миграция точечных дефектов.
- •1Вакансии
- •2)Межузельные атомы.
- •15. Вакансионные комплексы.
- •16. Комплексы из межузельных атомов
- •17. Поведение вакансий при закалке
- •18. Методы определения концентрации вакансий, энергии образования и миграции.
- •2 Метод.
- •3 Метод.
- •19. Измерение энергии активации миграции вакансий.
- •20. Дислокации.
- •21. Краевые дислокации. Экстраплоскость. Ядро дислокации. Положительная и отрицательная дислокации, их обозначение.
- •22. Объяснение механизма скольжения краевой дислокации. Скорость скольжения краевой дислокации.
- •23. Переползание краевой дислокации. Пороги на краевой дислокации.
- •24.Винтовая дислокация. Отличие винтовой дислокации от краевой дислокации.
- •25. Скольжение винтовой дислокации.
- •26. Смешанные дислокации и их движения. Дислокационные петли.
- •27. Вектор Бюргерса
- •28. Энергия дислокаций. Вывод формулы энергии винтовой дислокации. Сравнение энергий винтовой и краевой дислокаций. Обсуждение формулы энергии дислокаций.
- •29. Взаимодействие параллельных краевых дислокаций.
- •30. Дислокационные стенки.
- •31. Взаимодействие параллельных винтовых дислокаций. Сила их взаимодействия.
- •32. Полные и частичные дислокации. Дислок. Реакции. Критерий Франка.
- •33. Плотнейшие упаковки
- •34. Дефекты упаковки
- •36. Характер теплового движения частиц в кристаллах.
- •37. Скорость упругих волн. Характеристики волн.
- •38. Колебательные моды линейной одноатомной цепочки.
- •39. Анализ закона дисперсии. Первая зона Бриллюэна.
- •40. Нормальные колебания линейной 2-х атомной цепочки.
- •41. Анализ закона дисперсии для двухатомной цепочки.
- •42. Акустическая и оптическая ветви двухатомной цепочки.
- •Оптическая ветвь
- •43. Колебания атомов в трехмерном одноатомном кристалле.
- •44. Классическая теория теплоёмкости кристалла. Её недостатки. Закон Дюлонга-Пти.
- •45 .Эйнштейновская теория теплоёмкости. Вывод формулы для средней энергии осциллятора. Анализ теории.
- •46. Дебаевская теория теплоемкости кристаллической решетки. Вывод формулы.
- •47. Анализ уравнения Дебая. Температура Дебая.
- •48. Теплопроводность твердых тел
- •49. Ангармонические эффекты. Тепловое расширение твёрдых тел.
1.Потенциал парного взаимодействия (Потенциал Леннарда - Джонса).
Лондон заметил, что хотя постоянный электрический дипольный момент нейтральных атомов, как и многих молекул, равен нулю, эти атомы притягиваются друг к другу электрическими силами.
О н
указал на то, что нулевые колебания,
существующие в силу принципа
неопределённости, создают у каждого
нейтрального атома флуктуирующий
дипольный момент с быстро меняющееся
ориентацией и величиной.
н
указал на то, что нулевые колебания,
существующие в силу принципа
неопределённости, создают у каждого
нейтрального атома флуктуирующий
дипольный момент с быстро меняющееся
ориентацией и величиной.
Напряжённость поля диполя убывает с расстоянием: E ~ 1/r3.
Т .о.
если ядра двух атомов находятся на
расстоянии r
друг от друга, диполь одного из атомов
в каждый момент времени создаёт в точке,
где находится др. диполь, мгновенное
поле, пропорциональное 1/r3.
Тогда потенциальная энергия взаимодействия
между диполями, приводящая к притяжению,
будет равной: Wприт.
=-A/r6
(1), A
– постоянная пропорциональности.
.о.
если ядра двух атомов находятся на
расстоянии r
друг от друга, диполь одного из атомов
в каждый момент времени создаёт в точке,
где находится др. диполь, мгновенное
поле, пропорциональное 1/r3.
Тогда потенциальная энергия взаимодействия
между диполями, приводящая к притяжению,
будет равной: Wприт.
=-A/r6
(1), A
– постоянная пропорциональности.
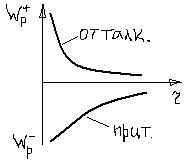
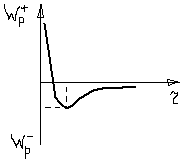
При уменьшении расстояния между атомами электронные облака начинают перекрываться, что и приводит к отталкиванию атомов друг от друга. Это можно понять исходя из принципа Паули. Следовательно, перекрытие электронных облаков должно привести к переходу некоторых электронов в более высокие квантовые состояния для чего требуется дополнительная энергия. Зависимость энергии отталкивания от рассеяния между атомами можно записать степенным законом: Wотт=B/r12 (2), B – коэф. пропорциональности.
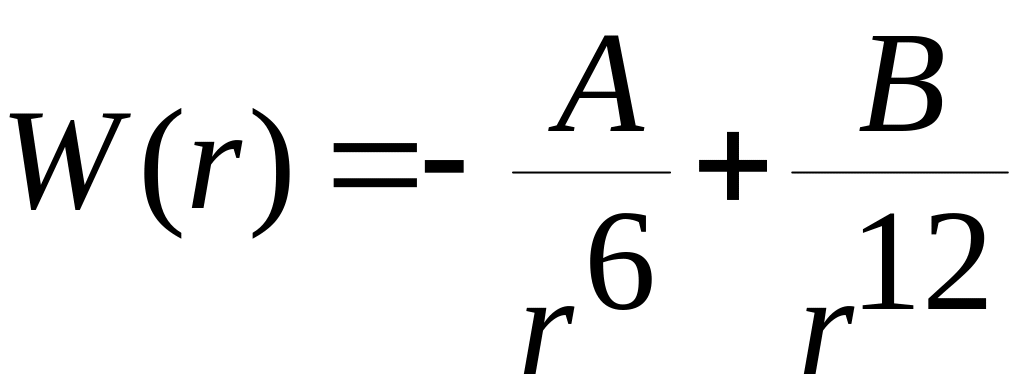 ,
(3) – взаимодействие между двумя
атомами(потенциал Леннарда – Джонса).
Иногда потенциальную энергию взаимодействия
атомов записывают в др. виде:
,
(3) – взаимодействие между двумя
атомами(потенциал Леннарда – Джонса).
Иногда потенциальную энергию взаимодействия
атомов записывают в др. виде: (4), где ρ – некоторая характеристическая
длина, малая по сравнению с межатомным
расстоянием.
(4), где ρ – некоторая характеристическая
длина, малая по сравнению с межатомным
расстоянием.
В 3-х мерных телах эффекты диполь-дипольного притяжения и отталкивания, обусловленного перекрытием электронных оболочек соседних атомов, складываются так, что полная энергия связи равна и в3-х мерном случае определяется выражением (4).
2. Агрегатное состояние вещества.
Любое вещество, в зависимости от внешних условий может находиться в различных агрегатных состояниях: жидкое, твёрдое, газообразное, плазма.
При попадании отдельного атома одного вещества на некоторую поверхность с температурой, меньше температуры кипения данного вещества, атом прилипнет к этой поверхности, т.е. совершит неупругий удар. При одной температуре совокупность атомов будет образовывать жидкость, а при другой – твёрдое состояние. Эти объекты, полученные из атомов, называются конденсатами, а сам процесс – конденсацией. Таким образом, объектами изучения будут жидкости и твёрдые тела. Твёрдые состояния делятся на кристаллические и аморфные тела. В дальнейшем на каждом из этих конкретных состояний остановимся более подробно. Подчеркнём, что основное внимание будет уделено кристаллическим твёрдым телам.
3. Жидкости и особенности их структуры.
Жидкость
нельзя рассматривать как сильно сжатый
газ. Количественное различие в их
плотности столь велико, что сво-ва
жидкости значительно отличаются от
сво-в газов. Различие сво-в обусловлено,
прежде всего, различием характера
теплового движения атомов в жидкостях
и газах. В жидкостях среднее расстояние
между атомами того же порядка, что и их
размеры. В газах расстояние между атомами
больше по сравнению с их размерами.
Поэтому перемещение атомов в объёме
жидкости крайне затруднено. Детальная
картина теплового движения атомов была
дана Френкелем: молекула жидкости в
течение некоторого времени колеблется
около определённого положения равновесия.
Затем, под воздействием окружающих
частиц скачком меняет своё место
равновесия, перемещаясь на расстояние
порядка размера этого атома. Если это
так, то молекулы жидкости делятся на 2
группы. Одни из них совершают беспорядочные
перемещения (кочующие), другие, совершая
колебательные движения, остаются на
месте (осёдлые). Между ними существует
динамическое равновесие. При увеличении
температуры возрастает доля кочующих
молекул. По Фр. сред. время осёдлой жизни
молекул связано с периодом их колебания:![]() ,
где φ – энергия, которую нужно сообщить
осёдлой частице для её перехода через
пот. барьер в соседнее положение
равновесия, τ0
– период колебания этой частицы.
,
где φ – энергия, которую нужно сообщить
осёдлой частице для её перехода через
пот. барьер в соседнее положение
равновесия, τ0
– период колебания этой частицы.
Если в газах молекула до столкновения с другой молекулой совершает некоторую длину свободного пробега, намного превышающий размер самой частицы, то в жидкостях дело обстоит немного по-другому. Г, Ж и крист. состояния различаются и степенью упорядоченности пространственного расположения частиц.
В Г молекулы в каждое мгновение находятся
беспорядочно, на разных расстояниях и
достаточно далеко друг от друга. В тв.
теле частицы плотно упакованы и образуют
крист. решётку. Порядок сохраняется на
всей протяжённости кристалла. Строгое
расположение атомов в кристаллах
называется дальним порядком.
Г молекулы в каждое мгновение находятся
беспорядочно, на разных расстояниях и
достаточно далеко друг от друга. В тв.
теле частицы плотно упакованы и образуют
крист. решётку. Порядок сохраняется на
всей протяжённости кристалла. Строгое
расположение атомов в кристаллах
называется дальним порядком.
В жидкости частицы плотно упакованы. Однако в расположении атомов наблюдается только частичная упорядоченность. Говорят, что в Ж имеется только ближний порядок. В Ж число ближайших соседей у фиксированных атомов будет примерно таким же, как и у атомов твёрдого тела, однако, на далёких расстояниях от выделенной частицы расположение атомов будет неупорядоченным. При этом если в твёрдом теле кристаллическая решётка сохраняется со временем, то в жидкой структуре ближний порядок непрерывно меняется вследствие малости времени осёдлой жизни атомов (τ~10-11с).
