
- •Введение в строение генома человека
- •От предположений до проекта «Геном человека»
- •Уже многое известно о строении генома человека
- •Уникальность человека не связана прямо с числом уникальных последовательностей.
- •Число повторяющихся элементов в геноме человека беспрецедентно для любого другого известного генома
- •Умеренно повторяющиеся последовательности способны перемещаться по геному
- •Мобильные элементы оказывают существенное влияние на функции генома
- •Среди повторяющихся последовательностей обнаружены семейства генов
- •Однонуклеотидный полиморфизм- основа индивидуальности человека.
- •Биосинтез днк – один из важнейших процессов передачи генетической информации последующим поколениям и ее хранения.
- •Д ля перемещения днк-полимеразы молекулу матрицы следует «раскрутить»
- •Ретровирусы внесли изменения в центральную догму молекулярной билогии.
- •Биосинтез днк у эукариот связан с циклом деления клетки.
- •Выход из состояния пролиферативного покоя требует специальных регуляторов.
- •У эукариот свой набор днк полимераз
- •Теломеры – «молекулярные часы клетки»
- •Генетический материал может изменяться и перестраиваться
- •Точечные мутации – результат влияния внешней среды на геном.
- •Некоторые перестройки генетического материала могут быть восстановлены.
- •Димеры пиримидинов в днк удаляются двумя механизмами.
- •Транскрипция – первый шаг на пути экспрессии генетической информации в клетке.
- •Механизм синтеза рнк во многом напоминает синтез днк
- •Транскриптон (оперон) - единица транскрипции.
- •Промоторы имеют сходное строение
- •У эукариот – 3 рнк- полимеразы
- •В транскрипции у прокариот важная роль принадлежит -фактору
- •У эукариот молекула рнк модифицируется после транскрипции.
- •Кэпирование и полиаденилирование иРнКопределяют дальнейшие особенности функций иРнк
- •Сплайсинг – способ создания многообразия белков
- •Процессинг продуктов рнк-полимераз I и III не похож на процессинг иРнк
Среди повторяющихся последовательностей обнаружены семейства генов
Еще один источник повторной ДНК - семейства генов. К умеренным повторам относят как транскрибируемые и транслируемые, так и только транскрибируемые, но не транслируемые последовательности ДНК и регуляторные участки.(см табл)
Таблица 8.7.Примеры участков генома с умеренно повторяющимися последовательностями. |
|||
Умеренные повторы |
|||
Гены |
регуляторные участки |
||
транскрибируемые транслируемые Гены белков рибосом, гистоновые гены, гены мембранных белков, цитоскелетных белков, гены иммуноглобулинов |
транскрибируемые не транслируемые гены рРНК, sРНК, тРНК |
энхансерные модули, ori репликации, промоторы и терминаторы транскрипции |
|
Гены тРНК в среднем повторяются в геноме 5 тыс. раз. Гены sРНК - сотни тысяч раз.
Многие уникальные гены фактически выделились в семейства очень подобных генов. Например, гены гемоглобина человека развились из одиночного предкового гена. Обнаружены теперь два подсемейства таких генов, гены глобина и гены - глобина. Каждое подсемейство состоит из кластера из нескольких генов, расположенных на двух различных хромосомах. Индивидуальные гены экспрессируются в разное время в течение развития. В дополнение к функциональным генам гемоглобина, кластеры генов также содержат несколько псевдогенов.
Клетка эукариот обладает способностью умножать некоторые последовательности под влиянием внешней среды. Например, при длительном лечении метотрексатом, ингибитором дигидрофолат редуктазы, часто возникают клетки, устойчивые к этому лекарственному средству. Исследование генома таких клеток обнаружило появление сотен тандемных дупликаций гена, кодирующего дигидрофолат редуктазу. (Повторяющаяся единица был значительно большей, чем длина гена, которая могла ожидаться если бы дублирование было следствием рекомбинации.) Это позволило клетке резко повысить продукцию фермента и таким образом компенсировать ингибирующий эффект метотрексата. Такие амплификации гена, вероятно, происходят часто, но не всегда замечаются.
Однонуклеотидный полиморфизм- основа индивидуальности человека.
Исследование последовательности нуклеотидов генома человека выявило около 3 млн участков, которые были заняты разными парами оснований (0,1% всего генома) у разных людей. Примерно на каждую 1000 пар нуклеотидов встречается одна замена нуклеотида. Введение понятия однонуклеотидный полиморфизм (ОНП) позволяет индивидуализировать геномы каждого человека и значительно изменяет развитие практической медицины в будущем. Составленные карты ОНП позволят при высоко автоматизированной технике анализа последовательности быстро обнаруживать такие ОНП и связывать их с индивидуальными особенностями больного человека.
Биосинтез днк – один из важнейших процессов передачи генетической информации последующим поколениям и ее хранения.
Известно несколько разных по биологическому назначению процессов биосинтеза ДНК. Некоторые их этих процессов проходят во всех типах клеток (репликация и репарация ДНК, синтез ДНК митохондрий), другие же - только в специализированных (например, осуществляющих синтез антител, транспозонов) или инфицированных вирусами клетках (репликация бактериофагов и вирусов). Все эти процессы катализируются разными ДНК- полимеразами, различающимися по числу субъединиц, молекулярной массе, ассоциацией с разными вспомогательными белками, ускоряющими процессы биосинтеза ДНК, и по многим другим структурным свойствам и функциональному назначению. В целом общие принципы синтеза ДНК схожи, однако, несомненно, существуют и различия, обусловленные видовыми и клеточными особенностями.
Как уже упоминалось выше синтез ДНК в подавляющем большинстве случаев проходит по полуконсервативному механизму, то есть дочерняя цепь ДНК синтезируется на материнской цепи, называемой обычно матрицей. Матрицами могут быть односпиральные ДНК или РНК. Ферменты, катализирующие синтез ДНК - полимеразы различаются по многим показателям. Одни из них синтезируют дочерние цепи ДНК процессивно, то есть, диссоциируя из комплекса с матричной цепью ( М-дДНК ) после удлинения дДНК на десятки нуклеотидных остатков (вплоть до полного окончания процесса), другие же функционируют дистрибютивно, диссоциируя из комплекса с матрицей практически после каждого шага удлинения. Процессивность полимераз усиливается специальными дополнительными беловыми факторами. Все ДНК-полимеразы нуждаются для начала своей работы в предварительно синтезированных олигонуклеотидах – затравках, 3’-ОН группа которых используется для удлинения цепи. (Эти короткие отрезки, обычно, рибонуклеотидов синтезируются специальными РНК-полимеразами. По названию затравки – праймер эти полимеразы получили название праймаз). Все ДНК-полимеразы формируют дочерние цепи в одном направлении 5’ 3’, перемещаясь по матричной ДНК в направлении 3’ 5’. На ДНК-полимеразы возложена ответственность за точность репликации, поэтому многие из них обладают экзонуклеазной корректирующей активностью, действующей в направлении 3’ 5’. Субстратами ДНК полимераз являются дезоксирибонуклеозидтрифосфаты.
Основные принципы синтеза ДНК были изучены в исследованиях с прокариотами.
Процесс репликации ДНК на уровне отдельных молекул удалось впервые показать при помощи ауторадиографии Джону Каирнсу. Он метил бактерии радиоактивным 3 H-тимидином и через короткий промежуток времени осторожно лизировал клетки, а выделенную ДНК помещал на нитроцеллюлозный фильтр. Контуры радиоактивно меченых молекул ДНК становились видимыми после заливки фильтров фотоэмульсией. Бактериальная ДНК имела структуру, напоминающую греческую букву с двумя точками ветвления. Такая структура впоследствии была названа репликативным «пузырем» или «глазом».
Инициация репликации ДНК начинается в специальных участках со специфической нуклеотидной последовательностью (Эти участки получили название ori от origin - начало) и продолжается в двух направлениях до тех пор, пока репликативные вилки не встречаются на противоположной стороне кольцевой хромосомы бактерии. После завершения процесса две связанные кольцевые дочерние молекулы разделяются при участии специальной ферментной системы..
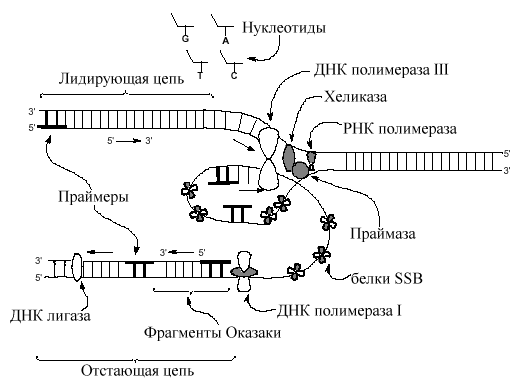
Скорость репликации (перемещения вилки) у бактерий составляет приблизительно 50,000-100000 пар нуклеотидов в минуту при 37 0 C. Родительская двойная спираль ДНК при такой скорости перемещения должна раскручиваться со скоростью 5,000-10000 об\мин (один виток молекулы образуется 10 парами азотистых оснований). Такой простой расчет указывает на определенные чисто механические проблемы, возникающие в процессе репликации. Основные участники процесса репликации и их основные функции у прокариот перечисляются в следующей таблице.
Таблица 8-8. Основные ферменты и белки, участвующие в процессе репликации |
|
Белок |
Функция |
DnaB белок |
Главный белок праймосомы раскручивает ДНК в сайте ori |
DnaC белок |
Образует комплекс с dnaB |
Белок Rep |
Хеликаза (раскручивает ДНК в репликационной вилке) |
Праймаза (dnaG) |
Синтезирует РНК-затравку |
ДНК-полимеразаIII |
Полимераза, катализирующая репликацию |
SSB |
Связывается с одноцепочечной ДНК в репликативной вилке для предотвращения образования двойной спирали |
ДНК-полимеразаI |
Удаляет РНК-затравку, заполняя пробел |
ДНК лигаза |
Катализирует образование 3 ’, 5 -фосфодиэфирной связи, соединяя фрагменты Оказаки |
Топоизомераза I |
Ослабляет суперспирализацию ДНК |
Топоизомераза II |
Разделяет ДНК после репликации |
Последовательность событий в механизме репликации у Е Coli следует строго определенному сценарию.
oric - инициирующая последовательность E.Coli длиной в 245 пар. Отдельные участки этой последовательности характеризуются высоким содержанием АТ пар и таким образом денатурируются относительно легко. К этому участку присоединяется белок - продукт гена DnaA.и специфические основные белки (HU и IHF) которые облегчают изгиб ДНК, образование которого - важный шаг в инициации репликации:

Рис.8-23.Структура oric и механизм инициации репликации у Е.coli
Комплекс из 10-20 молекул белка DnaA и ATФ связываются с oric . Молекула ДНК при этом образует изгиб и в зоне изгиба происходит плавление молекулы ДНК и раскрытие цепей. Активность молекул DnaA поддерживается специальным липидом – кардиолипином..
Комплекс из белков DnaC и DnaB связывается к обеим освободившимся цепям открытой петли и DnaB, обладающий активностью хеликазы, раскручивает молекулу ДНК открывая большее количество нуклеотидов. Белки SSB связываются с открытыми цепями, предотвращая их обратное скручивание.
Белок DnaG (праймаза) присоединяется к открытым цепям ДНК и катализирует синтез РНК- затравки. Некоторые праймеры могут быть синтезированы РНК-полимеразой. Ключом к открытию рибонуклеотидной природы праймеров послужило наблюдение, что репликация ДНК некоторых фагов тормозилась рифампицином (антибиотиком), который ингибировал РНК полимеразу. Длина праймеров составляет 10-12 нуклеотидов. Праймеры синтезируются на обеих цепях. Комплекс белков DnaB (хеликаза), DnaC и DnaG (праймаза) получил название праймосома
 Затем
в дело вступает ДНК-полимераза III.
Как
оказалось, выше упомянутая ДНК
полимераза открытая А.Корнбергом и
теперь называемая ДНК-полимеразаI
(Pol
I)
- не основной фермент репликации, хотя
и играет существенную роль в процессе
репликации (см. позже). У E.
coli
выделены две дополнительных
ДНК-полимеразы, полимераза II
(Pol
II)
и полимераза III (Pol
III).
Точная функция полимеразы II
в клетке пока не известна. Основным
ферментом, катализирующим репликацию,
является полимераза
III.
Помимо
полимеразной активности все бакте
Затем
в дело вступает ДНК-полимераза III.
Как
оказалось, выше упомянутая ДНК
полимераза открытая А.Корнбергом и
теперь называемая ДНК-полимеразаI
(Pol
I)
- не основной фермент репликации, хотя
и играет существенную роль в процессе
репликации (см. позже). У E.
coli
выделены две дополнительных
ДНК-полимеразы, полимераза II
(Pol
II)
и полимераза III (Pol
III).
Точная функция полимеразы II
в клетке пока не известна. Основным
ферментом, катализирующим репликацию,
является полимераза
III.
Помимо
полимеразной активности все бакте
Рис.8.24. Механизм репликации у прокариот
риальные ДНК-полимеразыобладают 3 '-5 ' экзонуклеазной активностью. Способность катализировать гидролиз фосфодиэфирных связей и удалять нуклеотиды с 3’ концов, действуя в противоположном от своей полимеразной активности направлении, позволяет полимеразам проверять и устранять ошибки своей деятельности.
Если к растущей цепи добавляется неправильный нуклеотид, он немедленно удаляется до завершения синтеза. У полимеразы I и III обнаружена и 5 '-3 ' экзонуклеазная активность, что позволяет им участвовать в процессах репарации ДНК. Эта же экзонуклеазная активность полимеразы I используется также для удаления РНК- затравок, которые инициируют синтез цепей ДНК (см. ниже). Работе ДНК- полимеразы предшествует первичный отбор комплементарного матрице дНТФ, который проходит в общем одинаково для разных ДНК-полимераз Этот отбор начинается с образования канонических Уотсон-Криковских пар оснований. Их образование энергетически более выгодно, поскольку при этом образуется оптимальное по сравнению с другими возможными вариантами число водородных связей. Кроме того, правильно образованные пары оказывают влияние на конформационное изменение ДНК-полимеразы, направленное на ускорение реакции элонгации и последующего перемещения фермента. При образовании неправильной пары резко ухудшается кинетика процесса. Скорость перемещения фермента замедляется. При кинетической задержке элонгации цепи , возникающей в результате включения некомплементарного 3'-нуклеотидного остатка и возникновения ошибочной пары начинает проявляться активность другого центра ДНК полимеразы, расположенного вблизи центра полимеризации и, по-видимому, частично совмещающегося с ним. Этот активный центр, катализирующий 3'->5'-экзонуклеазный гидролиз удаляет некомплементарный 3'-концевой нуклеотидный остаток. Ошибочные пары возникают с частотой порядка 1: 104 - 1: 106. Дело в том, что ДНК-полимеразе на каждом шагу элонгации дДНК приходится выбирать один из четырех различающихся по структуре дНТФ в условиях, когда матричный нуклеотидный остаток в образующейся паре также вариабелен из-за соседних нуклеотидных остатков, влияющих на конформацию односпирального участка матрицы в активном центре. Редактирующая активность фермента понижает частоту ошибок в 10-100 раз.
ДНК-полимераза копирует антипараллельные цепи ДНК перемещаясь в 5 ' 3 ' направлении
Как можно объяснить, что ДНК-полимераза копирует антипараллельные цепи матрицы ДНК в одном 5 ' 3 ' направлении одновременно? Предложена модель, согласно которой ДНК-полимераза формирует димер, связанный с другими необходимыми в репликативной вилке белками (реплисома) . Одна из цепей матричной ДНК, названная отстающей цепью, временно образует петли вокруг реплисомы так, что димер ДНК-полимеразы получает возможность перемещаться по обеим цепям в одном 3' 5 ' направлении одновременно на короткое расстояние. Мономер ДНК-полимеразы, копирующий эту цепь обладает низкой процессивностью и через небольшой промежуток времени, синтезировав короткий отрезок ДНК, покидает матричную отстающую цепь. Эти короткие (до 1000 пар нуклеотидов) отрезки ДНК, образующиеся на отстающей цепи, получили название фрагментов Оказаки по имени Ф. Оказаки, впервые (1968) указавшего на прерывистый характер синтеза ДНК. Новое присоединение мономера ДНК-полимеразык матрице происходит после предварительного синтеза нового праймера. Вторая половина димера ДНК-полимеразыреплисомы , обладающая более высокой процессивностью, в чем ей помогают специфические белки, копирует дочернюю цепь ДНК без перерывов. Матричную цепь, которая копируется без перерывов, назвали ведущей цепью. Так как репликативная вилка довольно быстро (1000 нулеотидов в сек) продвигается по матрице вновь синтезируемые дочерние цепи и родительские цепи матрицы сразу формируют двойные спирали ДНК. Предполагается, что только маленький отрезок матричной двойной спирали находится в одноцепочечном состоянии в данный отрезок времени. Праймеры ведущей и отстающей цепей (10-12 пар нуклеотидов) удаляются ДНК полимеразой I, обладающей репарирующей функцией с одновременной заменой рибонуклеотидов дезоксирибонуклеотидами. Промежутки, которые возникают между 3 '-ОН и 5 '- фосфатом , воссоединяются лигазами ДНК, завершая тем самым процесс репликации.
