
- •Практикум Общие правила работы в лаборатории
- •Техника безопасности и меры предосторожности
- •1. Основные понятия и законы химии
- •1.1. Семинар: Основные законы и понятия химии
- •1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
- •1.3. Контрольные вопросы
- •2. Термодинамика химической реакции
- •2.1. Семинар: Энергетика химических процессов
- •2.2. Лабораторная работа №2 Термодинамика химических реакций
- •2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
- •2.2.2. Химическая реакция в открытой системе
- •2.2.3. Образование структур при нагревании жидкости
- •2.3. Контрольные вопросы
- •3. Кинетика химической реакции
- •3.1. Семинар: Скорость химических реакций и химическое равновесие
- •3.2. Лабораторная работа №3. Скорость химических реакций
- •3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
- •3.2.2. Зависимость скорости реакции от температуры
- •4.2. Семинар: Электролитическая диссоциация
- •4.3. Лабораторная работа №4. Электролиты
- •4.3.1. Определение среды растворов солей
- •4.3.2. Изучение влияния температуры на равновесие гидролиза
- •4.3.3. Исследование поведения двух солей в растворе
- •4.3.4. Исследование буферных растворов
- •4.3.5. Изучение влияние среды раствора на состав ионов хрома (VI)
- •4.3.6. Приготовление растворов заданной концентрации. Титрование
- •4.4. Контрольные вопросы
- •4.5. Семинар: Растворимость малорастворимых соединений
- •5. Окислительно-восстановительные процессы
- •5.1. Семинар: Окислительно-восстановительные реакции
- •5.2. Окислительно-восстановительные процессы
- •6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
- •6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
- •6.2.2. Изучение реакций комплексных соединений кобальта (II)
- •6.2.3. Качественные реакции ионов железа (II),(III)
- •6.3. Контрольные вопросы
3.2. Лабораторная работа №3. Скорость химических реакций
Цель: доказать что скорость реакции зависит от концентрации ионов и эта зависимость имеет определенный характер; установить экспериментально, что скорость реакции при повышении температуры на каждые 100С изменяется (подчиняется правилу Вант-Гоффа); научиться рассчитывать порядок реакции по экспериментальным данным; изучить кинетику разложения пероксида водорода в водном растворе.
3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
При растворении в воде тиосульфата (гипосульфита) натрия соль диссоциирует на ионы натрия и тиосульфат-ионы:
![]()
В кислотной среде тиосульфат-ионы переходят в слабую тиосерную кислоту, которая неустойчива и распадается на серу и сульфит-ион. Образовавшиеся атомы серы, объединяются в кристаллические зародыши, из которых постепенно образуется суспензия серы, выпадающая в осадок.
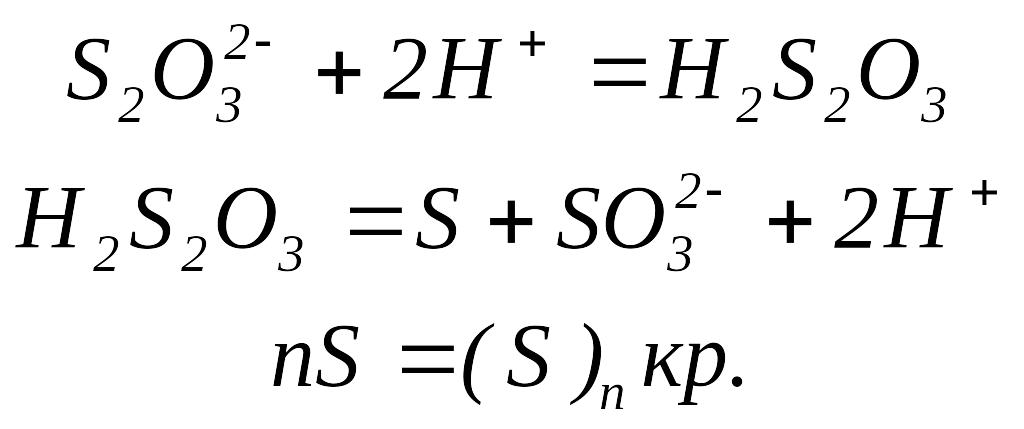
Именно третья реакция – лимитирующая стадия процесса, но скорость этой стадии зависит от концентрации серы в растворе, которая определяется в конечном итоге концентрацией ионов водорода и тиосульфат-ионов. Скорость реакции экспериментально определяют по времени помутнения раствора.
В три пробирки наливают по 2 мл 0,5 н. раствора H2SO4, затем в первую добавляют 2 мл 1 н. раствора Na2S2O3 и 4 мл H2O; во вторую – 4 мл 1 н. раствора Na2S2O3 и 2 мл H2O; в третью – 6 мл 1 н. Na2S2O3. Объемы измеряют мерной пипеткой. Отсчитывают время по секундомеру с момента сливания до появления мути в каждой пробирке (таблица 3).
Таблица 3
Экспериментальные данные
№ пробирки |
V (Na2S2O3), мл |
V(H2O), мл |
V (H2SO4), мл |
Vобщ |
отношение исходных концентраций |
время |
скорость реакции |
1 |
2 |
4 |
2 |
8 |
1:1 |
|
|
2 |
4 |
2 |
2 |
8 |
2:1 |
|
|
3 |
6 |
- |
2 |
8 |
3:1 |
|
|
Построить график зависимости скорости реакции от концентрации, сделать вывод о характере зависимости, приняв скорость реакции ~1/t. Рассчитайте порядок реакции по тиосульфат-иону.
3.2.2. Зависимость скорости реакции от температуры
В три пробирки наливают по 5 мл 0,5 н. раствора серной кислоты, а в три другие – по 5 мл 0,5 н. раствора тиосульфата натрия. Помещают все пробирки в стакан с водой и через 5-7 минут, измерив температуру воды в стакане, сливают вместе содержимое одной пары пробирок с серной кислотой и тиосульфатом натрия и отсчитывают время по секундомеру с момента сливания до начала появления мути (таблица 4).
Стаканчик с оставшимися пробирками ставят на асбестовую сетку, подогревают на 100С и вновь выдерживают растворы при этой температуре 5 минут. Слив содержимое второй пары пробирок с серной кислотой и тиосульфатом натрия, определяют время начала появления мути.
Опыт с последней парой пробирок проводят при температуре на 200С выше первоначальной.
Таблица 4
Экспериментальные данные
температура, 0С |
промежуток времени от начала отсчета до помутнения, сек |
скорость реакции |
|
|
|
Построить графики зависимостей: время реакции – температура, скорости реакции (обратное время) - температура.
3.2.3. Каталитическое разложение пероксида водорода
Пероксид водорода неустойчив и самопроизвольно распадается:
![]()
Реакция ускоряется при введении многих веществ, например диоксида марганца, перманганата калия, дихромата калия и др.
К 2 мл перекиси водорода прибавляют небольшое количество оксида марганца (IV) и наблюдают энергичное разложение перекиси водорода с выделением кислорода.
3.3. Контрольные вопросы
1. В соответствии с данными работы 3.3.1. предскажите, как изменится скорость реакции при разбавлении в 2 раза.
2. Зависит ли энергия активации от температуры?
3. Каков механизм влияния катализатора на скорость реакции?
4. РАСТВОРЫ
4.1. Семинар: Коллигативные свойства растворов
1. Способы выражения концентрации (мольная доля, молярность, моляльность массовая доля).
2 Давление насыщенных паров над раствором
3. Закон Рауля и его термодинамическое обоснование. Следствия из закона Рауля. Температура кипения и кристаллизации раствора. Осмотическое давление.
4. Коллигативные свойства растворов электролитов.
5. Изотонический эффект. Степень электролитической диссоциации.
Наиболее часто используемых в химической практике величинах, характеризующих содержание растворенного вещества.
Массовая
концентрация,
![]() ,
г/л;
,
г/л;
Молярная
концентрация,
![]() ,
моль/л;
,
моль/л;
Моляльная
концентрация,
![]() моль/кг;
моль/кг;
Процентная
концентрация,
![]() ;
;
Мольная
доля,
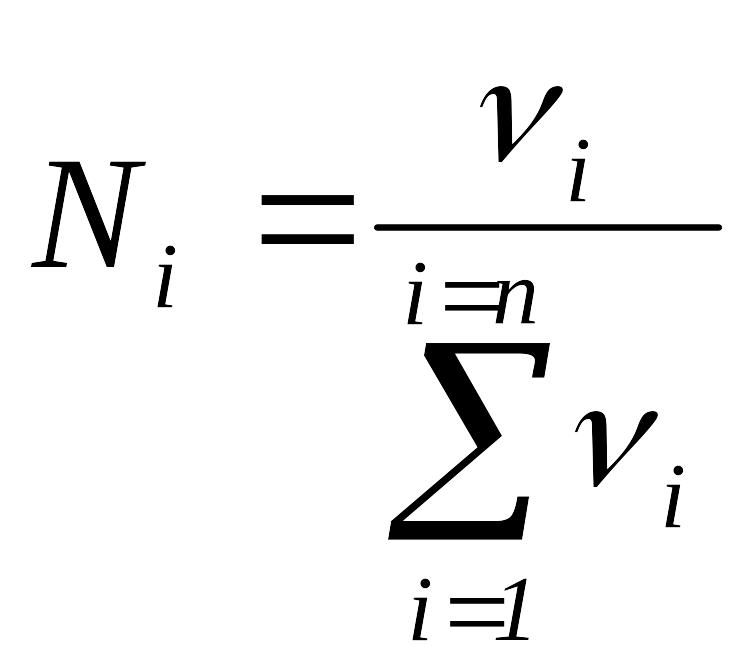 .
.
Физико-химические свойства растворов, не зависящие от химической природы растворенных частиц, а зависят только от их концентрации – называются коллигативными.
Основной закон, определяющий коллигативные свойства, - закон Рауля, согласно которому давление пара растворителя р1 над раствором нелетучего неэлектролита прямо пропорционально мольной доле растворителя N1:
![]()
p0 – давление насыщенного пара над чистым растворителем, Па.
Закон Рауля строго соблюдается только для идеальных растворов. Для водных растворов всегда наблюдается отклонение от этого закона, однако в разбавленных растворах неэлектролитов они настолько незначительны, что ими можно пренебречь.
Относительное понижение давления насыщенного пара над разбавленным раствором нелетучего неэлектролита не зависит от природы растворенного вещества и равно его молярной доле в растворе:
![]()
p1- парциальное давление насыщенного пара растворителя над раствором;
N2 – мольная доля растворенного вещества;
n1 – количество растворителя;
n2 – количество растворенного вещества.
Закон Рауля имеет ряд важных следствий:
Понижение температуры замерзания раствора по сравнению с температурой замерзания растворителя:
![]()
Повышение температуры кипения раствора по сравнению с температурой кипения растворителя:
![]()
К, Е – криоскопическая и эбулиоскопическая постоянные (таблица 5).
Таблица 5
вещество |
Tзам, С |
К, К·кг/моль |
Tкип, С |
E, К·кг/моль |
Вода |
0,00 |
1,86 |
100,0 |
0,52 |
Бензол |
5,45 |
5,07 |
80,2 |
2,57 |
Нитробензол |
5,85 |
6,9 |
211,03 |
5,27 |
Циклогексан |
6,2 |
20,2 |
81,5 |
2,75 |
Диоксан |
12,34 |
4,72 |
100,8 |
3,2 |
Диэтиловый спирт |
-177,0 |
1,79 |
34,6 |
2,02 |
Этанол |
-114,0 |
|
78,0 |
1,15 |
Уксусная кислота |
16,64 |
3,9 |
117,8 |
3,1 |
Закон Вант-Гоффа устанавливает зависимость осмотического давления раствора от температуры и концентрации неэлетролита:
![]()
Изменение температуры замерзания или температуры кипения растворов электролитов рассчитывают с учетом изотонического коэффициента:
![]()
![]()
![]() .
.
Значение изотонического коэффициента для раствора данного электролита увеличивается по мере его разбавления, имея пределом целое число, равное числу ионов, образующихся при диссоциации электролита.
Пример. В 100 г воды содержится 0,58 г хлорида натрия. При какой температуре закипит этот раствор, если кажущаяся степень диссоциации 96%.
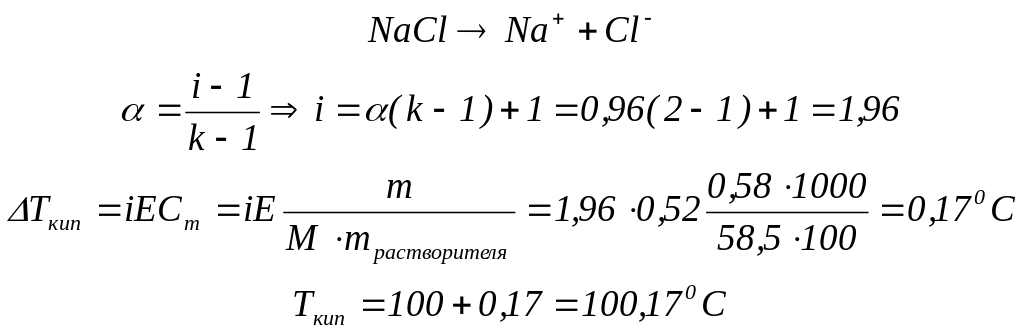
Задания для самостоятельной подготовки
1 Рассчитайте давление насыщенных паров воды над 10% раствором мочевины при 20оС.
2. Навеска вещества массой 24,84 г растворена в 1 л воды при 20 оС. Определите его молекулярную массу, если давление пара над раствором 3732,7 Па, а над чистой водой - 3742 Па.
3. Если вынуть кусочек льда из частично закристаллизовавшегося раствора соли и растопить его, будет ли образовавшийся расплав отличаться по составу от исходного раствора? Если да, то каким образом?
4. Почему кривые зависимости давления пара от температуры для чистого растворителя и раствора расходятся с увеличением температуры?
5. Почему водный раствор, в котором массовая доля NaCl составляет 0,86% называют физиологическим? Почему раны предпочтительнее промывать этим раствором, а не водой?
4. Каково должно быть соотношение числа растворенных частиц в двух растворах, если осмотические давления этих растворов относятся друг к другу как 1:150 (Т=const, V1/V2 = 2)?
5. Давление паров H2O над 0,5 М водным раствором (I) в 1,15 раза выше, чем над раствором (II). На сколько разнятся температуры замерзания этих растворов (К=1.86)?
6. Раствор анилина в воде изотоничен 0,32% раствору метилового спирта (ρ=1 г/см3). При какой температуре будет замерзать этот раствор?
7. Какое количество сахара надо растворить в 1 л воды, чтобы температура кипения увеличилась на 1 оС?
8. Определите на какой глубине в море в подводной лодке можно добывать пресную воду используя явление осмоса. Считать состав морской воды в пересчете на NaCl 5,13%, степень диссоциации NaCl =1, а ρ = 1,04 г/см3.
9. Почему при приготовлении варенья из слив, крыжовника или вишни, чтобы не сморщивались плоды, их рекомендуют накалывать? Почему при варке не очень сладкого компота непроколотые свежие ягоды раздуваются и лопаются?
10. Озеро с пресной водой находится недалеко от океана. Представьте себе, что уровни воды в озере и океане одинаковы, температура одна и та же, погода безветренная (все факторы местности одинаковы). Плотности жидкостей в озере и океане примите равными. Предскажите направление переноса воды в атмосфере и в почве.
