
- •Практикум Общие правила работы в лаборатории
- •Техника безопасности и меры предосторожности
- •1. Основные понятия и законы химии
- •1.1. Семинар: Основные законы и понятия химии
- •1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
- •1.3. Контрольные вопросы
- •2. Термодинамика химической реакции
- •2.1. Семинар: Энергетика химических процессов
- •2.2. Лабораторная работа №2 Термодинамика химических реакций
- •2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
- •2.2.2. Химическая реакция в открытой системе
- •2.2.3. Образование структур при нагревании жидкости
- •2.3. Контрольные вопросы
- •3. Кинетика химической реакции
- •3.1. Семинар: Скорость химических реакций и химическое равновесие
- •3.2. Лабораторная работа №3. Скорость химических реакций
- •3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
- •3.2.2. Зависимость скорости реакции от температуры
- •4.2. Семинар: Электролитическая диссоциация
- •4.3. Лабораторная работа №4. Электролиты
- •4.3.1. Определение среды растворов солей
- •4.3.2. Изучение влияния температуры на равновесие гидролиза
- •4.3.3. Исследование поведения двух солей в растворе
- •4.3.4. Исследование буферных растворов
- •4.3.5. Изучение влияние среды раствора на состав ионов хрома (VI)
- •4.3.6. Приготовление растворов заданной концентрации. Титрование
- •4.4. Контрольные вопросы
- •4.5. Семинар: Растворимость малорастворимых соединений
- •5. Окислительно-восстановительные процессы
- •5.1. Семинар: Окислительно-восстановительные реакции
- •5.2. Окислительно-восстановительные процессы
- •6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
- •6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
- •6.2.2. Изучение реакций комплексных соединений кобальта (II)
- •6.2.3. Качественные реакции ионов железа (II),(III)
- •6.3. Контрольные вопросы
2.2. Лабораторная работа №2 Термодинамика химических реакций
2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
Цель: Освоение калориметрической установки. Изучении метода определения теплового эффекта реакции.
Определяют изменение энтальпии реакции нейтрализации кислоты щелочью.
![]()
Так как в водном растворе эти вещества (кроме воды) ведут себя как сильные электролиты, уравнение реакции в полном и сокращенном молекулярно-ионном виде будет выглядеть так:
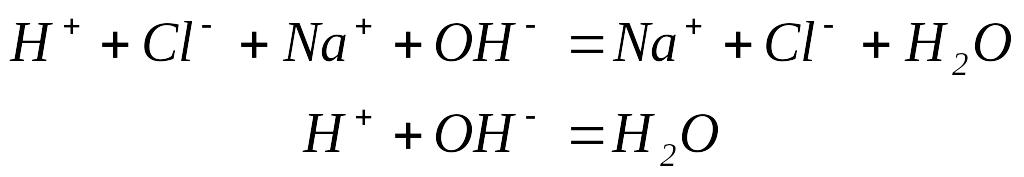
Для измерения количества теплоты, выделяемой или поглощаемой в химической реакции, используют калориметры.
Простейший калориметр состоит из двух стеклянных тонкостенных химических стаканов объемом 150-200 мл, вставленных один в другой с зазором между стенками 5-10 мм. Между большим и малым стаканом располагается термоизолирующая прокладка. Стакан закрыт крышкой с отверстиями, в которые вставлены воронка и термометр.
При использовании простейшего калориметра, необходимо взвесит стеклянный стакан с точностью до 2 –го знака.
Из имеющихся в лаборатории NaOH и HCl приготавливают по 100 мл 0,1 М раствора. В калориметрический сосуд помещают 100 мл раствора щелочи. Измеряют температуру раствора с точностью до 0,10С (растворы должны быть одинаковой температуры ~240С). Затем при вращающейся мешалке вливают быстро раствор кислоты в калориметр.
Отмечают самую высокую температуру, которую покажет термометр после сливания растворов. Находят разницу температур. Записывают данные в таблицу 2.
Таблица 2
Экспериментальные данные
Сст = 0,8 ·103 |
удельная теплоемкость стекла |
Своды = 4,19·103 |
удельная теплоемкость воды |
m1 |
масса внутреннего стеклянного стакана |
m2 |
масса внутреннего стеклянного стакана с водой |
t1 |
начальная температура |
t2 |
конечная температура |
Вычисляют
теплоту нейтрализации:
![]()
2.2.2. Химическая реакция в открытой системе
Цель: Изучение открытых систем.
В колбу емкостью 250 мл налейте 50 мл 2% раствора глюкозы С6Н12О6 и 50 мл 2% раствора гидроксида натрия NaOH, добавьте несколько капель индикатора метиленового синего. Колбу плотно закройте резиновой пробкой. В другой колбе приготовьте точно такой же раствор, но колбу пробкой не закрывайте. После перемешивания растворов взбалтыванием раствор приобретает синюю окраску. Через некоторое время окраска исчезает. После взбалтывания бесцветный раствор снова становится синим. Так может происходить несколько раз (В какой колбе реакция быстро прекратиться и взбалтывание больше не приведет к изменению окраски?)
Реакции можно описать схемами:
О2(воздух)→ О2(раствор);
Метиленовый синий (желтоватая окраска раствора)+ О2(раствор) → [метиленовый синий (синяя окраска раствора) · кислород];
[метиленовый синий (синяя окраска раствора) кислород] + глюкоза → глюконовая кислота + метиленовый синий (желтоватая окраска раствора).
2.2.3. Образование структур при нагревании жидкости
Цель: Показать, что в неравновесных условиях в открытой системе градиент температуры и гравитация приводят к самоорганизации и образованию структур жидкости. Доказать экспериментально, что неравновесные системы чувствительны к изменению условий
В состоянии равновесия какого-либо определенного направления движения молекул – они двигаются беспорядочно – не наблюдается. При нагревании жидкость переходит в неравновесное состояние, происходит упорядочение системы, её самоорганизация. Появление ячеек Бенара свидетельствует об образовании при повышении температуры в условиях неравновесности новой более организованной структуры.
В небольшую плоскую чашку налейте минеральное масло толщиной слоя 0,5 см. В масло насыпьте мелкие алюминиевые опилки или пудру, которые перемешиванием равномерно распределите по всей жидкости. Поставьте чашку в кристаллизатор, так чтобы дно чашки находилось в воде. Кристаллизатор поставьте на электрическую плитку и медленно нагревайте воду (не до кипения). При достижении некоторого градиента температуры в масле начинают возникать потоки и образуются шестиугольные ячейки Бенара.
Вместо алюминиевых опилок можно воспользоваться порошком мела или талька. Тот же эксперимент можно попытаться осуществить с водой. На электроплитку положите белую кафельную пластинку, на нее поставьте широкий стеклянный стакан, в который тонким слоем налита вода. Добавьте в воду алюминиевую пудру или порошок мела. Начните медленно нагревать воду и наблюдайте за верхним слоем воды в стакане.
