
- •Практикум Общие правила работы в лаборатории
- •Техника безопасности и меры предосторожности
- •1. Основные понятия и законы химии
- •1.1. Семинар: Основные законы и понятия химии
- •1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
- •1.3. Контрольные вопросы
- •2. Термодинамика химической реакции
- •2.1. Семинар: Энергетика химических процессов
- •2.2. Лабораторная работа №2 Термодинамика химических реакций
- •2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
- •2.2.2. Химическая реакция в открытой системе
- •2.2.3. Образование структур при нагревании жидкости
- •2.3. Контрольные вопросы
- •3. Кинетика химической реакции
- •3.1. Семинар: Скорость химических реакций и химическое равновесие
- •3.2. Лабораторная работа №3. Скорость химических реакций
- •3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
- •3.2.2. Зависимость скорости реакции от температуры
- •4.2. Семинар: Электролитическая диссоциация
- •4.3. Лабораторная работа №4. Электролиты
- •4.3.1. Определение среды растворов солей
- •4.3.2. Изучение влияния температуры на равновесие гидролиза
- •4.3.3. Исследование поведения двух солей в растворе
- •4.3.4. Исследование буферных растворов
- •4.3.5. Изучение влияние среды раствора на состав ионов хрома (VI)
- •4.3.6. Приготовление растворов заданной концентрации. Титрование
- •4.4. Контрольные вопросы
- •4.5. Семинар: Растворимость малорастворимых соединений
- •5. Окислительно-восстановительные процессы
- •5.1. Семинар: Окислительно-восстановительные реакции
- •5.2. Окислительно-восстановительные процессы
- •6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
- •6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
- •6.2.2. Изучение реакций комплексных соединений кобальта (II)
- •6.2.3. Качественные реакции ионов железа (II),(III)
- •6.3. Контрольные вопросы
1. Основные понятия и законы химии
1.1. Семинар: Основные законы и понятия химии
1. Основные законы стехеометрии.
2. Газовые законы.
3. Определение молекулярной массы.
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод формул химических соединений, составляют раздел химии, называемый стехиометрией. Стехиометрия включает в себя законы Авогадро, постоянства состава, кратных отношений, Гей-Люссака, эквивалентов и сохранения массы.
В основу составления химических уравнений положен метод материального баланса, основанный на законе сохранения массы (М. В. Ломоносов, 1748, А. Лавуазье, 1789).
В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты.
Химический эквивалент – реальная или условная частица вещества, способная соединиться и заместить 1 моль атомов водорода в реакциях присоединения и замещения или принять (отдать) 1 моль электронов в окислительно-восстановительных реакциях.
Молярная масса эквивалент определяется по формулам:
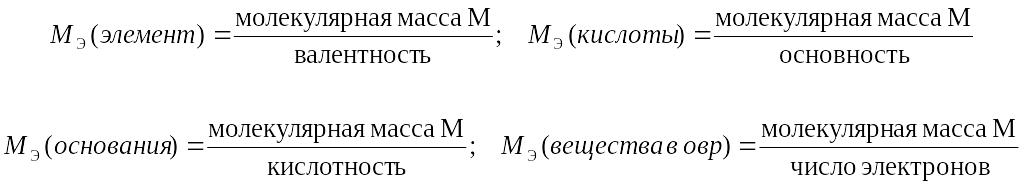
Закон
эквивалентов:
![]() .
.
Зависимость свойств идеальных газов от давления определяется законом Бойля-Мариотта:
p1V1 = p2V2 при t=const
Зависимость свойств идеальных газов от температуры определяется законом Гей-Люссака:
![]() при
p=const
при
p=const
Пример. Если 100 л газа, находящегося при температуре 300К, нагревают до 400К, не меняя давления, то при более высокой температуре новый объем газа будет равен
![]()
Запись объединенного газового закона pV/T= = const может быть преобразована в уравнение Менделеева-Клапейрона:
![]()
где
R
- универсальная
газовая постоянная, равная 0,082 атм·л/моль·K
или 8,31 кПа·л/моль·К (Па·м3/моль·К),
a
![]() -
число молей газа.
-
число молей газа.
Пример. Определить число молей газа при давлении 3 атм и температуре 400К, занимающих объем 70 л:
![]() (моль)
(моль)
Одно из следствий объединенного газового закона: в равных объемах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул. Это закон Авогадро.
Следствия из закона Авогадро:
1)
![]() , m1
и m2
- массы двух газов, а M1/M2
- относительная плотность.
, m1
и m2
- массы двух газов, а M1/M2
- относительная плотность.
2) 1 моль любого газа занимает при н.у. (101,3 кПа и 273К) объем 22,4 л.
Закон Авогадро применим только к идеальным газам. При нормальных условиях трудно сжимаемые газы (водород, гелий, азот, неон, аргон) можно считать идеальными. У оксида углерода (IV), аммиака, оксида серы (IV) отклонения от идеальности наблюдаются уже при нормальных условиях и возрастают с ростом давления и понижением температуры.
Задания для самостоятельной подготовки
1. Какой объем (при н. у.) занимает 0,5 моль кислорода?
2. Какой объем занимает водород, содержащий 18∙1023 молекул (при н. у.)?
3. При обжиге пирита выделяется газ, содержащий 40% серы и 60% кислорода и имеющий плотность по воздуху при н.у. 2,76. Установите формулу этого газа?
4. Какой объем занимают 68 г аммиака при давлении 2 атм и температуре 100oС?
5. В замкнутом сосуде емкостью 1,5 л находится смесь сероводорода с избытком кислорода при температуре 27oС и давлении 623,2 мм рт. ст. Найдите суммарное количество веществ в сосуде.
6. Состав минерала гематита выражается соотношением m(Fe):m(O)=7:3. Сколько граммов железа можно получить из 50 г этого минерала?
7. Вычислить объемные доли (в процентах) оксидов углерода (II и IV), парциальные давления которых соответственно 0,24 и 0,17 кПа.
8. Сколько литров водорода, приведенного к нормальным условиям, потребуется для восстановления 112 г оксида металла, содержащего 71,43% металла? Какова эквивалентная масса металла?
9. Минерал халькозин (медный блеск) содержит 20% серы. Определить эквивалентную массу металла и формулу халькозина.
10. Навеску 9,13 г магнезита обработали избытком азотной кислоты. Выделившийся газ поглотили раствором гидроксида натрия. Масса раствора щелочи после поглощения ею газа увеличилась на 4,4 г. Определить процентное содержание карбоната магния в магнезите.
