
- •Практикум Общие правила работы в лаборатории
- •Техника безопасности и меры предосторожности
- •1. Основные понятия и законы химии
- •1.1. Семинар: Основные законы и понятия химии
- •1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
- •1.3. Контрольные вопросы
- •2. Термодинамика химической реакции
- •2.1. Семинар: Энергетика химических процессов
- •2.2. Лабораторная работа №2 Термодинамика химических реакций
- •2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
- •2.2.2. Химическая реакция в открытой системе
- •2.2.3. Образование структур при нагревании жидкости
- •2.3. Контрольные вопросы
- •3. Кинетика химической реакции
- •3.1. Семинар: Скорость химических реакций и химическое равновесие
- •3.2. Лабораторная работа №3. Скорость химических реакций
- •3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
- •3.2.2. Зависимость скорости реакции от температуры
- •4.2. Семинар: Электролитическая диссоциация
- •4.3. Лабораторная работа №4. Электролиты
- •4.3.1. Определение среды растворов солей
- •4.3.2. Изучение влияния температуры на равновесие гидролиза
- •4.3.3. Исследование поведения двух солей в растворе
- •4.3.4. Исследование буферных растворов
- •4.3.5. Изучение влияние среды раствора на состав ионов хрома (VI)
- •4.3.6. Приготовление растворов заданной концентрации. Титрование
- •4.4. Контрольные вопросы
- •4.5. Семинар: Растворимость малорастворимых соединений
- •5. Окислительно-восстановительные процессы
- •5.1. Семинар: Окислительно-восстановительные реакции
- •5.2. Окислительно-восстановительные процессы
- •6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
- •6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
- •6.2.2. Изучение реакций комплексных соединений кобальта (II)
- •6.2.3. Качественные реакции ионов железа (II),(III)
- •6.3. Контрольные вопросы
2.3. Контрольные вопросы
1. Почему различаются тепловые эффекты реакции нейтрализации с разными кислотами и основаниями?
2. Докажите, что по схеме, предложной в работе 3.2.2 могут идти реакции в открытой системе. Как создать стационарные условия в этой реакционной системе?
3. Определить от каких факторов зависит размер ячейки Бенара.
4. Объясните за счет каких сил (каких химических связей) образовываются упорядоченные структуры. В какой жидкости – воде или минеральном масле – эти связи сильнее?
5. Почему лучше использовать минеральное масло, а не воду?
3. Кинетика химической реакции
3.1. Семинар: Скорость химических реакций и химическое равновесие
1. Скорость химической реакции (средняя, истинная). Закон действующих масс.
2. Зависимость скорости реакции от концентрации реагирующих веществ.
3. Зависимость скорости реакции от температуры. Уравнение Аррениуса. Энергия активации. Константа скорости. Размерность константы скорости. Молекулярность и порядок реакции. Способы определения порядка реакции.
4. Условие равновесия. Константа равновесия. Ее физический смысл принцип Ле-Шателье.
Скорость химической реакции определяется изменением концентрации реагирующих веществ (или продуктов) в единицу времени. Скорость химической реакции в общем случае не является постоянной в течении всего времени ее протекании. Скорость прямой реакции уменьшается по мере расходования исходных веществ, а скорость обратной реакции увеличивается по мере накопления продуктов.
Средняя
скорость:
![]()
Истинная
скорость (первая производная по времени):
![]()
Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например, для реакции:
![]()
a+b – порядок реакции (более 3 порядка не существует).
Для реакций первого порядка можно вычислить период полураспада:
![]()
Скорость реакции зависит от температуры. В соответствии с эмпирическим правилом Вант-Гоффа скорость реакции большинства реакций увеличивается в 2-4 раза при увеличении температуры на 100С:

Более точную зависимость скорости химической реакции от температуры устанавливает уравнение Аррениуса:
![]()
Уравнение Аррениуса для двух температур имеет следующий вид:
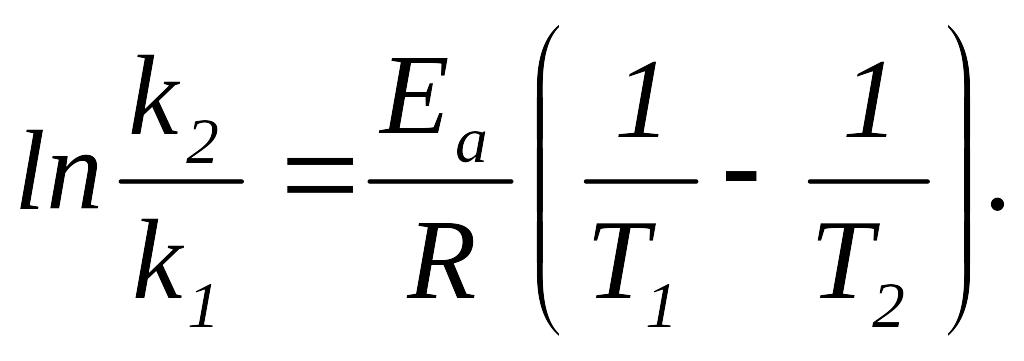
Пример. При повышении температуры от 20 до 400С скорость реакции увеличилась в 6 раз. Вычислить температурный коэффициент и энергию активации реакции.
![]()
![]()
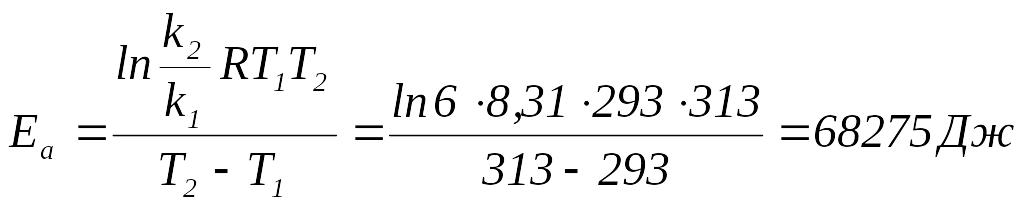 .
.
Задания для самостоятельной подготовки
1. Для реакции: H2 + J2 = 2HJ K=50 при 444°С. Определите направление процесса, если исходная смесь имеет следующий состав: [Н2]=2 моль/л, [J2]=5моль/л, [HJ] =10 моль/л.
2. В результате взаимодействия 1 моля H2 и 1 моля J2 равновесная смесь содержит 1,56 моль HJ. Вычислите K при 450°С.
3. Вычислите энергию активации при реакции, скорость которой при повышении температуры от 27°С до 37°С возрастает точно в два раза.
4. Вычислите температурный коэффициент, если при повышении температуры системы на 80°С скорость реакции возросла в 3000 раз.
5. Увеличение концентрации вещества в 2 раза приводит к возрастанию скорости реакции в 4 раза. Каков порядок реакции по этому веществу?
6. Радиоактивность природных вод в основном связана с присутствием в ней естественных радиоактивных изотопов калия, радона, радия, урана и некоторых искусственных, образовавшихся при ядерных взрывах и авариях изотопов. Их периоды полураспада составляют:
40K |
1,3·109лет |
226Ra |
1600 лет |
222Rn |
3,8 сут |
90Sr |
28,7 лет |
238U |
4,5·109лет |
137Cs |
30,2 года |
Как изменится содержание каждого вещества (нуклида) в образце воды:
1) через год;
2) 10 лет;
3) 500 лет;
4) 1 млн лет.
7. Период полураспада изотопа углерода-14 составляет 5730 лет. В лабораторию принесли образец древесины, содержание углерода-14 в котором составляет 6,25% от современного уровня. Каков возраст образца древесины? 2) Зависимость константы скорости химической реакции от температуры выражается уравнением Аррениуса:
![]() ,
,
где А - константа (предэкспоненциальный множитель),
Eакт - энергия активации данной реакции,
R - газовая постоянная,
T - абсолютная температура.
В каком из двух случаев скорость реакции увеличится в большее число раз: при нагревании от -11oС до 0oС или при нагревании от 0oС до +11oС? Ответ обоснуйте расчетной формулой.
8. Константа равновесия системы СО + Н2О⇄CO2 + H2 при некоторой температуре равна 1. Вычислите объемный процентный состав смеси в состоянии равновесия, если начальные концентрации СО и Н2О равны 1 моль/л.
9. Исходные концентрации окиси азота и хлора в системе: 2 NO + Cl2 ⇄2 NOCl составляют соответственно 0,5 моль/л и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% окиси азота.
10. Вычислите константу равновесия реакции 3 H2 + N2 ⇄2 NH3 при комнатной температуре и при 500оС.
