
- •Практикум Общие правила работы в лаборатории
- •Техника безопасности и меры предосторожности
- •1. Основные понятия и законы химии
- •1.1. Семинар: Основные законы и понятия химии
- •1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
- •1.3. Контрольные вопросы
- •2. Термодинамика химической реакции
- •2.1. Семинар: Энергетика химических процессов
- •2.2. Лабораторная работа №2 Термодинамика химических реакций
- •2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
- •2.2.2. Химическая реакция в открытой системе
- •2.2.3. Образование структур при нагревании жидкости
- •2.3. Контрольные вопросы
- •3. Кинетика химической реакции
- •3.1. Семинар: Скорость химических реакций и химическое равновесие
- •3.2. Лабораторная работа №3. Скорость химических реакций
- •3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
- •3.2.2. Зависимость скорости реакции от температуры
- •4.2. Семинар: Электролитическая диссоциация
- •4.3. Лабораторная работа №4. Электролиты
- •4.3.1. Определение среды растворов солей
- •4.3.2. Изучение влияния температуры на равновесие гидролиза
- •4.3.3. Исследование поведения двух солей в растворе
- •4.3.4. Исследование буферных растворов
- •4.3.5. Изучение влияние среды раствора на состав ионов хрома (VI)
- •4.3.6. Приготовление растворов заданной концентрации. Титрование
- •4.4. Контрольные вопросы
- •4.5. Семинар: Растворимость малорастворимых соединений
- •5. Окислительно-восстановительные процессы
- •5.1. Семинар: Окислительно-восстановительные реакции
- •5.2. Окислительно-восстановительные процессы
- •6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
- •6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
- •6.2.2. Изучение реакций комплексных соединений кобальта (II)
- •6.2.3. Качественные реакции ионов железа (II),(III)
- •6.3. Контрольные вопросы
1.3. Контрольные вопросы
Что такое эквивалент и молярная масса эквивалента?
Как рассчитывается молярная масса эквивалента вещества для химических элементов и соединений различных классов (соли, оксиды, кислоты, основания), а также для соединений, проявляющих свойства окислителей или восстановителей?
Рассчитать молярную массу эквивалента перманганата калия KMnO4, рассматривая данное соединение как: а) соль; б) окислитель, превращающийся в MnO(OH)2; в) окислитель, превращающийся в MnSO4
Какой объем оксида углерода СО, взятый при нормальных условиях требуется для получения железа из 1 кг его оксида Fe2O3?
Рассчитать молярную массу эквивалента азотной кислоты HNO3, рассматривая данное соединение как: а) кислоту б) окислитель, превращающийся в NO в) окислитель, превращающийся в NH3
Какое количество серной кислоты H2SO4 необходимо для реакции с 300г оксида алюминия Al2O3 при условии образования средней соли Al2(SO4)3 ?
2. Термодинамика химической реакции
2.1. Семинар: Энергетика химических процессов
1. Общие понятия термодинамики: система, состояние системы, параметры состояния, равновесные и обратимые процессы.
2. I закон термодинамики. Понятия: работа, теплота, внутренняя энергия, энтальпия. Тепловой эффект химической реакции. Закон Гесса. Теплотаобразования химических веществ. Стандартные условия. Энергия связи.
4. II закон термодинамики. Понятие энтропии. Условие самопроизвольного протекания процесса в изолированной системе. Энтропия идеального кристалла. Изменение энтропии при изменении температуры.
5. Понятие энергии Гиббса и Гельмгольца. Направление самопроизвольного протекания процесса. Зависимость ΔG от температуры. Влияние энтальпийного и энтропийного фактора на изменение направления процесса.
К величинам, характеризующим химические системы, относятся внутренняя энергия, энтальпия, энтропия, энергия Гиббса. Все эти величины представляют собой функции состояния, т.е. зависят только от состояния системы, но не от способа, которым это состояние достигнуто.
Энтальпия – функция состояния, изменение которой равно теплоте изобарного процесса (р=const).
![]()
ΔpH<0 – экзотермическая реакция.
ΔpH>0 – эндотермическая реакция.
Закон Гесса – частный случай фундаментального закона естествознания – первого начала термодинамики: энергия не создается и не уничтожается, а лишь превращается из одного вида в другой в строго эквивалентных количествах.
Стандартная энтальпия реакции рассчитывается по уравнениям (следствие закона Гесса):
![]()
Пример. Вычислить стандартную энтальпию реакции, протекающей в газовой фазе?
![]()
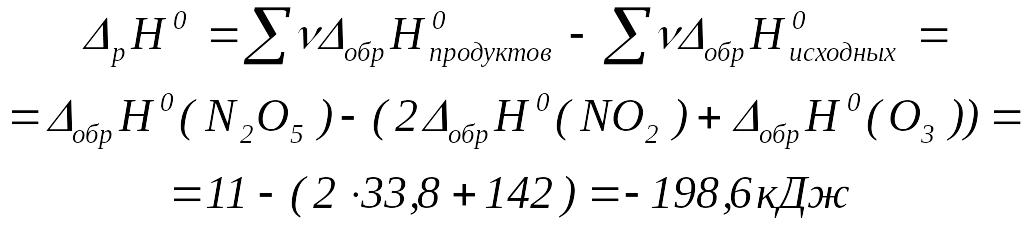
Химические реакции, протекающие без поступления энергии извне, называются самопроизвольными. Для решения вопроса о возможности самопроизвольного протекания реакции в изолированных системах используют изменение энтропии (ΔS), а в закрытых системах – изменение энергии Гиббса (ΔG).
Энтропия характеризует степень упорядоченности частиц в системе. В соответствии с постулатом М. Планка энтропия правильно образованного кристалла чистого вещества при абсолютном нуле равна нулю. Стандартная энтропия реакции ΔрS0 рассчитывается по уравнению, также являющимся следствием закона Гесса:
![]()
Энергия Гиббса – функция состояния, изменение которой в обратимом изобарно-изотермическом процессе равно максимально полезной работе (за вычетом работы расширения - сжатия).
![]()
Расчет стандартной энергии Гиббса реакции производится также по уравнению вытекающему из закона Гесса:
![]()
Критерием направления самопроизвольного протекания необратимого процесса являются неравенства:
ΔS>0 (для изолированных систем)
ΔG<0 (для закрытых систем)
Задания для подготовки к семинару
1. На основании приведенных данных найдите ΔfH°298ZnSO4 :
ZnS (тв) = Zn (тв) + S (ромб) ΔrH°298 = 184 кДж
2 ZnS (тв) + 3О2 (г) = 2ZnO (тв) + 2SO2 ΔrH°298 = -928кДж
2SO2 (г) + O2 (г) = 2SO3 (г) ΔrH°298 = -196 кДж
ZnSO4 (тв) = ZnO (тв) + SO3 (г) ΔrH°298 = 230 кДж
2. Вычислите изменение энтропии реакции в стандартных условиях:
2H2S(г) + 3O2 (г) = 2SO2 (г) + 2H2O (ж), используя табличные данные.
3. Вычислите изменение энтропии при плавлении 15 г серебра. Tпл = 960°С, ΔHпл = 104,5 кДж/моль.
4. В сосуде, разделенном перегородкой на 2 объема одинаковой емкости (по 30 л) находятся: в одном 42г азота, а в другом -16г кислорода при одинаковой температуре. Найдите изменения энтропии при удалении перегородки.
5. Вы знаете о роли водки в экономике страны. Можно ли получить этиловый спирт из простых веществ – водорода, кислорода и углерода (угля)? Термодинамические характеристики веществ взять из справочника. Если окажется, что процесс возможен, объясните, почему его не используют в промышленности. Почему спирт – очень дешевый продукт, а водка, изготовляемая из него, по сути дела разбавленная водой, очень дорога?
6. Проведите термодинамический анализ реакции образования озона из кислорода 3О2(г.)=2О3(г.) (реакция осуществляется через ряд последовательных стадий). Каковы знаки энтальпии, энтропии и изобарного потенциала реакции образования озона? Возможна ли эта реакция при стандартных условиях? Устойчив ли озон при обычных условиях? Как изменяется устойчивость озона при повышении температуры? При какой температуре – более высокой или более низкой – следует получать озон из кислорода? Почему эта реакция имеет исключительно важное значение для природы и человека? Какова роль озона верхних и нижних слоях атмосферы? Что вы знаете об озоновых дырах в верхних слоях атмосферы? К каким глобальным последствиям может привести снижение содержания озона в верхних слоях атмосферы? Вреден или полезен озон, содержащийся во вдыхаемом воздухе? Каковы источники озона в нижнем слое атмосферы? Где используется озон?
7. Возможна ли при стандартных условиях реакция
2SO2(г.)+О2(г.)=2SO3(г.)
Кислотные дожди связаны с присутствием в атмосфере серной и азотной кислот. Серная кислот образуется при взаимодействии триоксида серы SO3 с водой, который получается при окислении диоксида серы (сернистого газа) кислородом воздуха. Диоксид серы выбрасывается в воздух двигателями автомобилей (при использовании некачественного бензина), а также при сжигании на тепловых станциях угля и нефти, содержащих соединения серы.
8. Проведите анализ преимуществ (экономичность, удобство) использования в качестве топлива следующих газов: метана, этана, этилена, ацетилена, пропана, бутана. Вам следует найти в справочной литературе энтальпию образования, энтропию, температуру плавления, температуру кипения, плотность жидкости и другие характеристики, необходимые для выполнения задачи.
9. Температура тела человека равна ~36,70С. Сможет ли человек постоянно жить при одной из следующих температур: 35, 36,7 или 370С? Как вы считаете, чем может закончится такой эксперимент, когда животное (или человек) на долгое время помещают в среду с температурой, равной температуре его тела (пищу и воду им поставляют в необходимом количестве)?
10. Рассмотрите систему город – окружающая среда с точки зрения создания порядка и беспорядка. Почему города возникают и существуют? Почему некоторые города и цивилизации перестают существовать?
