
- •Практикум Общие правила работы в лаборатории
- •Техника безопасности и меры предосторожности
- •1. Основные понятия и законы химии
- •1.1. Семинар: Основные законы и понятия химии
- •1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
- •1.3. Контрольные вопросы
- •2. Термодинамика химической реакции
- •2.1. Семинар: Энергетика химических процессов
- •2.2. Лабораторная работа №2 Термодинамика химических реакций
- •2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
- •2.2.2. Химическая реакция в открытой системе
- •2.2.3. Образование структур при нагревании жидкости
- •2.3. Контрольные вопросы
- •3. Кинетика химической реакции
- •3.1. Семинар: Скорость химических реакций и химическое равновесие
- •3.2. Лабораторная работа №3. Скорость химических реакций
- •3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
- •3.2.2. Зависимость скорости реакции от температуры
- •4.2. Семинар: Электролитическая диссоциация
- •4.3. Лабораторная работа №4. Электролиты
- •4.3.1. Определение среды растворов солей
- •4.3.2. Изучение влияния температуры на равновесие гидролиза
- •4.3.3. Исследование поведения двух солей в растворе
- •4.3.4. Исследование буферных растворов
- •4.3.5. Изучение влияние среды раствора на состав ионов хрома (VI)
- •4.3.6. Приготовление растворов заданной концентрации. Титрование
- •4.4. Контрольные вопросы
- •4.5. Семинар: Растворимость малорастворимых соединений
- •5. Окислительно-восстановительные процессы
- •5.1. Семинар: Окислительно-восстановительные реакции
- •5.2. Окислительно-восстановительные процессы
- •6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
- •6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
- •6.2.2. Изучение реакций комплексных соединений кобальта (II)
- •6.2.3. Качественные реакции ионов железа (II),(III)
- •6.3. Контрольные вопросы
6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
Цель: Изучение реакций образования комплексных соединений. Применение некоторых реакций для идентификации ионов.
6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
В первой пробирке к нескольким каплям раствора сульфата меди (II) прибавьте 1-2 капли раствора аммиака. Отметьте цвет полученного осадка. Напишите реакции в сокращенном молекулярно-ионном виде.
Затем прибавьте еще несколько капель до растворения осадка. Отметьте цвет полученного раствора. Объясните, что произошло с осадком. Напишите реакцию.
Во вторую пробирку к раствору сульфата меди (II) добавьте раствор гидроксида натрия. Прилейте к раствору аммиаката (к первой пробирке) 3-5 капель сероводородной воды или раствора сульфида натрия. Объясните выпадение осадка, учитывая, что ПР(СuS)=8,5·10-45, а полная константа нестойкости [Cu(NH3)4]2+ равна 9,3·10-13.
6.2.2. Изучение реакций комплексных соединений кобальта (II)
1. В первую пробирку внесите несколько кристалликов соли CoCl2·6H2O и осторожно нагрейте до появления голубой окраски. Напишите координационную формулу кристаллогидрата хлорида кобальта, учитывая, что координационное число Co2+ равно 6. Объясните, что произошло при нагревании.
Разбавленный водный раствор хлорида кобальта (II) имеет розовую окраску. При нагревании раствора до кипения он приобретает синюю окраску:
![]()
Раствор CoCl2 или [Co(H2O)6]Cl2 имеет бледно-розовую окраску и при сильном разбавлении почти бесцветен. Текст написанный таким раствором не виден. Если бумагу с таким текстом нагреть, вода из комплекса удалиться и на бумаге останется комплексное соединение, имеющее голубую окраску:
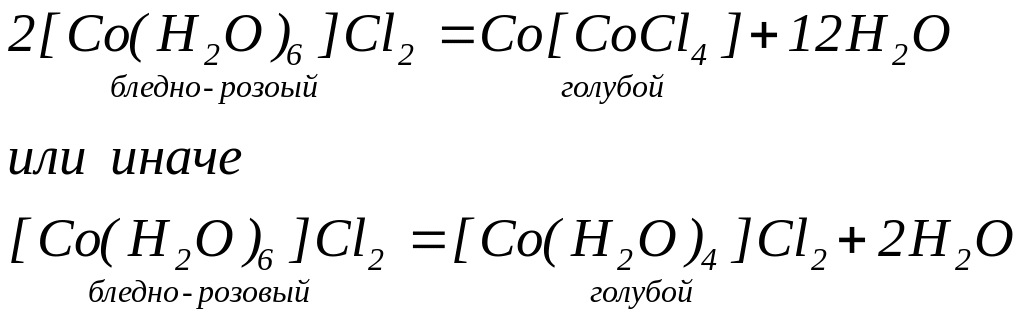
Голубая окраска постепенно исчезает.
2. Разбавленный водный раствор хлорида кобальта (II) имеет розовую окраску, но при нагревании его до кипения, вследствие замены лигандов приобретает синюю окраску.
![]()
Налейте в пробирку 5-10 мл 0,5 М раствора хлорида кобальта (II). Отметьте его окраску. Нагрейте раствор в бане с кипящей водой. Охладите. Что произошло с окраской.
6.2.3. Качественные реакции ионов железа (II),(III)
1. К 2-3 мл раствора соли железа (II) добавьте 1-2 капли соляной кислоты (среда проведения реакции – кислотная, рН=2) и несколько капель раствора гексацианоферрата (III) калия (красной кровяной соли) K3[Fe(CN)6] раствор приобретает темно-синюю окраску или выпадает осадок турнбулевой сини. Турнбулева синь мало растворима в соляной кислоте.
Аналогичное действие проделать с раствором соли железа (III), добавив в качестве реагента – раствор гексацианоферрита (II) калия, K4[Fe(CN)6]. Получится темно-синий раствор или осадок берлинской лазури.
![]()
Берлинская лазурь и турнбулева синь имеют один и тот же состав:
![]()
2. К 2-3 мл раствора железа (III) прибавьте 2-3 капли раствора соляной кислоте (рН=2) и 2-3 капли раствора роданида аммония.
![]()
6.3. Контрольные вопросы
Как объяснить постепенное изменение окраски раствора аммиаката меди от голубой до темно-синей.
Объясните, почему действие гидроксида натрия на ион меди иное, чем раствора аммиака.
Почему кобальтовые чернила выцветают на воздухе?
Каков знак теплового эффекта (энтальпии) реакции замены лигандов с одновременным изменением координационного числа кобальта?
Напишите реакцию качественного определения ионов железа (II) гексацианоферратом (III) калия, помня о том, что осадки турнбулевой сини и берлинской лазури имеют одинаковый состав.
