
- •Практикум Общие правила работы в лаборатории
- •Техника безопасности и меры предосторожности
- •1. Основные понятия и законы химии
- •1.1. Семинар: Основные законы и понятия химии
- •1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
- •1.3. Контрольные вопросы
- •2. Термодинамика химической реакции
- •2.1. Семинар: Энергетика химических процессов
- •2.2. Лабораторная работа №2 Термодинамика химических реакций
- •2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
- •2.2.2. Химическая реакция в открытой системе
- •2.2.3. Образование структур при нагревании жидкости
- •2.3. Контрольные вопросы
- •3. Кинетика химической реакции
- •3.1. Семинар: Скорость химических реакций и химическое равновесие
- •3.2. Лабораторная работа №3. Скорость химических реакций
- •3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
- •3.2.2. Зависимость скорости реакции от температуры
- •4.2. Семинар: Электролитическая диссоциация
- •4.3. Лабораторная работа №4. Электролиты
- •4.3.1. Определение среды растворов солей
- •4.3.2. Изучение влияния температуры на равновесие гидролиза
- •4.3.3. Исследование поведения двух солей в растворе
- •4.3.4. Исследование буферных растворов
- •4.3.5. Изучение влияние среды раствора на состав ионов хрома (VI)
- •4.3.6. Приготовление растворов заданной концентрации. Титрование
- •4.4. Контрольные вопросы
- •4.5. Семинар: Растворимость малорастворимых соединений
- •5. Окислительно-восстановительные процессы
- •5.1. Семинар: Окислительно-восстановительные реакции
- •5.2. Окислительно-восстановительные процессы
- •6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
- •6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
- •6.2.2. Изучение реакций комплексных соединений кобальта (II)
- •6.2.3. Качественные реакции ионов железа (II),(III)
- •6.3. Контрольные вопросы
4.3.6. Приготовление растворов заданной концентрации. Титрование
Из имеющегося в лаборатории концентрированного ≈20% раствора гидроксида натрия приготовьте 0,1 М. С помощью денситометров измерьте плотность раствора и установите молярную концентрацию его по таблицам справочника. Рассчитайте, какой объем концентрированного раствора необходимо взять, чтобы приготовить 100 мл 0,1 М раствора по формуле:
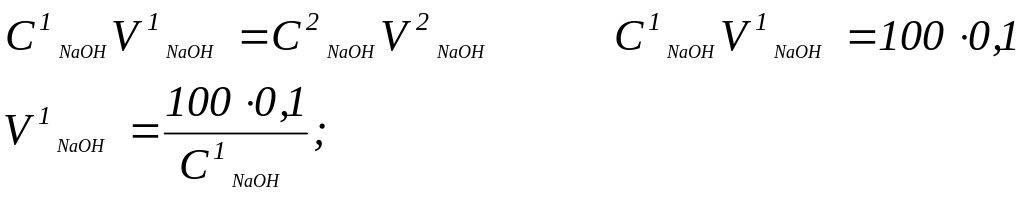
В мерную колбу на 100,0 мл внесите мерной пипеткой необходимое количество щелочи, доведите при перемешивании объем до риски дистиллированной водой. Концентрацию приготовленного раствора определите титрованием с соляной или серной кислотой.
Бюретку промойте несколько раз щелочью (титрантом). Залейте бюретку щелочью, проверьте как заполнился носик бюретки, удалите воздух, заполните бюретку кислотой до нулевой отметки. Отмерьте аликвоту кислоты (пипетка объемом 10,00 мл) перенесите в колбу для титрования, добавьте индикатор фенолфталеин и титруйте раствором гидроксида натрия до появления слабо розового окрашивания. Запишите результаты титрования с точностью до 0,05 мл. Повторяйте определение до получения не менее 3-х сходящихся результатов (отличающихся не более чем на 0,1 мл). Затем повторите все то же с индикатором метиловым оранжевым. Окраска индикатора в точке эквивалентности изменится с красной на желтую.
Сравните полученные результаты. Вычислите погрешность определения.
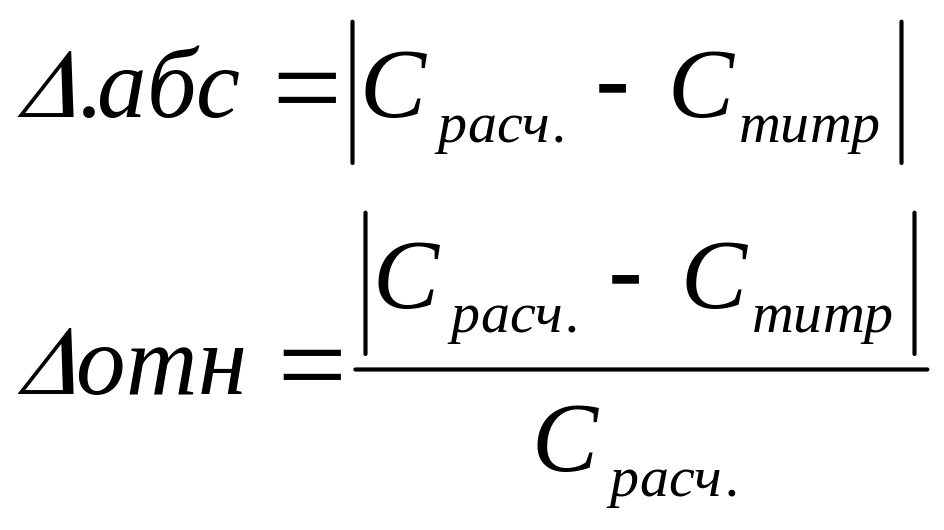
4.4. Контрольные вопросы
1. Какие соли подвергаются гидролизу?
2. Напишите реакции гидролиза фосфата натрия, гидрофосфата натрия, дигидрофосфата натрия и определите среду растворов.
3. Какие факторы влияют на смещение равновесия реакции гидролиза?
4. Исходя из полученных результатов опыта 4.3.4. предложите понятие «буферный раствор».
5. Почему в опыте 4.3.5. не рекомендуется приливать соляную кислоту (применяют серную).
4.5. Семинар: Растворимость малорастворимых соединений
Малорастворимые соли. Произведение растворимости
Факторы, влияющие на растворимость малорастворимых электролитов.
Осаждение гидроксидов
Для уравнения диссоциации AnBm⇄nA+mB
Константа равновесия
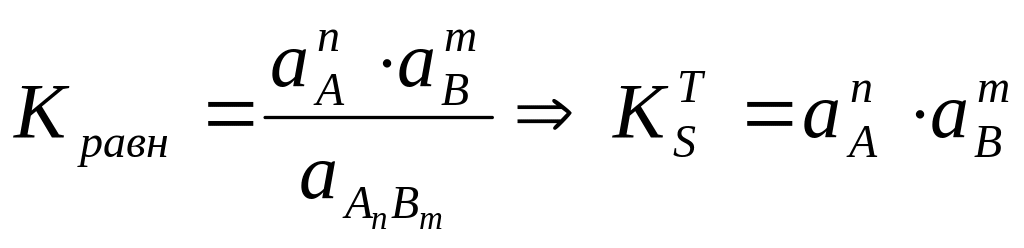
KST (ПР) - (константа растворимости термодинамическая, произведение растворимости (активностей) ПР) – характеризует систему: насыщенный раствор – осадок, находящийся в равновесии.
Если ионная сила раствора µ ≠0, коэффициент активности f≠1, то константа растворимости
![]()
Если
ионная сила раствора µ≠0,
коэффициент активности f≠1,
коэффициент конкурирующей реакции α≠1,
то константа растворимости
![]() .
.
При этом влияние конкурирующей реакции более значимо, поэтому коэффициентами активностей можно пренебречь.
В насыщенном растворе растворимость (S) осадка определяется в зависимости от условий: величины ионной силы, присутствия одноименных с осадком ионов, конкурирующими реакциями.
В
насыщенном растворе при µ=0,
α=1:
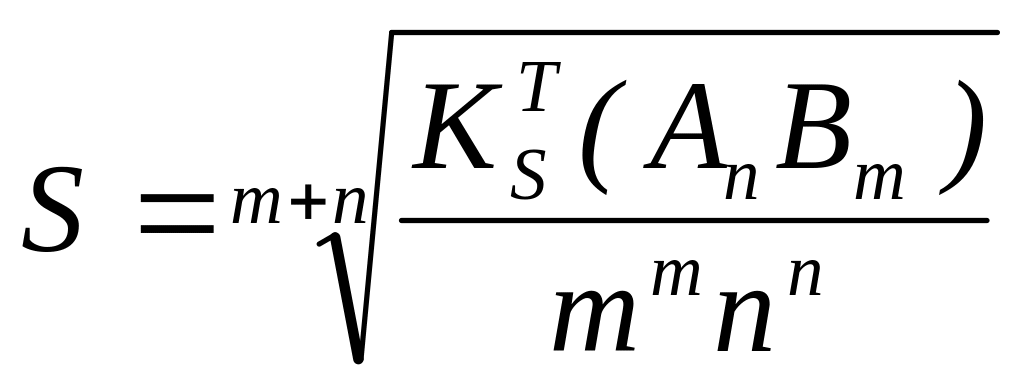 .
.
- В присутствии сильного электролита, µ≠0, α=1 растворимость увеличивается (“солевой эффект”):
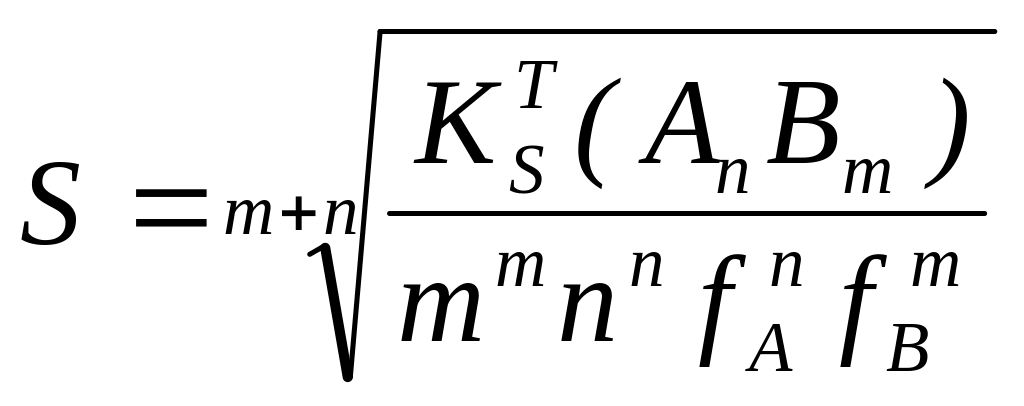
- В присутствии сильного электролита с одноименными осадку ионами, I≠0, α=1 растворимость уменьшается (“высаливание”), например, одноименным анионом B:
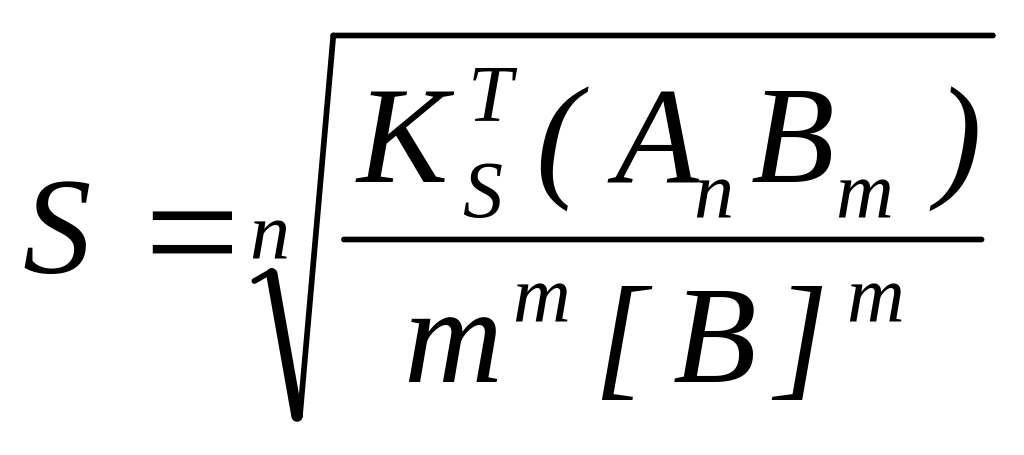 ,
,
при этом одноименный ион влияет значительный, чем ионная сила.
- Конкурирующая реакция α≠1 смещает равновесие в сторону увеличения растворимости:
![]()
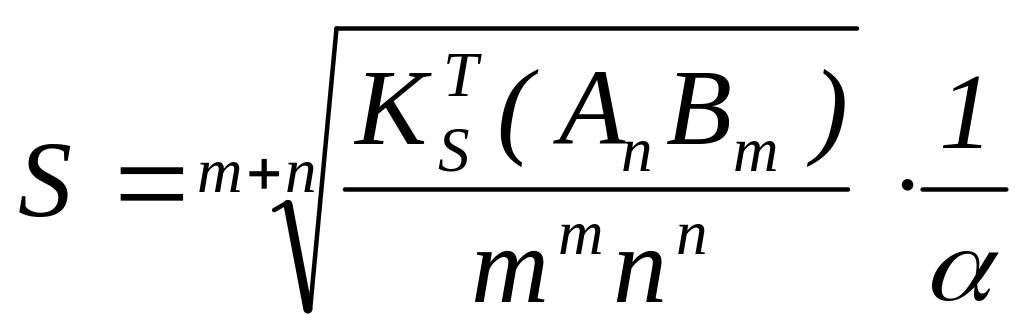 .
.
Определить образуется в данных условиях осадок, можно сравнив произведение равновесных концентраций ионов осадка с термодинамической константой растворимости:
![]() .
.
Для малорастворимых гидроксидов можно вычислить рН осаждения исходя из константы растворимости, например:
Ca(OH)2⇄Ca2++2OH- (обратите внимание, гидроксид кальция - сильный, но малорастворимый электролит), в насыщенном растворе, при ионной силе равной нулю:
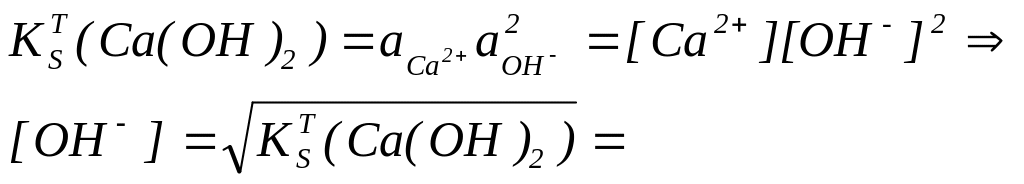
Задания для самостоятельной подготовки
1. Вычислите рН насыщенного раствора гидроксида магния при ПР = 5⋅10-12.
2. Произведение растворимости гидроксида магния при 25 оС равно 5⋅10-12.Какова растворимость этого соединения?
3. Растворимость гидроксида некоторого двухвалентного металла равна 3.75⋅10-5 моль/л. Каково его произведение растворимости?
4. Растворимость сульфата калия в воде равна 1,06 г/л. Какова будет растворимость этого соединения в 0.1М растворе сульфата калия?
