
- •62. Тепловые машины. Кпд тепловой машины. 63 Цикл Карно.
- •67. Средняя длина свободного пробега молекулы газа. Среднее число соударений. Эффективный диаметр молекул.
- •68. 69. 70. Явление переноса.
- •61. Энтропия. Расчет изменения энтропии при различных изопроцессах.
- •64. Третье начало термодинамики. Теорема Нернста.
- •65. Распределение молекул по скоростям.
- •51. Внутренняя энергия идеального газа
- •56. Первое начала термодинамики
- •57 Теплоемкость идеального газа
- •60. Второе начало термодинамики.
- •37. Скорость и ускорение гармонических колебаний.
- •38. Сила и энергия гармонических колебаний.
- •40. Сложение гармонических колебаний одного направления.
- •41. Сложение взаимно – перпендикулярных колебаний.
- •43. Добротность, декремент затухания
- •44. Основы молекулярно-кинетической теории.
- •45. Термодинамические макропараметры. Идеальный газ.
- •46. Уравнение состояния идеального газа.
- •47. Опытные газовые законы.
- •48. Температура. Кинетическая энергия поступательного движения молекул идеального газа.
- •59.Политропический процесс.
- •12. Основное уравнения вращательного движения твердого тела.
- •13. Момент импульса. Момент силы
- •15.Момент инерции материальной точки.
- •16.Момент инерции тела. Теорема Штейнера.
- •19.Момент инерции тонкого диска.
- •21.Поле. Силовое поле. Работа и кинетическая энергия
- •11.Реактивное движение. Формула Циолковского.
- •23 Кинетическая энергия
- •Кинетическая энергия
- •24.Потенциальная энергия
- •66.Барометрическая формула
- •22. Работа и энергия.
- •20. Момент инерции шара.
- •18. Моменты инерции тонкого диска относительно его главных центральных осей.
- •17. Определение момента инерции тонкого стержня, относительно оси, проходящей через его середину.
- •1.Основные кинематические понятия. Материальная точка. Система отсчета, система координат.
- •2.Кинематическое уравнение движения. Уравнение траектории. Перемещение, скорость, ускорение мат. Точки.
- •3.Криволинейное движение, нормальное и тангенсальное ускорение.
- •4. Кинематика вращательного движения.
- •5.Равномерное движение по окружности.
- •6. Связь линейных и угловых параметров.
- •7. Законы Ньютона
- •9. Преобразования Галлилея
- •10.Импульс. Закон сохранения импульса.
64. Третье начало термодинамики. Теорема Нернста.
При
абсолютном нуле всякое тело, как правило,
находится в основном состоянии,
статистический вес которого равен
единице(Ω=1). Формула энтропии S
= k∙lnΩ
дает
в этом случае для энтропии значение,
равное нулю. Отсюда вытекает, что
энтропия всякого тела стремится к нулю
температуры : ![]() .
.
Это утверждение представляет собой т.Нернста или третьим началом термодинамики.
65. Распределение молекул по скоростям.
Аналогичная неравномерность имеет место и в распределении частиц в газе по скоростям. Случайный обмен импульсами и энергиями частиц при столкновениях приводит к некоторому разбросу кинетических энергий и скоростей молекул вокруг их средних значений, соответствующих установившейся в газе температуре. Случайные изменения скоростей молекул в результате столкновений можно рассматривать как случайное блуждание частиц, но не в реальном координатном пространстве, а в пространстве скоростей, осями в котором являются скорости частиц vx, vу, vz (рис.).
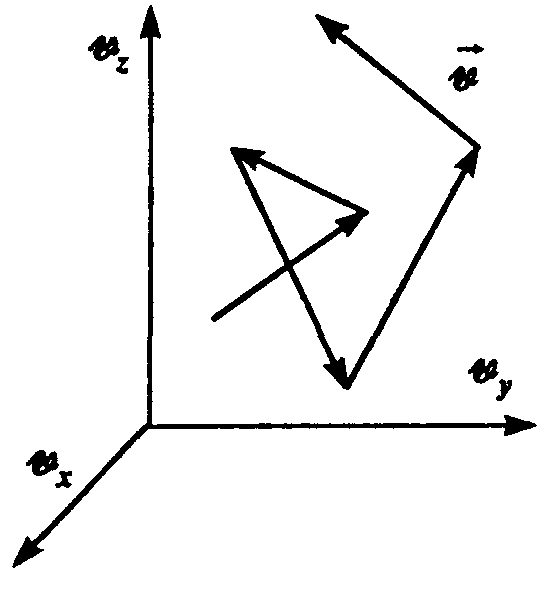 Поэтому
все сказанное о хаотическом тепловом
движении в реальном пространстве
применимо и к распределению частиц по
скоростям.
Поэтому
все сказанное о хаотическом тепловом
движении в реальном пространстве
применимо и к распределению частиц по
скоростям.
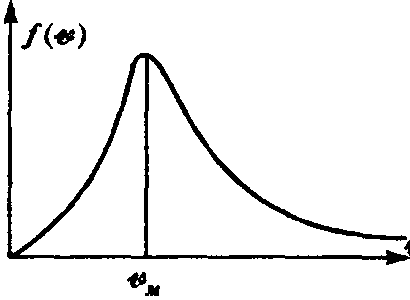
Наиболее вероятная величина скорости в газе — скорость vm.
![]() .
.
Средняя
скорость :
![]()
![]()
Cреднеквадратичной скорости:
![]()
Все эти средние скорости близки друг другу.
51. Внутренняя энергия идеального газа
Внутренней энергией тела называют часть его полной энергии за вычетом кинетической энергии движения тела как целого и потенциальной энергии тела во внешнем поле. Таким образом, во внутреннюю энергию входят кинетическая энергия поступательного и вращательного движений молекул, потенциальная энергия их взаимодействия, энергия колебательного движения атомов в молекулах, а также энергия различных видов движения частиц в атомах.
В идеальном газе потенциальная энергия взаимодействия молекул пренебрежимо мала и внутренняя энергия равна сумме энергий отдельных молекул
![]() ,
,
где Ei — энергия отдельной молекулы.
Ввиду полной беспорядочности движения молекул в газе все направления перемещения молекулы равновероятны. Поэтому на каждую степень свободы поступательного движения приходится в среднем энергия
![]() .
.
Энергия молекул, состоящих из некоторого числа атомов, не жестко связанных друг с другом, будет теперь складываться из энергии поступательного движения, вращательной энергии и энергии колебаний
Ei = Eпоступ + Eвращ +Eколеб.
Нет причин полагать, что поступательное движение является в какой-то мере выделенным по сравнению с вращательным или колебательным. Поэтому следует считать, что по-прежнему на каждую степень свободы молекулы приходится энергия, равная kT/2. Однако следует учесть особенность, связанную с колебательным движением. Средняя энергия колебательного движения складывается из средней кинетической энергии и равной ей средней потенциальной энергии. Поэтому на каждую колебательную степень свободы приходится энергия, в два раза большая, чем на поступательные или вращательные степени свободы. Следовательно, средняя энергия молекулы должна равняться:
<Ei> = i·k·T,
где i — сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
i = iпоступ + iвращат + 2·iколеб.
Внутренняя энергия на один моль идеального газа
![]() .
.
Внутрення энергия определяется температурой
E
![]()
Изменение энергии не зависит от характера пути. Отсутствие зависимости внутренней энергии от занимаемого газом объема указывает на то, что молекулы идеального газа подавляющую часть времени не взаимодействуют друг с другом.
52-55. Работа идеального газа при различных изопроцессах.
dA= PdV.
 Такую
же по величине работу совершает газ при
расширении, перемещая поршень. При этом
dV
положительно,
если газ расширяется, и отрицательно
при сжатии газа. Соответственно работа
dA
положительна
или отрицательна: в первом случае система
производит работу сама, во втором —
внешние силы производят работу над
системой.
Такую
же по величине работу совершает газ при
расширении, перемещая поршень. При этом
dV
положительно,
если газ расширяется, и отрицательно
при сжатии газа. Соответственно работа
dA
положительна
или отрицательна: в первом случае система
производит работу сама, во втором —
внешние силы производят работу над
системой.
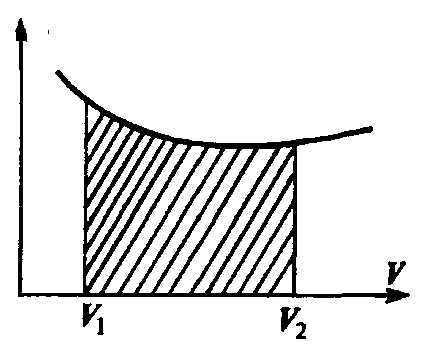
Графически процесс изменения состояния газа при его расширении или сжатии изображается на кривой P, V участком 1-2 на рис. Полная работа, совершаемая газом, при расширении от V1 до V2:
 .
.
Эта работа численно равна заштрихованной площади, заключенной под кривой P(V).
-
Т= const:
Поскольку температура газа остается постоянной dT = 0, при термодинамическом процессе не изменяется внутренняя энергия газа, dE=0, т.е. все подводимое в систему тепло расходуется только на совершение механической работы dQ = PdV. Таким образом,
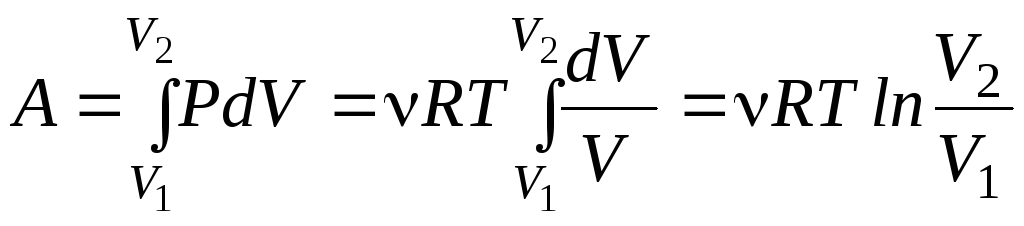 .
.
При изотермическом сжатии газа механическая работа, совершаемая над системой, переходит в тепловую энергию окружающих тел.
2) Изобарический процесс. P=const;
Этот термодинамический процесс происходит при постоянном давлении. Ему соответствуют на диаграмме P,V горизонтальные прямые — изобары, определяемые уравнением состояния:
![]() .
.
Работа при изобарическом процессе пропорциональна разности объемов газа в начальном и конечном состояниях:
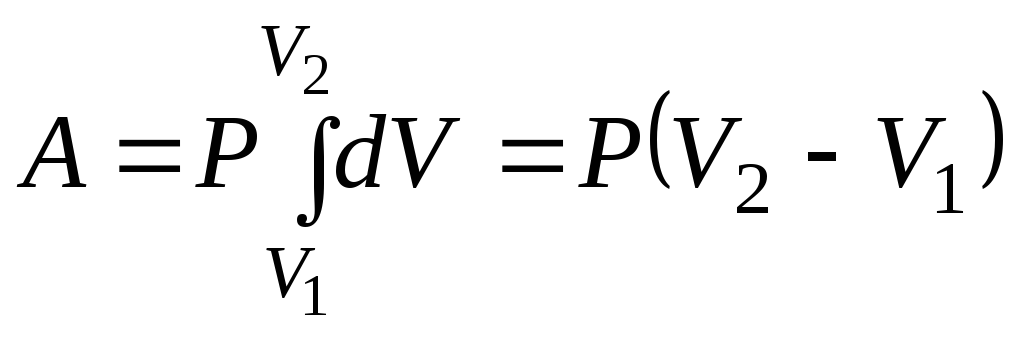 .
.
3) Изохорический процесс.
Зависимость давления от температуры при постоянном объеме представляет собой в координатах P, V вертикальную прямую, называемую изохорой. Поскольку при этом процессе dV = 0, работа равна нулю.
4) Адиабатический процесс происходит в системе без теплообмена с окружающей средой, т. е. dQ = 0. Из первого начала термодинамики (2.32) следует, что при таком процессе dE = ‑ Pd V , т. е. изменение внутренней энергии системы происходит только за счет совершения работы. Выразим изменение внутренней энергии через теплоемкость при постоянном объеме согласно формуле (2.34): dE = v·CV·dT .Тогда
v·CV·dT = ‑ PdV.
Отсюда следует, что при адиабатическом расширении газа dV > 0, dT < 0, и газ охлаждается. При сжатии газа, наоборот, происходит его нагревание и соответственно увеличение внутренней энергии.
Работа при адиабатическом процессе пропорциональна изменению температур газа в начальном и конечном состояниях:
![]()
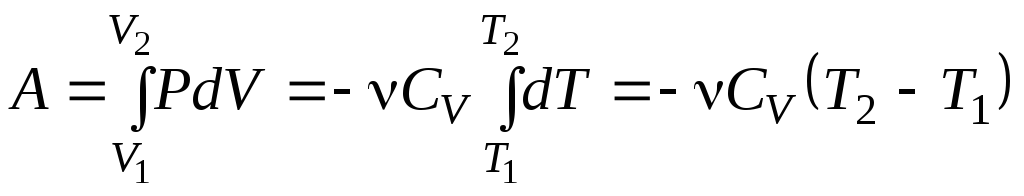 .
.
