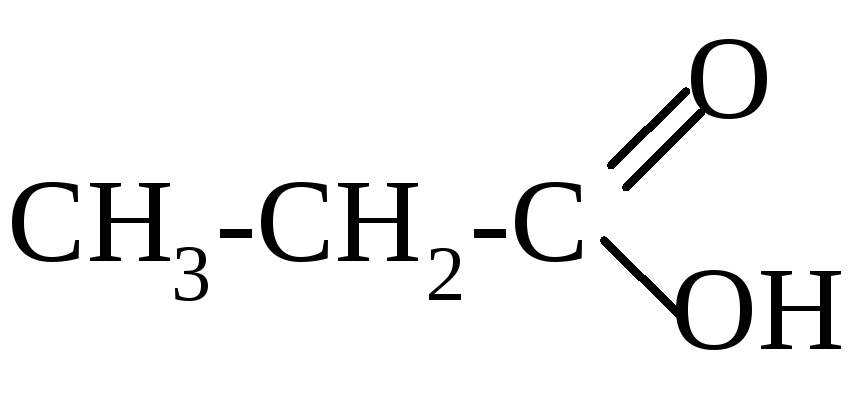- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Медико-биологическое значение альдегидов и кетонов
Муравьиный альдегид (формальдегид) обладает способностью свертывать белки. Его 40% водный раствор (формалин) применяется в медицине как дезинфицирующее средство и консервант анатомических препаратов.
При взаимодействии формальдегида с аммиаком образуется гексаметилентетрамин, или уротропин:


Уротропин используют в качестве дезинфицирующего средства при заболеваниях мочевыводящих путей. Его действие основано на способности расщепляться в кислой среде с выделением формальдегида.
Хлоральгидрат CCl3CH(OH)2 применяется в медицине как успокаивающее и снотворное средство.
Химические свойства карбоновых кислот и их функциональных производных
Ф![]() ункциональной
группой карбоновых кислот является
карбоксильная группа : .
ункциональной
группой карбоновых кислот является
карбоксильная группа : .
Таблица 2
Названия предельных алифатических монокарбоновых кислот
|
Строение |
Название по IUPAC |
Тривиальное название |
Название солей |
|
|
метановая кислота
этановая кислота
пропановая кислота
бутановая кислота
пентановая кислота |
муравьиная кислота
уксусная кислота
пропионовая кислота
масляная кислота
валериановая кислота |
формиаты
ацетаты
пропионаты
бутираты
валераты |
Представителями непредельных алифатических кислот являются

П ростейшей
ароматической кислотой является
бензойная:
ростейшей
ароматической кислотой является
бензойная:
Реакционные центры в молекулах карбоновых кислот
 Карбоксильная
группа является p,π-сопряженной
системой. Неподеленная электронная
пара кислорода OH-группы
участвует в сопряжении с π-электронным
облаком C=O-связи.
Общая электронная плотность смещена к
более электроотрицательному атому
кислорода, поэтому на углероде
карбоксильной группы возникает частичный
положительный заряд. Этот углерод
является электрофильным
центром. За
счет p,π-сопряжения
C-H-связь
еще более поляризуется, водород может
отщепиться в виде протона – это
OH-кислотный
центр.
Неподеленная электронная пара кислорода
C=O-группы
не участвует в сопряжении, к ней может
присоединяться протон водорода – это
оксониевый
основный
центр. За
счет электроноакцепторного действия
карбоксильной группы на α-углеродном
атоме возникает частичный положительный
заряд, CH-связи
поляризуются. α-Углеродный атом является
CH-кислотным
центром.
Карбоксильная
группа является p,π-сопряженной
системой. Неподеленная электронная
пара кислорода OH-группы
участвует в сопряжении с π-электронным
облаком C=O-связи.
Общая электронная плотность смещена к
более электроотрицательному атому
кислорода, поэтому на углероде
карбоксильной группы возникает частичный
положительный заряд. Этот углерод
является электрофильным
центром. За
счет p,π-сопряжения
C-H-связь
еще более поляризуется, водород может
отщепиться в виде протона – это
OH-кислотный
центр.
Неподеленная электронная пара кислорода
C=O-группы
не участвует в сопряжении, к ней может
присоединяться протон водорода – это
оксониевый
основный
центр. За
счет электроноакцепторного действия
карбоксильной группы на α-углеродном
атоме возникает частичный положительный
заряд, CH-связи
поляризуются. α-Углеродный атом является
CH-кислотным
центром.
Кислотные свойства карбоновых кислот
Р анее
(стр.67,68) мы сделали вывод о том, что
карбоновые кислоты проявляют более
сильные кислотные свойства, чем спирты
и фенолы. Это связано с высокой
стабильностью карбоксилат-аниона,
являющегося p,π-сопряженной
системой:
анее
(стр.67,68) мы сделали вывод о том, что
карбоновые кислоты проявляют более
сильные кислотные свойства, чем спирты
и фенолы. Это связано с высокой
стабильностью карбоксилат-аниона,
являющегося p,π-сопряженной
системой:
Отрицательный заряд в карбоксилат-анионе делокализован и распределен между двумя атомами кислорода.
Карбоновые кислоты способны взаимодействовать с щелочами, карбонатами и гидрокарбонатами, образуя соли:
 CH3-CH2-CH2-COOH
+ NaOH CH3-CH2-CH2-COONa
+ H2O
CH3-CH2-CH2-COOH
+ NaOH CH3-CH2-CH2-COONa
+ H2O
натрия бутират
 C6H5-COOH
+ NaHCO3
C6H5-COONa
+ CO2
+ H2O
C6H5-COOH
+ NaHCO3
C6H5-COONa
+ CO2
+ H2O
натрия бензоат
Электроноакцепторные заместители в радикале карбоновых кислот повышают их кислотные свойства, электронодонорные – понижают. В гомологическом ряду предельных алифатических карбоновых кислот кислотность понижается.