
muravev_a_g_rukovodstvo_po_opredeleniyu_pokazatelei_kachestv
.pdfже со стоком с сельскохозяйственных угодий (в качестве эмульгаторов входят в состав инсектицидов, фунгицидов, гербицидов и дефолиантов).
Главными факторами понижения их концентрации являются такие процессы, как биохимическое окисление, а также сорбция взвешенными веществами и донными отложениями.
По биохимической устойчивости, определяемой структурой молекул, ПАВ делят на мягкие, промежуточные и жесткие. К числу наиболее легко окисляющихся ПАВ относятся первичные и вторичные алкилсульфаты нормального строения. С увеличением разветвления цепи скорость окисления понижается, и наиболее трудно разрушаются алкилбензолсульфонаты, приготовленные на основе тетрамеров пропилена.
При понижении температуры скорость биохимического окисления ПАВ уменьшается и при 0–5°С протекает весьма медленно. Наиболее благоприятные для процесса самоочищения водоемов от ПАВ – нейтральная или слабощелочная среды (рН 7–9).
С повышением содержания взвешенных веществ и значительным контактом водной массы с донными отложениями скорость снижения концентрации ПАВ в воде обычно повышается за счет сорбции и соосаждения. При значительном накоплении ПАВ в донных отложениях в аэробных условиях происходит их окисление микрофлорой донного ила.
Вслучае анаэробных условий ПАВ могут накапливаться в донных отложениях и становиться источником вторичного загрязнения водоема.
При биохимическом окислении ПАВ образуются различные промежуточные продукты распада: спирты, альдегиды, фенолы, органические кислоты и др.
Вповерхностных водах ПАВ находятся в растворенном и сорбированном состоянии, а также в поверхностной пленке воды водного объекта. В слабозагрязненных поверхностных водах концентрация ПАВ колеблется обычно в пределах тысячных и сотых долей миллиграмма в 1 л.
Взонах загрязнения водных объектов концентрация повышается до десятых долей миллиграмма, вблизи источников загрязнения может достигать нескольких миллиграммов в 1 л.
Попадая в водоемы и водотоки, ПАВ оказывают значительное влияние на их физико-биологическое состояние, ухудшая кислородный режим и органолептические свойства, и сохраняются там долгое время, так как разлагаются очень медленно. Отрицательным с гигиенической точки зрения свойством ПАВ является их высокая пенообразующая способность. Хотя ПАВ не являются высокотоксичными веществами, имеются сведения о косвенном их воздействии на гидробионтов. Так, при концентрациях 5–15 мг/л рыбы теряют слизистый покров, при более высоких концентрациях может наблюдаться кровотечение жабр.
161
ПДКв ПАВ составляет 0,5 мг/л, ПДКвр – 0,1 мг/л.
ПДКв большинства ПАВ составляет 0,1 мг/л, лимитирующий показатель вредности – органолептический (пенообразование). Поскольку указанные соединения имеют один норматив с одним и тем же показателем вредности, при санитарно-химическом контроле можно ограничиваться определением их суммарного содержания.
Ниже приводится унифицированнный метод определения анионоактивных ПАВ, который разработан в полевом портативном варианте для диапазона концентраций от 0,5 до 5,0 мг/л. Определение является визу- ально-колориметрическим и основано на способности анионоактивных ПАВ образовывать с метиленовым голубым растворимое в хлороформе окрашенное соединение. Это соединение экстрагируют в щелочной среде и промывают кислым раствором метиленового голубого, чем устраняется мешающее влияние хлоридов, нитратов, роданидов и белков.
Концентрация ПАВ в анализируемой воде определяется по окраске пробы, путем визуального сравнения ее с окраской образцов на контрольной шкале.
Проведению анализа мешают катионоактивные ПАВ, а также сульфиды, восстанавливающие метиленовый голубой. Их влияние устраняется добавлением к пробе перекиси водорода.
Продолжительность выполнения анализа – не более 20 мин.
Оборудование и реактивы
Водорода перекись (пергидроль), раствор метиленового голубого, раствор серной кислоты 0,3%, раствор буферный фосфатный, хлороформ.
Пипетка-капельница на 3,0 мл (1 шт.) и на 1,0 мл (4 шт.), пробирка на 20 мл с меткой «10 мл», флакон на 100 мл для приготовления 3%-ного раствора перекиси водорода.
Контрольная шкала образцов окраски для определения ПАВ, отградуированная по концентрациям (0,0; 0,5; 1,0; 2,0; 5,0 мг/л) из состава тест-комплекта либо приготовленная самостоятельно (приложение 1).
Приготовление растворов см. приложение 3.
Подготовка к работе
Приготовление 3%-ного раствора перекиси водорода. К 10 мл пергидроля добавить 90 мл дистиллированной воды.
Примечание: Раствор нестойкий и применяется свежеприготовленным.
162
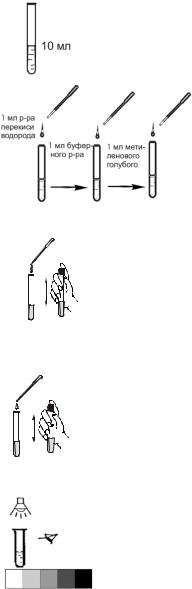
Выполнение анализа
1. Отберите в пробирку анализируемую воду до метки «10 мл», предварительно ополоснув ее 2–3 раза той же водой.
2. В пробирку разными пипетками последовательно прибавьте по 1 мл 3%-ного раствора перекиси водорода, фосфатного буферного раствора, раствора метиленового голубого. После добавления каждого реактива пробирку закройте пробкой и встряхните для перемешивания раствора.
Примечание. Добавляйте растворы разными чистыми пипетками!
3 мл хлороформа 3. Далее пипеткой прибавьте 3 мл хлороформа, после
чего пробирку закройте пробкой и осторожно перемешайте в течение 1 мин.
1 минута
1 мл р-ра серной кислоты
1 минута
4. Затем пипеткой прибавьте 1 мл 0,3%-ного раствора серной кислоты, перемешайте в течение 1 мин.
5. После разделения слоев проведите визуальное колориметрирование пробы, сравнивая окраску нижнего (хлороформного) слоя с окраской ближайшего по окраске поля контрольной шкалы. Для этого пробирку с пробой поместите на белое поле контрольной шкалы и, освещая пробирку рассеянным белым светом достаточной интенсивности, определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение концентрации ПАВ в мг/л.
163
Контроль точности анализа
Контроль точности анализа может быть выполнен путем тестирования специально приготовленного раствора соли натрия додецилсульфата (натрия лаурилсульфата) при концентрациях, равных значениям, приведенным для образцов на контрольной шкале. Эталонные растворы приготавливают весовым методом в лабораторных условиях по методике, изложенной в приложении 1.
6.6.5. Фенолы
Фенолы представляют собой производные бензола с одной или несколькими гидроксильными группами. Простейшим представителем соединений этого класса является фенол (карболовая кислота, или гидроксилбензол) C6 H5OH , имеющий следующую структурную формулу:

 OH
OH
Фенолы в естественных условиях образуются в процессах метаболизма водных организмов, при биохимическом распаде и трансформации органических веществ, протекающих как в водной толще, так и в донных отложениях. Значительное загрязнение фенолами воды водоемов вызывает разложение древесины, происходящее при молевом сплаве леса.
Фенолы являются одним из наиболее распространенных загрязнений, поступающих в поверхностные воды со стоками предприятий нефтеперерабатывающей, сланцеперерабатывающей, лесохимической, коксохимической, анилинокрасочной промышленности и др. В сточных водах этих предприятий содержание фенолов может превосходить 10–20 г/л при весьма разнообразных сочетаниях. Сброс фенольных вод в водоемы и водотоки резко ухудшает их общее санитарное состояние, оказывая влияние на живые организмы не только своей токсичностью, но и значительным изменением режима биогенных элементов и растворенных газов (кислорода, углекислого газа).
Вповерхностных водах фенолы могут находиться в растворенном состоянии в виде фенолятов, фенолят-ионов и свободных фенолов. Фенолы в водах могут вступать в реакции конденсации и полимеризации, образуя сложные гумусоподобные и другие довольно устойчивые соединения. В условиях природных водоемов процессы адсорбции фенолов донными отложениями и взвесями играют незначительную роль.
Внезагрязненных или слабозагрязненных речных водах содержание фенолов обычно не превышает 20 мкг/л, в то время как в загрязненных фенолами природных водах содержание их может достигать сотен мкг/л. Фенолы – соединения нестойкие и подвергаются биохимическому и хи-
164
мическому окислению, причем простые (одноатомные) фенолы подвержены, главным образом, биохимическому окислению. При концентрации более 1 мг/л разрушение фенолов протекает достаточно быстро, убыль фенолов составляет 50–75% за трое суток; при концентрации несколько десятков мкг/л этот процесс замедляется, и убыль за то же время составляет 10–15%. Многоатомные фенолы разрушаются в основном путем химического окисления.
Концентрация фенолов в поверхностных водах подвержена сезонным изменениям. В летний период содержание фенолов падает, т.к. с ростом температуры увеличивается скорость их распада.
В результате хлорирования воды, содержащей фенолы, образуются устойчивые соединения хлорфенолов, малейшие следы которых (0,1 мкг/л) придают воде характерный неприятный привкус. Именно по этой причине ПДК фенолов (летучих) для воды водоемов ХПН при отсутствии хлорирования установлено равным 0,1 мг/л, в то время как в присутствии хлорирования тот же норматив составляет 0,001 мг/л (лимитирующий показатель вредности – органолептический).
В токсикологическом и органолептическом отношении фенолы неравноценны. Летучие с паром фенолы более токсичны и обладают более интенсивным запахом при хлорировании. Наиболее резкие запахи дают простой фенол и крезолы.
С точки зрения аналитического определения фенолы подразделяют на летучие с паром и нелетучие.
К летучим (с паром) фенолам относятся простой фенол; три крезола (метилфенолы, CH3C6H4OH ); шесть ксиленолов (диметилфенолы,CH3 2 C6H3OH ); гваякол (о-метоксифенол, CH3OC6H4OH ); тимол (3-гидрокси-п-цимол, C10H4O ) и многие их замещенные.
К нелетучим фенолам относятся также различные соединения: резорцин (м-дигидроксибензол, C6H4 (OH )2 ); пирокатехин (о-дигидрокси- бензол, C6H4 (OH )2 ); пирогаллол (1,2,3-три-гидроксибензол, C6H3 (OH )3 );-нафтол (1-нафтол, C10H7 (OH ) );. гидрохинон (n-дигидроксибензол, п-
C6H4 (OH )2 ). -нафтол (2-нафтол, C10H7 (OH ) ) и др.
ПДК для нелетучих фенолов установлены в пределах 0,1–0,4 мг/л. Поскольку нормативы на содержание в воде нелетучих фенолов различны, их определяют (при необходимости) раздельно, используя для этой цели специальные селективные методы.
При санитарно-химическом контроле качества воды обычно определяют суммарное содержание именно летучих фенолов, т.к. они наиболее токсичны и, как правило, преобладают в общем количестве фенолов, обычно присутствующих в поверхностных водах. Ниже мы приводим
165

унифицированный метод, применяемый при групповом определении летучих фенолов (РД 52.24.480-95).
Метод определения летучих фенолов основан на реакции их окисления в щелочном буферном растворе (рН=10±0,2) при взаимодействии с индикатором 4-аминоантипирином в присутствии гексацианоферрата (III) калия, протекающей с образованием интенсивно окрашенного в желтый цвет соединения. Важно поддержание рН на требуемом уровне, т.к. при более высоких и низких значениях рН с индикатором реагируют вещества, не относящиеся к фенолам (например, анилин, кетоны). Кроме того, при рН более 10,2 возникающая окраска растворов нестабильна. В аналитическую реакцию не вступают паракрезол и другие паразамещенные фенолы с замещающими алкил-, арил-, нитро-, бензоил-, нитрозо- и альдегидными группами. Пара-замещенные фенолы с замещающими карбоксил-, галоген-, метокси- и сульфогруппами реагируют с 4-аминоантипирином, но наиболее полно эти реакции протекают в менее щелочной среде, при рН=8.
Мешающее влияние на определение фенолов данным методом оказывают окислители (например, свободный хлор, гипохлориты). Их удаляют, при необходимости, перед анализом, добавляя к пробе избыток соли железа (II) или арсенида натрия.
Мешающее влияние оказывают также большие количества нефтепродуктов и смол (их рекомендуется удалять перед анализом экстракцией из пробы четыреххлористым углеродом). Влияние других мешающих соединений может быть, при необходимости, устранено предварительной отгонкой фенолов с паром (например, сероводород и сульфиды в пробе связывают добавлением раствора сульфата меди в присутствии серной кислоты) и определением летучих фенолов в дистилляте.
Предлагаемый метод предназначен для контроля питьевой и природной воды (пресной, морской), а также сточных вод (промышленных стоков, стоков неизвестного происхождения) на суммарное содержание растворенных в воде летучих фенолов. Определение концентрации фенолов проводится визуально-колориметрическим (по цветовой контрольной шкале или шкале эталонных растворов) либо фотоколориметрическим способом, в зависимости от наличия условий, подготовленности персонала и поставленных задач по точности анализа.
Количественная оценка содержания фенолов в пробе проводится путем измерения оптической плотности соответствующих хлороформных экстрактов в кюветах с использованием предварительно построенной
Подробно о количественном определении фенолов, методике концентрирования их путем экстракции из водной среды хлороформом с последующим анализом экстракта на содержание фенолов с помощью фотометрической методики см. РД 52.24.480-95.
166
градуировочной характеристики, которая сохраняет линейность в диапазоне концентраций фенолов в воде от 0,001 до 0,2 мг/л.
При анализе визуально-колориметрическом методом определение носит полуколичественный характер.
Диапазон контролируемых концентраций фенолов – 0,001–1,0 мг/л. Продолжительность выполнения анализа – не более 1 час.
Оборудование и реактивы
Раствор буферный аммонийно-аммиачный, раствор 4-амино- антипирина (индикатора), раствор гексацианоферрата (III) калия (восстановителя), хлороформ перегнанный, фенол очищенный.
Бутыль калиброванная на 500 мл с пробкой, воронка делительная на 100 мл и 1000 мл, пипетки на 5 мл (4 шт.), склянка для колориметрирования с полиэтиленовой пробкой, шприц медицинский на 10 мл с соединительной трубкой.
Контрольная шкала цветных образцов окраски для определения фенолов (0; 0,05; 0,20; 0,50 мг/л) из состава тест-комплекта либо приготовленная самостоятельно (приложение 1).
Приготовление растворов см. приложение 3.
Подготовка к проведению анализа
Подготовка к проведению анализа состоит в приготовлении некоторых растворов, имеющих ограниченные сроки годности (1 неделя). Необходимые для работы растворы рекомендуется приготавливать в количествах, не превышающих потребности в них с учетом срока годности.
Отбор и консервация проб
Отбор проб для определения фенолов имеет особенности. Для отбора проб фенолов используют чистые стеклянные бутыли (пробоотборники, батометры и т.п.), предварительно откалиброванные по фактическому объему при температуре воды 20°С и имеющие соответствующие отметки (риски) на корпусе. Оптимально использовать бутыли объемом 0,5 л. В этом случае для выполнения одного анализа (по двум параллельным определениям) необходимо отобрать пробу в количестве около 1 л.
При отборе проб соблюдают следующее правило: для анализа используют весь объем пробы, причем бутыль водой не ополаскивают.
О консервации и хранении проб воды для определения фенолов см.
табл. 2 (стр. 47).
167
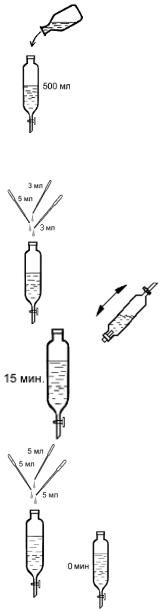
Выполнение анализа
1. Пробу воды из калиброванной бутыли объемом 500 мл (если используется проба меньшего объема, его доводят до 500 мл дистиллированной водой) перенесите в сосуд для экстракции (оптимально использовать делительную воронку вместимостью 1 л).
Примечание. Величина объема пробы, переносимой в делительную воронку, должна быть равна 500 мл с точностью до ± 10 мл, что во многом определяется точностью калибровки сосуда для отбора проб.
2. Добавьте в воронку с помощью пипеток 5,0 мл буферного раствора, 3,0 мл раствора индикатора и 3,0 мл раствора восстановителя.
После прибавления каждого раствора содержимое делительной воронки перемешайте встряхиванием.
3. Содержимое воронки выдержите 15 мин. при комнатной температуре для развития окраски.
4. Проведите экстракцию окрашенного продукта тремя порциями по 5,0 мл хлороформа, каждую из которых вносите в делительную воронку пипеткой. После прибавления каждой порции хлороформа склянку закрывайте пробкой, встряхивайте в течение 1–2 мин.
Воронку оставьте на 10 мин. для расслоения жидкостей.
168
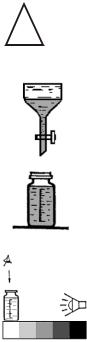
В процессе экстракции необходимо периодически сбрасы-
вать избыточное давление паров хлороформа в делительной воронке, для чего располагайте ее вертикально краном вверх и слегка приоткрывайте кран.
Образующуюся в процессе экстракции каждой порции хлороформа после расслоения слоев основную массу воды (верхний слой) отбрасывают. Используйте для анализа нижний (хлороформный) слой от каждого раствора, перенесите его в делительную воронку на 100 мл и, после тонкого разделения слоев, в склянку для колориметрирования. Все экстракты объедините, сливая в одну и ту же склянку для колориметрирования.
5. Проведите визуальное колориметрирование объединенного экстракта с помощью пленочной контрольной шкалы образцов окраски либо серии стандартных окрашенных растворов. Для этого открытую склянку поместите на белое поле контрольной шкалы. Далее, освещая склянку рассеянным белым светом достаточной интен-
сивности, смотрите на раствор в склянке сверху и определите ближайшее по окраске поле контрольной шкалы и соответствующее значение концентрации фенола в воде в мг/л, получая, таким образом, результат наблюдения концентрации.
При сравнении пробы с серией окрашенных растворов определите ближайший по окраске раствор. В случае, если полученное значение концентрации фенолов в пробе объемом 500 мл превышает 0,2 мг/л, проведите разбавление пробы дистиллированной водой и анализ повторите, учитывая при расчете величины концентрации степень разбавления пробы.
Для более точного определения концентрации фенолов оптическая плотность проб может быть измерена с помощью фотоэлектроколориметра. При колориметрировании проб с помощью фотоэлектроколориметра МКМФ-02 относительно воздуха ориентировочная величина углового коэффициента составляет 0,42 в кюветах с длиной оптического пути 10 мм (светофильтр «460»). Градуировочная характеристика линейна в диапазоне концентраций фенолов от 0,001 до 0,2 мг/л.
169
Контроль точности анализа
Контроль точности при определении фенолов может быть выполнен путем тестирования специально приготовленного раствора фенола очищенного при концентрациях, равных значениям, приведенным для образцов на контрольной шкале.
Методика приготовления эталонных растворов фенола для контроля точности анализа приведена в приложении 1.
170
