
muravev_a_g_rukovodstvo_po_opredeleniyu_pokazatelei_kachestv
.pdf
6.3.5. Общая жесткость, кальций и магний
Жесткость воды – одно из важнейших свойств, имеющее большое значение при водопользовании. Если в воде находятся ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в такой воде затрудняется образование пены при стирке белья или мытье рук, в результате чего возникает ощущение жесткости. Жесткость воды пагубно сказывается на трубопроводах при использовании воды в тепловых сетях, приводя к образованию накипи. По этой причине в воду приходится добавлять специальные «смягчающие» химикаты.
Жесткость воды обусловлена присутствием растворимых и малорастворимых солей-минералов, главным образом кальция (Ca2+) и магния (Mg2+). Кроме указанных, к солям жесткости относят также соли стронция (Sr2+), цинка (Zn2+) и др., однако в поверхностных и грунтовых природных водах из перечисленных катионов в заметных концентрациях присутствуют практически исключительно кальций и магний. Ввиду того, что солями жесткости являются соли разных катионов, имеющие разную молекулярную массу, концентрация солей жесткости, или жесткость воды, измеряется в единицах эквивалентной концентрации (ГОСТ 6055) – количеством моль/л или ммоль/л. При жесткости до 4 ммоль/л экв. вода считается мягкой; от 4 до 8 ммоль/л экв. – средней жесткости; от 8 до 12 ммоль/л экв. – жесткой; более 12 ммоль/л экв. – очень жесткой (встречается и другая классификация воды по степеням жесткости).
Величина жесткости воды может варьироваться в широких пределах в зависимости от типа пород и почв, слагающих бассейн водосбора, а также от сезона года, погодных условий. Общая жесткость воды в озерах и реках тундры, например, составляет 0,1–0,2 ммоль/л экв., а в морях, океанах, подземных водах достигает 80–100 ммоль/л экв. и даже больше (Мертвое море). В табл. 11 приведены значения общей жесткости воды некоторых рек и водоемов России.
Из всех солей, относящихся к солям жесткости, выделяют гидрокарбонаты, сульфаты и хлориды. Содержание других растворимых солей кальция и магния в природных водах обычно очень мало. Жесткость, придаваемая воде гидрокарбонатами, называется гидрокарбонатной, или устранимой (временной), т.к. гидрокарбонаты при кипячении воды (точнее, при температуре более 60°С) разлагаются с образованием малорастворимых карбонатов:
Са(НСО3)2 СаСО3 +Н2О+СО2
Mg(HCO3)2 в природных водах встречается реже, чем Ca(HCO3)2, т.к. магнезитовые породы мало распространены. Поэтому в пресных водах преобладает так называемая кальциевая жесткость.
111
|
|
|
|
|
Таблица 11 |
|
Значения общей жесткости воды |
|
|||
|
некоторых рек и водоемов России |
|
|||
|
|
|
|
|
|
Море, озеро |
Сухой оста- |
Общая жест- |
Река |
Сухой |
Общая же- |
|
ток, мг/л |
кость, |
|
остаток, |
сткость, |
|
|
ммоль/л экв. |
|
мг/л |
ммоль/л |
|
|
|
|
|
экв. |
Каспийское |
13500 |
74 |
Дон |
476 |
7 |
море |
|
|
|
|
|
Черное море |
16000 |
46 |
Волга |
453 |
5,4 |
Балтийское |
7500 |
13,9 |
Москва |
345 |
14,6 |
море |
|
|
|
|
|
Белое море |
1800 |
7 |
Иртыш |
250 |
2,5 |
Оз. Балхаш |
8,8 |
8,8 |
Ангара |
132 |
2 |
Оз. Байкал |
220 |
2,6 |
Нева |
80 |
0,7–4,3 |
Оз. Ладож- |
73 |
0,6 |
Днепр |
300 |
5,7 |
ское |
|
|
|
|
|
Примечание. В природных условиях приведенная выше реакция обратима, однако при выходе на поверхность подземных (грунтовых) вод, обладающих значительной временной жесткостью, равновесие сдвигается в сторону образования СО2, который высвобождается в атмосферу. Этот процесс приводит к разложению гидрокарбонатов и выпадению в осадок CaCO3 и MgCO3. Таким путем образуются разновидности карбонатных пород, называемые известковыми туфами. В присутствии растворенного в воде углекислого газа протекает и обратная реакция. Так происходит растворение, или вымывание, карбонатных пород в природных условиях.
Жесткость, обусловленная хлоридами или сульфатами, называется неустранимой (постоянной), т.к. эти соли устойчивы при нагревании и кипячении воды.
Суммарная жесткость воды, т.е. общее содержание растворимых солей кальция и магния, получила название общей жесткости.
Допустимая величина общей жесткости для питьевой воды и источников централизованного водоснабжения составляет не более 7 ммоль/л экв. (в отдельных случаях – до 10 ммоль/л экв.), лимитирующий показатель вредности – органолептический.
Предлагаемый метод определения общей жесткости как суммарной массовой концентрации катионов кальция и магния основан на реакции солей кальция и магния с реактивом – трилоном Б (двунатриевой солью этилендиаминтетрауксусной кислоты):
112

Ca2++Na2H2R Na2CaR+2H+,
Mg2++Na2H2R Na2MgR+2H+,
где R – радикал этилендиаминтетрауксусной кислоты –
(–OCCH2)2NCH2CH2N(CH2CO–)2
Анализ проводят в аммиачном буферном растворе при рН 10,0–10,5 титриметрическим методом в присутствии индикатора хром темносинего кислотного.
Общую жесткость (CОЖ) в ммоль/л экв. вычисляют по формуле:
C VTP Н 1000 ,
ОЖ |
VA |
|
где: VТР – объем раствора трилона Б, израсходованного на титрование, мл; Н – концентрация титрованного раствора трилона Б, моль/л экв.; VА – объем воды, взятой на анализ, мл;
1000 – коэффициент пересчета единиц измерения из моль/л в ммоль/л.
Метод определения массовой концентрации катиона кальция (РД 52.24.403-95, ИСО 6058) аналогичен методу определения общей жесткости с реактивом трилоном Б с той разницей, что анализ проводится в сильнощелочной среде (рН 12–13) в присутствии индикатора мурексида. Молярную концентрацию эквивалента кальция рассчитывают по результатам титрования по такой же формуле. Определению кальция мешают карбонаты и диоксид углерода, удаляемые из пробы при ее подкислении.
Для определения содержания магния в незагрязненных поверхностных и грунтовых природных водах, как и в большинстве речных вод, можно применять расчетный метод по разности результатов определения общей жесткости и концентрации катиона кальция. Для анализа загрязненных вод на содержание магния необходимо применять прямое определение магния.
А. Определение общей жесткости
Оборудование и реактивы
Баня водяная; ножницы; палочка стеклянная; пипетка на 2 мл или на 5 мл с резиновой грушей (медицинским шприцем) и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Вода дистиллированная; раствор буферный аммиачный; раствор индикатора хром темно-синего кислотного; раствор трилона Б (0,05 моль/л экв.).
Приготовление растворов см. приложение 3.
113
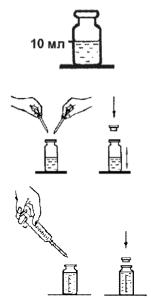
Выполнение анализа
1. В склянку налейте 10 мл анализируемой воды.
2. Добавьте в склянку пипетками 6–7 капель раствора буферного аммиачного и 4–5 капель раствора индикатора хром темно-синего.
3. Герметично закройте склянку пробкой и встряхните для перемешивания.
4. Постепенно титруйте содержимое склянки раствором трилона Б до перехода окраски в точке эквивалентности из винно-красной в яркоголубую. Периодически встряхивайте склянку для перемешивания пробы. Определите объем раствора, израсходованный на титрование общей жесткости (VОЖ, мл).
5. Рассчитайте величину общей жесткости (CОЖ ) в ммоль/л экв. по формуле со стр. 113 или для VА = 10 мл и Н = 0,05 моль/л экв. по следующей формуле:
СОЖ=VОЖ 5
Примечание. После изменения окраски пробу необходимо выдержать еще 0,5 мин. для полного протекания реакции, после чего принять решение об окончании титрования (окраска раствора может несколько восстановиться. В этом случае необходимо добавить еще некоторое количество раствора трилона Б).
В. Определение кальция
Оборудование и реактивы
Баня водяная; ножницы; палочка стеклянная; пипетка на 2 мл или на 5 мл с шприцем и соединительной трубкой; пипетка-капельница (0,5 мл); склянка с меткой «10 мл».
Бумага индикаторная универсальная; вода дистиллированная; индикатор мурексид в капсулах (по 0,03 г); раствор буферный аммиачный; раствор гидроксида натрия (10%); раствор соляной кислоты (1:100); раствор трилона Б (0,05 моль/л экв.).
114
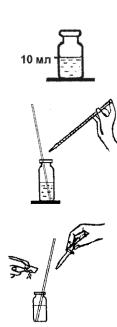
Приготовление растворов см. приложение 3.
Выполнение анализа
1. В склянку с меткой «10 мл» налейте до метки анализируемую воду.
2. Далее из раствора удаляется гидрокарбонатанион. Для этого в склянку прибавьте по каплям раствор соляной кислоты (1:100) при интенсивном перемешивании стеклянной палочкой до достижения величины рН раствора 4–5 (при перемешивании удаляется и большая часть диоксида углерода, мешающего определению). Величину рН контролируйте с помощью бумаги индикаторной универсальной.
3. К пробе прибавьте пипеткой-капельницей 13– 14 капель (около 0,5 мг) раствора гидроокиси натрия и содержимое одной капсулы (0,02–0,03 г) индикатора мурексида. Раствор перемешайте стеклянной палочкой.
4. Затем проведите титрование раствором трилона Б из пипетки на 5 мл на белом фоне до перехода окраски в точке эквивалентности из оранжевой в сине-фиолетовую. Определите объем раствора трилона Б, израсходованный на титрование кальция (VКА, мл).
5. Рассчитайте молярную концентрацию эквивалента кальция (СКА) в ммоль/л экв. по уравнению:
СКА=VКА 5.
Примечание. После изменения окраски пробу необходимо выдержать еще 0,5 мин. для полного протекания реакции, после чего принять решение об окончании титрования (окраска раствора может несколько восстановиться. В этом случае необходимо добавить еще некоторое количество раствора трилона Б).
Массовая концентрация катиона кальция может быть рассчитана умножением полученного значения СКА на молярную массу кальция (40 г/моль).
115
С. Определение магния
Массовую концентрацию катиона магния (СМГ) в мг/л определите расчетным методом, произведя вычисления по формуле:
CМГ = (CОЖ – CКА) 24,3,
где: CОЖ и CКА – результаты определения общей жесткости (ммоль/л экв.) и молярной концентрации эквивалента катиона кальция (ммоль/л экв.) соответственно; 24,3 – молярная масса магния.
Полученный результат округлите до целых чисел (мг/л).
6.3.6. Натрий и калий
Массовую концентрацию катиона натрия (СНА) в мг/л определите расчетным методом, производя вычисление по формуле:
СНА=(А–СОЖ) 23,
где: А – сумма массовых концентраций главных анионов (определяют с использованием данных табл. 12), ммоль/л экв.; СОЖ – значение общей жесткости, ммоль/л экв.; 23 – молярная масса натрия.
6.3.7. Общее солесодержание
Для расчета общего солесодержания по сумме концентраций главных анионов в ммоль-эквивалентной форме их массовые концентрации, определенные при анализе и выраженные в мг/л, умножьте на коэффициенты, указанные в табл. 12, после чего просуммируйте.
Таблица 12
Коэффициенты пересчета концентраций из мг/л в ммоль/л экв.
Анионы |
Коэффициент |
Анионы |
Коэффициент |
Гидрокарбонат |
0,0164 |
Сульфат |
0,0208 |
Карбонат |
0,0333 |
Нитрат |
0,0161 |
Хлорид |
0,0282 |
Нитрит |
0,0217 |
Концентрацию катиона калия в данном расчете (для природных вод) условно учитывают в виде концентрации катиона натрия (СКНА).
Полученный результат округлите до целых чисел (ммоль/л экв.).
116
6.4. Биогенные элементы
Биогенными элементами (биогенами) традиционно считаются элементы, входящие в значительных количествах в состав живых организмов. Круг элементов, относимых к биогенным, достаточно широк, это – азот, фосфор, сера, железо, кальций, магний, калий и др.
Вопросы контроля качества воды и экологической оценки водоемов внесли в понятие биогенных элементов более широкий смысл: к ним относят соединения (точнее, компоненты воды), которые, во-первых, являются продуктами жизнедеятельности различных организмов и, вовторых, являются «строительным материалом» для живых организмов. В первую очередь к ним относятся соединения азота (нитраты, нитриты, органические и неорганические аммонийные соединения), а также фосфора (ортофосфаты, полифосфаты, органические эфиры фосфорной кислоты и др.). Соединения серы нас интересуют в этой связи в меньшей степени, так как сульфаты мы рассматривали в аспекте компонента минерального состава воды, а сульфиды и гидросульфиды если присутствуют в природных водах, то в очень малых концентрациях, и могут быть обнаружены по запаху.
6.4.1. Аммоний
Соединения аммония содержат атом азота в минимальной степени окисления «–3».
Катионы аммония являются продуктом микробиологического разложения белков животного и растительного происхождения. Образовавшийся таким образом аммоний вновь вовлекается в процесс синтеза белков, участвуя тем самым в биологическом круговороте веществ (цикле азота). По этой причине аммоний и его соединения в небольших концентрациях обычно присутствуют в природных водах.
Существуют два основных источника загрязнения окружающей среды аммонийными соединениями. Аммонийные соединения в больших количествах входят в состав минеральных и органических удобрений, избыточное и неправильное применение которых приводит к соответствующему загрязнению водоемов. Кроме того, аммонийные соединения в значительных количествах присутствуют в нечистотах (фекалиях). Не утилизированные должным образом нечистоты могут проникать в грунтовые воды или смываться поверхностными стоками в водоемы. Стоки с пастбищ и мест скопления скота, сточные воды от животноводческих комплексов, а также бытовые и хозяйственно-фекальные стоки всегда содержат большие количества аммонийных соединений. Опасное загрязнение грунтовых вод хозяйственно-фекальными и бытовыми сточными водами происходит при разгерметизации системы
117
канализации. По этим причинам повышенное содержание аммонийного азота в поверхностных водах обычно является признаком хозяйст- венно-фекальных загрязнений.
Предложенный метод определения массовой концентрации катиона аммония (приведен в ГОСТ 4192) основан на его реакции с реактивом Несслера с образованием окрашенного в щелочной среде в желтый цвет соединения:
2K2HgJ4+NH3+3KOH=Hg2OJNH2+7KJ+2H2O
желтый
Мешающее влияние железа устраняют добавлением к пробе сегне-
товой соли: КСОО(СНОН)СООNa.
Концентрацию катионов аммония определяют визуально-колоримет- рическим методом, сравнивая окраску раствора с контрольной шкалой образцов окраски.
ПДК аммиака и ионов аммония в воде водоемов составляет 2,6 мг/л (или 2,0 мг/л по аммонийному азоту). Лимитирующий показатель вредности – общесанитарный.
Оборудование и реактивы
Ножницы, пипетка на 2 мл, пробирка колориметрическая с меткой «5 мл», шприц медицинский с соединительной трубкой.
Реактив Несслера, сегнетова соль в капсулах по 0,1 г.
Контрольная шкала образцов окраски для определения катиона аммония (0; 0,2; 0,7; 2,0; 3,0 мг/л) из состава тест-комплекта или приготовленная самостоятельно.
Приготовление растворов см. приложение 3.
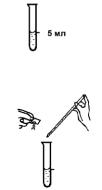
Проведение анализа
1. Налейте анализируемую воду в колориметрическую пробирку до метки «5 мл».
2. Добавьте в воду шпателем на ¼ глубины (около 0,1 г) сегнетовой соли и туда же пипеткой – 1,0 мл реактива Несслера. Содержимое пробирки перемешайте встряхиванием.
118
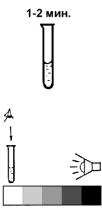
3. Оставьте смесь на 1–2 мин. для завершения реакции.
4. Окраску раствора в пробирке сравните на белом фоне с контрольной шкалой образцов окраски.
Для более точного определения концентрации аммония оптическая плотность пробы может быть измерена с помощью фотоэлектроколориметра. При колориметрировании проб с помощью фотоэлектроколориметра МКМФ-02 (светофильтр «425») ориентировочная величина углового коэффициента состав-
ляет 0,22 в кюветах с длиной оптического пути 10 мм. Градуировочная характеристика линейна в диапазоне концентраций катиона аммония от 0 до 3,0 мг/л.
Контроль точности анализа
Контроль точности анализа при определении аммония проводят с использованием эталонных растворов с известным содержанием катионов аммония (см. приложение 1) либо с использованием поверенного (образцового) прибора для измерения концентрации аммония потенциометрическим методом.
6.4.2. Нитраты
Нитраты являются солями азотной кислоты и обычно присутствуют в воде. Нитрат-анион содержит атом азота в максимальной степени окисления «+5». Нитратобразующие (нитратфиксирующие) бактерии превращают нитриты в нитраты в аэробных условиях. Под влиянием солнечного излучения атмосферный азот (N2) превращается также преимущественно в нитраты посредством образования оксидов азота. Многие минеральные удобрения содержат нитраты, которые при избыточном или нерациональном внесении в почву приводят к загрязнению водоемов. Источниками загрязнения нитратами являются также поверхностные стоки с пастбищ, скотных дворов, молочных ферм и т.п.
Повышенное содержание нитратов в воде может служить индикатором загрязнения водоема в результате распространения фекальных либо химических загрязнений (сельскохозяйственных, промышленных). Богатые нитратными водами сточные канавы ухудшают качество воды в во-
119

доеме, стимулируя массовое развитие водной растительности (в первую очередь – сине-зеленых водорослей) и ускоряя эвтрофикацию водоемов. Питьевая вода и продукты питания, содержащие повышенное количество нитратов, также могут вызывать заболевания, и в первую очередь у младенцев (так называемая метгемоглобинемия). Вследствие этого расстройства ухудшается транспортировка кислорода с клетками крови и возникает синдром «голубого младенца» (гипоксия). Вместе с тем, растения не так чувствительны к увеличению содержания в воде азота, как фосфора.
Присутствие нитратных ионов в природных водах связано с:
внутриводоемными процессами нитрификации аммонийных ионов в присутствии кислорода под действием нитрифицирующих бактерий;
атмосферными осадками, которые поглощают образующиеся при
атмосферных электрических разрядах оксиды азота (концентрация нитратов в атмосферных осадках достигает 0,9–1,0 мг/дм3);
промышленными и хозяйственно-бытовыми сточными водами, осо-
бенно после биологической очистки, когда концентрация достигает 50 мг/дм3;
стоком с сельскохозяйственных угодий и со сбросными водами с
орошаемых полей, на которых применяются азотные удобрения . Главными процессами, направленными на понижение концентра-
ции нитратов в водоемах, являются потребление их фитопланктоном и денитрофицирующими бактериями, которые при недостатке кислорода используют кислород нитратов на окисление органических веществ.
В поверхностных водах нитраты находятся в растворенной форме. Концентрация нитратов в поверхностных водах подвержена заметным сезонным колебаниям: минимальная в вегетационный период, она увеличивается осенью и достигает максимума зимой, когда при минимальном потреблении азота происходит разложение органических веществ и переход азота из органических форм в минеральные. Амплитуда сезонных колебаний может служить одним из показателей эвтрофирования водного объекта.
Смертельная доза нитратов для человека составляет 8–15 г; допустимое суточное потребление по рекомендациям ФАО/ВОЗ – 5 мг/кг массы тела.
ПДКв нитратов составляет 45 мг/дм3 (по NO3–) (тождественно равен стандарту США для питьевой воды), ПДКвр – 40 мг/дм3 (по NO3–) или 9,1 мг/дм3 (по азоту).
С одного гектара орошаемых земель в водные системы может выноситься до 8–10 кг соединений азота.
120
