
muravev_a_g_rukovodstvo_po_opredeleniyu_pokazatelei_kachestv
.pdf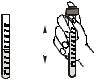
Метод определения нитрат-анионов в воде является унифицированным и основан на визуальном сравнении окраски пробы исследуемой воды с контрольной шкалой образцов окраски водных растворов с различным содержанием нитрат-анионов.
Определение нитрат-анионов основано на предварительном восстановлении цинковой пылью нитрат-анионов до нитрит-анионов с последующим образованием азокрасителя в присутствии сульфаниловой кислоты и α-нафтиламина по реакции, описанной при определении нитритов.
Диапазон определяемых концентраций нитрат-анионов в воде – от 0 до 50 мг/л.
Объем пробы, необходимой для анализа, составляет 6 мл. Продолжительность выполнения анализа – не более 25 мин.
Оборудование и реактивы
Порошок цинкового восстановителя, раствор α-нафтиламина, раствор сульфаниловой кислоты.
Пипетка-капельница на 3 мл, пробирки градуированные на 15 мл с пробкой (2 шт.), склянки для колориметрирования с меткой «10 мл» (2 шт.), флакон для приготовления реактива на нитрат-анионы, шпатель.
Контрольная шкала образцов окраски проб для визуального колориметрирования «Нитрат-анионы» (0–10–30–50 мг/л) из состава тесткомплекта либо приготовленная самостоятельно.
Приготовление растворов и реактивов см. приложение 3.
Подготовка к работе
Приготовление реактива на нитрат-анионы. С помощью градуированных пробирок отмеряются равные объемы растворов α- нафтиламина и и сульфаниловой кислоты и смешиваются во флаконе для приготовления реактива на нитрат-анионы. Реактив готовится в количествах, необходимых для проведения анализа, и используется в день приготовления.
Выполнение анализа
|
|
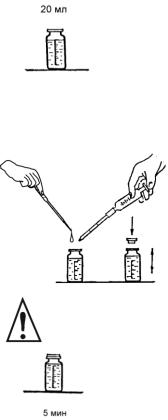
1. Градуированную пробирку ополосните несколько |
11 мл |
|
раз анализируемой водой. В пробирку отберите 6 мл |
|
||
6 мл |
|
анализируемой воды (пробы), прибавьте дистиллят до |
|
значения объема 11 мл и перемешайте. |
|
|
||
|
|
121

2 мл реактива на нитрат-анион
2. К содержимому пробирки добавьте 2,0 мл свежеприготовленного реактива на нитрат-анионы, закройте пробирку пробкой и встряхните для перемешивания раствора.
0,2 г порошка восстановителя 
3. Прибавьте в пробирку около 0,2 г порошка цинко-  вого восстановителя, используя шпатель (0,2 г порош-
вого восстановителя, используя шпатель (0,2 г порош- 
 ка заполняют шпатель на ½ глубины, не образуя «гор-
ка заполняют шпатель на ½ глубины, не образуя «гор- 


 ки»). Закройте пробирку пробкой и тщательно пере-
ки»). Закройте пробирку пробкой и тщательно пере-
мешайте.
4. Оставьте пробирку на 15 минут для полного протекания реакции, периодически встряхивая содержимое пробирки.
15 минут
5. В склянку для колориметрирования перелейте раствор из пробирки до метки «10», стараясь не допустить попадания осадка в склянку.
6. Проведите визуальное колориметрирование пробы. Для этого склянку поместите на белое поле контрольной шкалы и, освещая склянку рассеянным белым светом достаточной интенсивности, определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение концентрации нитрат-анионов в мг/л.
Контроль точности анализа
Контроль точности при определении нитратов проводят с использованием эталонных растворов (см. приложение 1) либо с использованием поверенного (образцового) нитратомера.
122
6.4.3. Нитриты
Нитритами называются соли азотистой кислоты. Нитрит-анионы являются промежуточными продуктами биологического разложения азотсодержащих органических соединений и содержат атомы азота в промежуточной степени окисления «+3». Нитрифицирующие бактерии превращают аммонийные соединения в нитриты в аэробных условиях. Некоторые виды бактерий в процессе своей жизнедеятельности также могут восстанавливать нитраты до нитритов, однако это происходит уже в анаэробных условиях. Нитриты часто используются в промышленности как ингибиторы коррозии, в пищевой промышленности как консерванты.
Благодаря способности превращаться в нитраты, нитриты, как правило, отсутствуют в поверхностных водах. Поэтому наличие в анализируемой воде повышенного содержания нитритов свидетельствует о загрязнении воды, причем с учетом частично прошедшей трансформациии азотистых соединений из одних форм в другие.
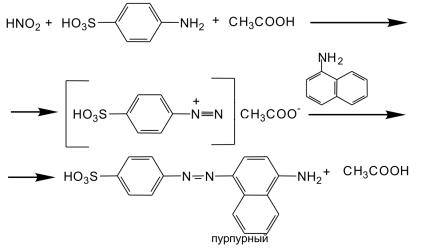
Предлагаемый метод определения массовой концентрации нитританиона соответствует приведенному в ГОСТ 4192. Метод основан на реакции нитрат-аниона в среде азотистой кислоты с реактивом Грисса (смесью сульфаниловой кислоты и 1-нафтиламина). При этом протекают реакции диазотирования и азосочетания, в результате которых образуется азосоединение (азокраситель), имеющее пурпурную окраску:
Концентрацию нитрит-анионов определяют визуально-колориметри- ческим методом, сравнивая окраску раствора с контрольной шкалой образцов окраски.
123
ПДК нитритов (по NO2–) в воде водоемов составляет 3,3 мг/л (или
1 мг/л нитритного азота), лимитирующий показатель вредности – сани- тарно-токсикологический.
Оборудование и реактивы
Ножницы, пробирка колориметрическая с меткой «5 мл». Реактив Грисса в капсулах по 0,05 г.
Контрольная шкала образцов окраски для определения нитританиона (0; 0,02; 0,10; 0,50; 2,0 мг/л) из состава тест-комплекта или приготовленная самостоятельно.
Приготовление реактива Грисса см. приложение 3.
Выполнение анализа
1. Налейте анализируемую воду в колориметрическую пробирку до метки «5 мл».
2. Добавьте содержимое одной капсулы (около 0,05 г) реактива Грисса в пробирку. Перемешайте содержимое пробирки встряхиванием до растворения смеси.
3. Оставьте пробирку на 20 мин. для завершения реакции.
4. Проведите визуальное колориметрирование пробы. Окраску раствора в пробирке на белом фоне сравните с контрольной шкалой образцов окраски.
Для более точного определения концентрации нитритов оптическая плотность пробы может быть измерена с помощью фотоэлектроколори-
124

метра. При колориметрировании проб с помощью фотоэлектроколориметра МКМФ-02 (светофильтр «540») ориентировочная величина углового коэффициента составляет 0,25 в кюветах с длиной оптического пути 10 мм. Градуировочная характеристика линейна в диапазоне концентраций нитрит-аниона от 0 до 2,0 мг/л.
Контроль точности анализа
Контроль точности анализа при определении нитритов проводят с использованием эталонных растворов с известным содержанием нитританиона (см. приложение 1) либо с использованием поверенного (образцового) нитритомера потенциометрическим методом.
6.4.4. Фосфаты и общий фосфор
Фосфор является необходимым элементом для жизни. Являясь важнейшим биогенным элементом, именно фосфор чаще всего лимитирует развитие продуктивности водоемов. Поэтому поступление избытка соединений фосфора с водосбора в виде минеральных удобрений с поверхностным стоком полей (с гектара орошаемых земель может выносить 0,4–0,6 кг фосфора), со стоками ферм (0,01–0,05 кг/сут. на одно животное), с недоочищенными или неочищенными бытовыми сточными водами (0,003–0,006 кг/сут. на одного жителя), а также с некоторыми производственными расходами приводит к резкому неконтролируемому приросту растительной биомассы водного объекта. Особенно характерен данный процесс для малопроточных и непроточных водоемов. Происходит изменение трофического статуса водоема, сопровождающееся перестройкой всего водного сообщества и ведущее к преобладанию гнилостных процессов (и, соответственно, возрастанию мутности, солености, концентрации бактерий).
В природных и сточных водах фосфор может присутствовать в разных видах. В растворенном состоянии (иногда говорят – в жидкой фазе анализируемой воды) он может находиться в виде ортофосфорной кислоты (H3PO4) и ее анионов (H2PO4–, HPO42–, PO43–), в виде мета-, пиро- и полифосфатов (эти вещества используют для предупреждения образования накипи, они входят также в состав моющих средств). Кроме того, существуют разнообразные фосфорорганические соединения – нуклеиновые кислоты, нуклеопротеиды, фосфолипиды и др., которые также могут присутствовать в воде, являясь продуктами жизнедеятельности или разложения организмов. К фосфорорганическим соединениям относятся также некоторые пестициды .
Фосфорорганические пестициды аналитически определяются в воде специальными методами.
125

Фосфор может содержаться и в нерастворенном состоянии (в твердой фазе воды), присутствуя в виде взвешенных в воде труднорастворимых фосфатов, включая природные минералы, белковые, органические фосфорсодержащие соединения, остатки умерших организмов и др. Фосфор в твердой фазе в природных водоемах обычно находится в донных отложениях, однако может встречаться, и в больших количествах, в сточных и загрязненных природных водах.
Фосфаты определяются колориметрическим методом (ГОСТ 18309, ИСО 6878) по реакции с молибдатом аммония в кислой среде:
HPO42–+3NH4++12MoO42–+23H+=(NH4)3[PMo12O40]+12H20
желтый
Образующийся при этом комплекс, продукт желтого цвета, далее под действием восстановителя – хлорида олова (II) – превращается в интенсивно окрашенный синий краситель сложного состава – «молибденовую синь». Концентрацию ортофосфатов в анализируемой воде определяют по окраске пробы, визуально сравнивая ее с окраской образцов на контрольной шкале или измеряя оптическую плотность проб с помощью фотоколориметра.
В данную реакцию из всех присутствующих в воде фосфатов непосредственно вступают только ортофосфаты. Для определения полифосфатов их необходимо предварительно перевести в ортофосфаты путем кислотного гидролиза в присутствии серной кислоты. Многие сложные эфиры фосфорной кислоты также могут быть определены после их кислотного гидролиза в тех же условиях, что и полифосфаты. Реакция кислотного гидролиза на примере пирофосфата протекает следующим образом:
Na4P2O7+2H2SO4+H2O=2H3PO4+4Na++2SO42–
Некоторые фосфорсодержащие органические соединения могут быть определены только после их минерализации, называемой иногда также «мокрым сжиганием». Минерализация фосфорсодержащих органических соединений проводится при кипячении пробы с добавлением кислоты и сильного окислителя – персульфата или перекиси водорода. В случае использования для этой цели персульфата калия реакция протекает по уравнению:
O
R–O–P–O–R1+K2S2O8+H2SO4=H3PO4+2K++3SO42–+R+R1 ,
OH
126

где R и R1 – органические фрагменты.
Минерализация приводит к превращению в ортофосфаты все, даже труднорастворимые, формы фосфатов в воде. Таким образом определяется содержание общего фосфора в любой воде (этот показатель можно определять как для растворенных фосфатов, так и для нерастворимых соединений фосфора). Однако для природных вод, не содержащих или содержащих незначительное количество трудногидролизующихся фосфатов в твердой фазе, минерализации обычно не требуется, и полученный при анализе гидролизованной пробы результат может с хорошим приближением быть принят за содержание общего фосфора.
Влияние некоторых мешающих примесей, которые могут присутствовать в сточных водах – силикатов (более 50 мг/л), соединений железа (III) (более 1 мг/л), сульфидов и сероводорода (более 3 мг/л), устраняют добавлением к пробе специальных реагентов, входящих в состав тесткомплекта, или изменением операций обработки пробы.
Возможное влияние нитритов (до 25 мг/л) устраняется за счет прибавления к пробе раствора для их связывания, предусмотренного методом (раствора сульфаминовой кислоты). Проведению анализа мешают большие количества хлоридов, нитритов, хроматов, арсенатов, танина.
При анализе фосфатов в гидролизованной пробе непосредственно определяется сумма ортофосфатов и полифосфатов; концентрация же полифосфатов рассчитывается как разность между результатами анализа гидролизованной и негидролизованной пробы. Гидролиз полифосфатов протекает также и при проведении минерализации, т.к. ее проводят в сильнокислой среде.
ПДК полифосфатов (триполифосфат и гексаметафосфат) в воде водоемов составляет 3,5 мг/л в пересчете на ортофосфат-анион РО43–, лими-
тирующий показатель вредности – органолептический.
Диапазон определяемых концентраций ортофосфатов в воде при визу- ально-колориметрическом определении – от 0,2 до 7,0 мг/л, при фотометрическом определении – 0,01–0,4 мг/л. Определение визуально-колоримет- рическим методом возможно и при концентрации ортофосфатов более 7,0 мг/л после соответствующего разбавления пробы чистой водой.
Оборудование и реактивы
Колба коническая термостойкая (Эрленмейера) на 100 мл со шлифом, мерная склянка с делениями (5, 10, 20 мл) с пробкой, холодильник обратный со шлифом, кипелки (стеклянные капилляры, зерна силикагеля), колба мерная вместимостью 50 мл, плитка электрическая с закрытым
Кипелки используются для обеспечения равномерного и устойчивого кипения жидкостей.
127
нагревательным элементом, пипетка-капельница на 1 мл, чашка фарфоровая на 200–500 мл.
Вода дистиллированная, перманганат калия кристаллический, раствор восстановителя, раствор для связывания нитритов, раствор молибдата, раствор серной кислоты (10%-ный) водный, раствор серной кислоты (1:3) водный, персульфат аммония в капсулах по 0,5 г.
Контрольная шкала образцов окраски для концентраций ортофосфатов (0; 0,2; 1,0; 3,5; 7,0 мг/л) из состава тест-комплекта или приготовленная самостоятельно.
Приготовление растворов см. приложение 3.
Выполнение определения
А. Определение ортофосфатов в питьевой и природной воде
1. Отберите в мерную склянку 20 мл профильтрованной или отстоянной анализируемой воды (пробы), предварительно ополоснув ее 2–3 раза той же водой.
Примечание. При ожидаемой концентрации ортофосфатов более 5 мг/л рекомендуется отбирать 5 мл пробы (склянкой) или 1 мл (шприцемдозатором), доводя объем раствора в склянке до 20 мл чистой водой, не содержащей ортофосфатов.
2. Добавьте к пробе пипеткойкапельницей 10 капель раствора для связывания нитритов и затем шприцемдозатором 1 мл раствора молибдата. Склянку закройте пробкой и встряхните для перемешивания раствора.
Раствор молибдата содержит серную кислоту. Соблюдайте осторожность при выполнении данной операции!
3. Оставьте пробу на 5 мин. для полного протекания реакции.
128
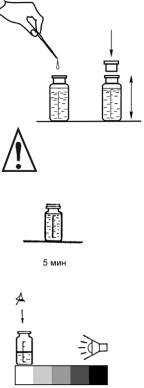
4. Добавьте к пробе пипеткой-капельницей 2–
3 капли раствора восстановителя. Склянку закройте пробкой и встряхните для перемешивания раствора. При наличии в воде ортофосфатов раствор приобретает синюю окраску.
Раствор восстановителя содержит соляную кислоту. Соблюдайте осторожность при выполнении данной операции!
5. Оставьте пробу на 5 мин. для полного протекания реакции.
6. Проведите визуальное колориметрирование пробы. Для этого мерную склянку поместите на белое поле контрольной шкалы и, освещая склянку рассеянным белым светом достаточной интенсивности, определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение концентрации ортофосфатов в мг/л.
При получении результата анализа учтите разбавление пробы чистой водой, введя поправочный коэффициент (например, при разбавлении пробы в 4 раза, т.е. при отборе 5 мл анализируемой воды, полученное по шкале значение концентрации умножьте на 4).
Для более точного определения концентрации ортофосфатов оптическая плотность пробы может быть измерена с помощью фотоколориметра. В этом случае для получения результата анализа следует воспользоваться предварительно построенной градуировочной характеристикой, которая линейна в диапазоне 0,01–0,4 мг/л.
В. Дополнительные операции при определении ортофосфатов в загрязненных поверхностных и сточных водах
При анализе сточных вод выполняются операции, позволяющие устранить мешающее влияние силикатов, соединений железа (III), сульфидов и сероводорода, а также танина.
129

Для этого выполните следующие операции:
1)определите универсальной индикаторной бумажкой рН анализируемой воды. При наличии сильнощелочной среды пробу необходимо нейтрализовать раствором серной кислоты до значений рН 4–8;
2)если в анализируемой воде ожидается присутствие силикатов (более 50 мг/л) и соединений железа (III) (более 1 мг/л), разбавьте пробу перед анализом либо отберите 5 мл воды и доведите объем пробы до 20 мл чистой водой;
3)если в анализируемой воде ожидается присутствие сульфидов и сероводорода (более 3 мг/л), приготовьте разбавленный (слегка розовый) раствор перманганата калия и добавьте несколько капель его в пробу. При этом проба должна приобрести слабую розовую окраску (при значительной окраске раствора пробу можно разбавить анализируемой водой);
4)если в анализируемой воде ожидается присутствие хроматов (более 3 мг/л), измените порядок прибавления растворов: первым прибавьте
кпробе раствор восстановителя, а затем – раствор для связывания нитритов и раствор молибдата;
5)если в анализируемой воде ожидается присутствие танина, его можно удалить фильтрованием через колонку с активированным углем.
С. Определение гидролизующихся полифосфатов и эфиров фосфорной кислоты
1. Пробу анализируемой воды объемом 50 мл (может быть отобрана с использованием мерной колбы или цилиндра) поместите в коническую колбу.
2. Добавьте к пробе шприцем-дозатором 1 мл раствора серной кислоты (10%) и несколько кипелок.
3. Присоедините к колбе обратный холодильник, как показано на рисунке. Поместите колбу на электро-
130
