
- •I. Основні поняття і закони хімії
- •II. Будова атома та періодична система д.І.Менделєєва
- •Ііі. Хімічний зв'язок та будова молекул
- •IV. Розчини. Кількісний склад розчинів
- •V. Теорія електролітичної дисоціації. Рівновага у розчинах малорозчинних сполук. Сучасні теорії кислот та основ
- •Vі. Водневий показник. Гідроліз солей
- •VII. Окиснювально-відновні реакції
- •Vііі. Элементи хімічної термодинаміки. Хімічна кінетика. Хімічна рівновага
- •Тестове завдання 11
- •Тестове завдання 12
- •Тестове завдання 13
- •Тестове завдання 14
- •Тестове завдання 15
- •IX. Елементи електрохімії. Гальванічний елемент. Електроліз
- •Х. Комплексні сполуки
- •Рецензія
- •Рецензія
Vііі. Элементи хімічної термодинаміки. Хімічна кінетика. Хімічна рівновага
ТЕСТОВЕ ЗАВДАННЯ 1
Доповніть
Різниця сум ентальпій утворення продуктів реакції і сум ентальпій утворення початкових речовин з урахуванням стехіометричних коефіцієнтів в рівнянні хімічної реакції при р = const, називається .
Теплота не може переходити сама собою від менш нагрітого тіла до …
Тепловий ефект процесу залежить тільки від вигляду і стану початкових речовин і кінцевих продуктів, але не залежить від шляху переходу .
Встановіть відповідність
|
Впливаючий чинник |
Зсув рівноваги |
|
1) підвищення тиску 2) зниження температури 3) зниження концентрації
|
а) у бік початкових речовин б) у бік меншого об’єму в) у бік екзотермічної реакції
|
Виберіть правильну відповідь
Ентальпія утворення карбонату магнію дорівнює, якщо при його розкладанні виділяється 100,9 кДж тепла (ΔH°(MgO)= -601,5 кДж/моль, ΔH°(СО2)= -393,5 кДж/моль). 1) -894,1 кДж/моль 2) -1095,9 кДж/моль 3) -208,0 кДж/моль 4) 308,9 кДж/моль.
Енергія Гібса (ΔG°) реакції дорівнює
CH4(г) + 2O2(г) = CO2(г) + 2H2O(г); ΔH°= -802,2 кДж
(S°(CO2) = 213,66 Дж/моль•K; S°(H2O)= 188,72 Дж/моль•K; S°(CH4) = 186,27 Дж/моль•K; S°(O2)= 205,04 Дж/моль•K) 1) -800,6 кДж 2) -400,3 кДж 3) 800,6 кДж 4) 400,3 кДж.
Швидкість прямої реакції Н2(г) + СI2(г) ↔ 2HСI(г) при підвищенні тиску в 2 рази зросте 1) у 2 рази 2) у 8 разів 3) у 4 рази 4) у 12 разів.
Температурний коефіцієнт швидкості реакції дорівнює, якщо при підвищенні температури на 40° швидкість реакції збільшилася в 16 разів
1) 8 2) 4 3) 2 4) 3.
Константа рівноваги реакції CO2(г) + CаO(кр) ↔ CaCO3(кр)
Кр = [CO2] [CаO] / [CaCO3] 2) Кр = [CO2] / [CaCO3]
Кр = 1/[CO2] 4) Кр = [CаO]/ [CaCO3].
Рівновага реакції 2ZnS(кр)+ 3O2(г) ↔ 2ZnO(кр) + 2SO2(кр), ΔH < 0 зміститься вліво при:
1) збільшенні концентрації кисню;
2) додатковому введенні ZnO;
3) підвищенні температури;
4) підвищенні тиску.
ТЕСТОВЕ ЗАВДАННЯ 2
Доповніть
Термодинамічна функція, яка характеризує міру впорядкованості системи або міру безладу, називається…..
Наука про швидкості і механізми хімічних реакцій, закони, яким підкоряється розвиток хімічної реакції в часі, називається ….
Обмежена частина простору, що включає які-небудь речовини, називається …..
Встановіть відповідність
|
Закони та правила |
Визначення |
|
1) Закон Геса 2) Закон діючих мас (Гульдберг та Вааге) 3) Правило Вант-Гофа
|
а) при постійній температурі швидкість хімічної реакції прямо пропорціональна добутку молярних концентрацій реагуючих речовин у ступені їх стехіометричних коефіцієнтів б) зміна ентальпії при переході від початкових речовин до продуктів реакції залежить тільки від стану початкових та вихідних речовин і не залежить від шляху переходу, тобто числа і послідовності проміжних стадій в) підвищення температури реакційної суміші на 10ºС призводить до підвищення швидкості хімічної реакції частіше всього в 2-4 рази та дуже рідко у 5-7 разів
|
Виберіть правильну відповідь
Тепловий ефект (ΔH°) реакції 2Mg(кр) + CO2(г)= 2MgO(кр) + С(графит) дорівнює (ΔH°(CO2) = -393,5 кДж/моль; ΔH°(MgO) = -601,8 кДж/моль)
1) 810,1 кДж 2) 405,1 кДж 3) -810,1 кДж 4) -405,1 кДж.
Енергія Гібса (ΔG°) реакції дорівнює CO2(г) + 2SO2(г) = CS2(г) + 3O2(г); ΔH°= 1104 кДж (S°(CO2)= 213,66 Дж/моль•K; S°(SO2)= 248,07 Дж/моль•K;
S°(CS2)= 237,77 Дж/моль•K; S°(O2) = 205,04 Дж/моль•K) 1) -530,5 кДж 2) -1061 кДж 3) 530,5 кДж 4) 1061 кДж.
Швидкість прямої реакції 2Н2(г) + О2(г) ↔ 2H2О(г) при підвищенні тиску в 2 рази зросте 1) у 2 рази 2) у 8 разів 3) у 4 рази 4) у 12 разів.
Швидкість реакції зросте в ... разів, якщо температурний коефіцієнт швидкості реакції рівний 2, а температура зросла на 20°С. 1) 4 2) 8 3) 16 4) 32.
Константа рівноваги реакції 2CO (г) + O2 (г) ↔ 2CO2(г) 1) Кр = [CО2]2/[CO]2•[O2] 2) Кр = [CO2] / [CO] 3) Кр = 1/[CO2] 4) Кр = [CO] / [CO2].
Рівновага реакції CO2(г)+ CаO(кр) ↔ CaCO3(кр), ΔH< 0 зміститься вліво при 1) підвищенні тиску; 2) підвищенні концентрації CO2 3) додатковому введенні CaCO3; 4) підвищенні температури.
ТЕСТОВЕ ЗАВДАННЯ 3
Доповніть
Зміна ентальпії при ізобарному переході певного числа молей початкових речовин у відповідне число молей продуктів реакції, виражене в одиницях теплової енергії - джоулях (або калоріях), називається…
Зміна внутрішньої енергії системи дорівнює різниці між кількістю теплоти, одержаною системою з середовища, і кількістю роботи, проведеною системою над середовищем, зокрема роботою розширення – це формулювання …….
Обмежена частина простору, що включає які-небудь речовини, називається ….. Все, що не входить в …, називається зовнішнім середовищем.
Встановіть відповідність
|
Шлях процесу |
Постійний параметр стану |
|
1) ізобарно-ізотермічний 2) ізохорно-ізотермічний 3) адіабатний
|
а) об’єм та температура б) відсутній обмін теплотою в) тиск та температура
|
Виберіть правильну відповідь
Ентальпія утворення N2O(г) дорівнює, якщо термодинамічне рівняння реакції C(графіт)+ 2N2O(г) = CO2(г)+ 2N2(г); ΔH° = -557,5 кДж (ΔH°(CO2) = -393,5 кДж/моль) 1) -164 кДж/моль 2) 82 кДж/моль 3) -82 кДж/моль 4) 164 кДж/моль.
Температура, при якій наступить рівновага в системі, дорівнює 4HCl(г) + O2(г) ↔ 2H2O(г) + 2Cl2(г); ΔH° = -114,42 кДж; (S°(Cl2)= 222,98 Дж/моль•K; S°(H2O) = 188,72 Дж/моль•K; S°(HCl) = 186,79 Дж/моль•K; S°(O2) = 205,04 Дж/моль•K) 1) 688,35 K 2) 700,00 K 3) 888,35 K 4) 900,00 K.
Швидкість реакції CO(г) + Сl2(г) ↔ CОCl2(г) при підвищенні концентрації оксиду вуглецю(II) в 2 рази збільшиться 1) у 2 рази; 2) у 4 рази; 3) у 6 разів; 4) у 8 разів.
Температурний коефіцієнт швидкості реакції дорівнює, якщо при підвищенні температури на 30° швидкості реакції збільшилася в 27 разів 1) 8 2) 4 3) 2 4) 3.
Константа рівноваги реакції 2NO(г) + O2 (г) ↔ 2NO2(г) 1) Кр = [NO2]2/[NO]2 • [O2] 2) Кр = [NO2] / [NO] 3) Кр = 1/[NO2]; 4) Кр = [NO]/ [NO2].
Реакція, для якої підвищення тиску викличе зсув рівноваги управо це ...
2NF3(г) + 3H2(г) ↔ 6HF(г)+ N2(г); 2) CH4(г)+ 4S(т) ↔ CS2(г)+ 2H2S(г); 3) 2NO2(г)+ Cl2(г) ↔ 2NOCl(г); 4) 2O3(г) ↔ 3O2(г).
ТЕСТОВЕ ЗАВДАННЯ 4
Доповніть
Все, що оточує систему, називається ….
Процес, який йде з виділенням теплоти називається ….
Фізичні та хімічні властивості системи, які характеризують її стан, називаються… До базових … відносяться: ……….
Виберіть правильну відповідь
|
Мірою термодинамічної вірогідності протікання хімічної реакції є
|
а) ентальпія реакції б) ентропія реакції в) енергія Гібса г) константа хімічної рівноваги |
Теплота згорання метану ΔН°згор.(СН4) = -890 кДж/моль. Теплотворна здатність метану (у кДж/м3) дорівнює 1) 89000 2) 39732 3) 890,0 4) 3973,2.
Енергія Гібса (ΔG°) реакції дорівнює NH3(г) + HCl(г) = NH4Cl(кр); ΔH°= -175,97 кДж; (S°(NH4Clкр)= 95,81 Дж/моль•K; S°(NH3(г))= 192,66 Дж/моль•K; S°(HCl(г))= 186,79 Дж/моль•K) 1) 75,97 кДж; 2) -87,9 кДж; 3) 87,9 кДж; 4) -91,45 кДж.
Швидкість прямої реакції CO2(г)+ 2SO2(г) ↔ CS2(г)+ 4O2(г) при пониженні тиску в 3 рази зменшиться 1) у 3 рази; 2) у 6 разів; 3) у 9 разів; 4) у 27 разів.
Температуру газоподібної суміші слід підвищити для збільшення швидкості реакції в 81 раз (температурний коефіцієнт рівний 3) на 1) 20°; 2) 30°; 3) 40°; 4) 50°.
Константа рівноваги реакції 2SO2(г) + O2 (г) ↔ 2SO3(г) 1) Кр = [SO3?/ [SO2]І[O2]; 2) Кр = [SO3] / SO2]; 3) Кр = 1/[SO2]; 4) Кр = [SO2]/ [SO3].
Рівновага реакції CO2(г) + MgO(кр) ↔ MgCO3(кр), ΔH< 0 зміститься вліво при 1) підвищенні тиску; 2) підвищенні концентрації CO2; 3) додатковому введенні MgCO3; 4) підвищенні температури.
ТЕСТОВЕ ЗАВДАННЯ 5
Доповніть
Системи, усередині яких немає поверхонь розділу, що відокремлюють одну від одної частини системи, які розрізняються за властивостями, називаються ….
Процес, що йде з поглинанням теплоти, називається ….
Зміна концентрації реагуючих речовин за одиницю часу в одиниці об'єму або число елементарних актів взаємодії за одиницю часу в одиниці об'єму, називається ….
Встановіть відповідність
|
Закони та правила |
Математичні вирази цих законів та правил |
|
1) закон діючих мас 2) закон Геса 3) правило Вант-Гофа
|
|
Виберіть правильну відповідь
При спалюванні 3,04 г магнію виділилося 76,45 кДж теплоти. Теплота утворення MgO (ΔHутв., кДж/моль) дорівнює 1) 232,4 2) -611,0 3) -232,4 4) 611,0.
Температура, при якій наступить рівновага в системі, дорівнює PCl5(г) ↔ PCl3(г)+ Cl2(г); ΔH° = 92,59 кДж; (S°(Cl2) = 222,98 Дж/моль•K; S°(PCl5) = 364,47 Дж/моль•K; S°(PCl3) = 311,71 Дж/моль•K) 1) 688,3 K; 2) 543,9 K; 3) 888,5 K; 4) 900,0 K.
Швидкість прямої реакції Н2(г) + Br2(г) ↔ 2HBr(г) при підвищенні тиску в 3 рази зросте 1) у 9 разів; 2) у 12 разів; 3) у 6 разів; 4) у 3 рази.
Температурний коефіцієнт швидкості реакції дорівнює, якщо при підвищенні температури на 30° швидкість реакції збільшилася в 27 разів 1) 8; 2) 4; 3) 2; 4) 3.
Константа рівноваги реакції 2CO (г) + Cl2 (г) ↔ 2COCl2(г) 1) Кр = [COCl2]2 / [CO]2 • [Cl2]; 2) Кр = [CO] / [Cl2]; 3) Кр = 1 / [COCl2]; 4) Кр = [CO] / [COCl2].
Реакція, в якій збільшення об'єму системи не викличе зсуву рівноваги, - це 1) 2SO2(г)+ O2(г) ↔ 2SO3(г); 2) N2O4(г) ↔ 2NO2(г); 3) H2(г)+ Сl2(г) ↔ 2HCl(г); 4) N2(г)+ 3H2(г) ↔ 2NH3(г).
ТЕСТОВЕ ЗАВДАННЯ 6
Доповніть
Системи, в яких не існують поверхні розділу, які відокремлюють один від одної частини системи, що розрізняються за своїми властивостями, називаються …….
Процес переходу від одного рівноважного стану до іншого рівноважного стану називається ….
Така змінна характеристика системи, яка не залежить від передісторії системи і зміна якої під час переходу системи з одного стану в інший не залежить від того, яким чином був проведений цей перехід, а залежить тільки від стану системи, називається …
Встановіть відповідність
|
Начала термодинаміки |
Формулювання |
|
1) перше 2) друге 3) третє
|
а) будь-яка речовина має додатню ентропію, але при температурі абсолютного нуля ентропія може дорівнювати нулю і вона дійсно дорівнює нулю для чистих та правильно побудованих кристалічних речовин б) вічний двигун першого роду неможливий в) теплота не може переходити сама собою від менш нагрітого тіла до більш нагрітого
|
Виберіть правильну відповідь
Термохімічне рівняння реакції горіння фосфору 4Р(тв) + 502(г) = 2Р205(тв) + 3010 кДж. Кількість теплоти (у кДж), яка виділиться при згоранні 62 г фосфору, дорівнює 1) 752,5 2) 1505 3) 2257,5 4) 683,4.
Температура, при якій наступить рівновага в системі, дорівнює 2НCl(г) ↔ Н2(г)+ Cl2(г); ΔH° = -184,62 кДж (S°(Cl2) = 222,98 Дж/моль•K; S°(Н2) = 130,52 Дж/моль•K; S°(НCl) = 186,79 Дж/моль•K). 1) 6883 K; 2) 5439 K; 3) 8885 K; 4) 9194 K.
Швидкість прямої реакції CO2(г)+C(графіт) ↔ 2CO(г) при підвищенні тиску в 4 рази зросте 1) у 4 рази; 2) у 8 разів; 3) у 16 разів; 4) у 32 рази.
Температурний коефіцієнт швидкості реакції дорівнює, якщо при підвищенні температури на 50° швидкість реакції збільшилася в 32 рази 1) 5; 2) 4; 3) 2; 4) 3.
Константа рівноваги реакції 4HCl(г)+ O2(г) ↔ 2H2O(г)+ 2Сl2(г) дорівнює, якщо рівноважні концентрації (моль/дм3) рівні: [Cl2] = 0,04; [H2O] = 0,016 [HCl] = 0,08; [O2] = 0,1. 1) 0,1; 2) 0,04; 3) 0,2; 4) 0,3.
Набір реакцій, в яких збільшення об'єму системи не викличе зсуву рівноваги, - це
1) 2SO2(г)+ O2(г) ↔ 2SO3(г) H2(г)+ Сl2(г) ↔2HCl(г);
2) N2O4(г) ↔2NО2 N2(г)+ 3H2(г) ↔2NH3(г);
3) PCl5(г) ↔PCl3(г)+ Cl2(г) 2CO(г)+O2(г)↔2CO2(г);
4) H2(г)+ I2(г) ↔2HI(г)
N2(г)+ O2(г) ↔2NO(г).
ТЕСТОВЕ ЗАВДАННЯ 7
Доповніть
Система, яка позбавлена можливості обміну речовиною або енергією із зовнішнім середовищем і має постійний об'єм, називається ….
Підвищення температури реакційної суміші на 10° призводить до збільшення швидкості хімічної реакції частіше всього в ….. рази і рідше в ….. разів – це правило …….
У ізольованій системі самовільно можуть протікати тільки такі процеси, які ведуть до збільшення безладу системи, тобто до зростання ентропії це формулювання ……….
Встановіть відповідність
|
Зміна ΔG |
Можливість або неможливість протікання процесу |
|
1) більше нуля 2) дорівнює нулю 3) менше нуля |
а) процес термодинамічно дозволений б) процес термодинамічно заборонений в) в системі наступив стан рівноваги |
Виберіть правильну відповідь
Температура, при якій наступить рівновага в системі, дорівнює CO2(г) + 2SO2(г) ↔ CS2(г)+ 3O2(г); ΔH°= 1104 кДж (S°(CO2) = 213,66 Дж/моль•K; S°(SO2) = 248,07 Дж/моль•K; S°(CS2) = 237,77 Дж/моль•K; S°(O2) = 205,04 Дж/моль•K) 1) 5305 К; 2) 7715 К; 3) 6305 К; 4) 8061 К.
Швидкість прямої реакції Н2(г) + I2(г) ↔ 2HI(г) при підвищенні тиску в 5 разів зросте 1) у 5 разів; 2) у 10 разів; 3) у 25 разів; 4) у 125 разів.
Температурний коефіцієнт швидкості реакції дорівнює, якщо при підвищенні температури на 30° швидкість реакції збільшилася в 64 рази 1) 5; 2) 4; 3) 2; 4) 3.
Константа рівноваги для реакції 2NO + O2 ↔ 2NO2 дорівнює, якщо в стані рівноваги концентрації речовин були (моль/дм3): [NO] = 0,56; [O2] = 0,28; [NO2] = 0,44. 1) 2,2; 2) 5,6; 3) 2,8; 4) 4,4.
Реакція, в якій збільшення об'єму системи не викличе зсуву рівноваги, - це 1) PCl5(г) ↔ PCl3(г)+ Cl2(г); 2) H2(г)+ I2(г) ↔ 2HI(г); 3) 2CO(г)+O2(г) ↔ 2CO2(г); 4) 2NО(г)+ O2(г) ↔ 2NO2 (г).
Дано термохімічне рівняння Si02(т) + 2Mg(т) = 2MgO(т) + Si(т); ΔHº = -372 кДж. Теплота утворення оксиду магнію ΔHºутв.(MgO) = -611 кДж/моль. Теплота утворення оксиду кремнію(IV) (ΔHºутв.(Si02), у кДж/моль) дорівнює 1) -239 2) 239 3) -850 4) 850.
ТЕСТОВЕ ЗАВДАННЯ 8
Доповніть
Cистема, між окремими частинами якої немає межі розділу називається ………..
Величина, пропорційна логарифму термодинамічної вірогідності (W) стану системи: S = k•lnW називається ……..
У ізольованій системі самовільно можуть протікати тільки такі процеси, які ведуть до збільшення неврегульованості системи, тобто до зростання ентропії – це визначення ……….
Встановіть відповідність
|
Зміна ΔG |
Можливість або неможливість протікання процесу |
|
1) більше нуля 2) дорівнює нулю 3) менше нуля |
а) процес термодинамічно дозволений б) процес термодинамічно заборонений в) в системі наступив стан рівноваги |
Виберіть правильну відповідь
Ентальпія утворення газоподібного оксиду сульфуру(IV) дорівнює, якщо при взаємодії 1 моля оксигену і 1 моль сульфуру виділилося 296,9 кДж тепла 1) 210,6 кДж/моль; 2) 296,9 кДж/моль; 3) -210,6 кДж/моль; 4) -296,9 кДж/моль.
Енергія Гібса (ΔG°) реакції NH3(г) + HCl(г) = NH4Cl(кр); ΔH°= -175,97 кДж (S°(NH4Clкр) = 95,81 Дж/моль•K; S°(NH3(г)) = 192,66 Дж/моль•K; S°(HCl(г)) = 186,79 Дж/моль•K) дорівнює 1) 75,97 кДж; 2) -87,9 кДж; 3) 87,9 кДж; 4) -91,45 кДж.
Швидкість прямої реакції 2H2(г) + O2(г) ↔ 2H2O(г) зміниться, якщо збільшити тиск системи в 2 рази 1) у 8 разів; 2) у 6 разів; 3) у 27 разів; 4) у 9 разів.
Термохімічне рівняння реакції Fe(т) + S(т) = FеS(т) + 95,4 кДж. Кількість теплоти (у кДж), яка виділиться при окисненні 11,2 г заліза, дорівнює 1) 9,5 2) 19,1 3) 38,2 4) 57,3
Константа рівноваги реакції C(графіт) + Н2O(г) ↔ CO(г) + H2(г) 1) Кр = [CO][H2 ] / [Н2O]; 2) Кр = [H2O] / [CO][H2]; 3) Кр = 1 / [CO2]; 4) Кр = [H2O] / [C][H2].
Напрям зсуву рівноваги реакції: СО2(г)+ C(графіт) ↔ 2СО(г) при підвищенні тиску 1) не зміститься; 2) у бік кінцевих продуктів; 3) у бік початкових речовин.
ТЕСТОВЕ ЗАВДАННЯ 9
Доповніть
Теплові ефекти реакцій, що протікають в прямому і зворотному напрямках, рівні по величині та протилежні по знаку - це закон …….
Швидкістю хімічної реакції називають ………………. (у випадку гомогенної реакції) або ………………………. (у випадку гетерогенної реакції).
Співвідношення
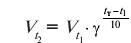 виражає …………
виражає …………
Встановіть відповідність
|
Зміна ΔG |
Можливість або неможливість протікання процесу |
|
1) більше нуля 2) дорівнює нулю 3) менше нуля |
а) процес термодинамічно дозволений б) процес термодинамічно заборонений в) в системі наступила рівновага |
Виберіть правильну відповідь
Температуру газоподібної суміші слід підвищити для збільшення швидкості реакції в 32 рази (температурний коефіцієнт рівний 2) на 1) 20°; 2) 30°; 3) 40°; 4) 50°.
Константа рівноваги реакції N2(г) + 3H2(г) ↔ 2NН3(г) 1) Кр = [H2]3/[NH3]2; 2) Кр = [N2][H2]3/[NH3]2; 3) Кр = [NH3]2/ [N2][H2]3; 4) Кр = [NH3]2/ [N2].
Напрям зсуву рівновага реакції: 2SО2(г) + О2(г) ↔ 2SО3(г) при підвищенні тиску 1) не зміститься; 2) у бік кінцевих продуктів; 3) у бік початкових речовин.
Ентальпія утворення газоподібного сірководню дорівнює, якщо при взаємодії 1 моля гідрогену та 1 моля сульфуру виділилося 20,6 кДж тепла 1) -10,3 кДж/моль; 2) 10,3 кДж/моль; 3) -20,6 кДж/моль; 4) 20,6 кДж/моль.
Енергія Гібса (ΔG°) реакції Fe2O3(кр)+ 3H2(г)= 2Fe(кр) + 3H2O (г); АH°= +96,61 кДж (S°( Fe2O3(кр))= 87,45 Дж/моль•K; S°(H2(г)) = 130,52 Дж/моль•K; S°( H2O (г))= 188,72 Дж/моль•K; S°( Fe(кр))= 27,15 Дж/моль•K ) дорівнює 1) +55,28 кДж; 2) -87,45 кДж; 3) +27,15 кДж; 4) +188,72 кДж.
Утворення енергії в живому організмі протікає відповідно термохімічному рівнянню реакції окиснення глюкози C6H1206 + 602 = 6С02 + 6Н20 + 2815,8 кДж. Кількість теплоти (у кДж), що виділяється при окисненні 120 г глюкози, дорівнює 1) 2815,8 кДж; 3) 1877,2 кДж; 2) 938,6 кДж; 4) 4693,0 кДж.
ТЕСТОВЕ ЗАВДАННЯ 10
Доповніть
Кількість речовини, що вступає в реакцію або утворюється в результаті реакції за одиницю часу на одиницю об'єму (для гомогенної системи) або на одиницю поверхні розділу фаз (для гетерогенної системи), називається …….
Теплові ефекти, визначені за стандартних умов, називаються …….. та позначаються ……..
Сума показників степенів концентрацій у математичному виразі закону діяння мас визначає ……..
Виберіть невірне твердження Тепловий ефект реакції……… 1) залежить від числа проміжних стадій реакції 2) визначається фазовим станом продуктів реакції 3) визначається станом вихідних речовин 4) залежить від напрямку реакції
Встановіть відповідність
|
Параметр стану |
Характеристика |
|
а) загальний запас енергії в системі б) тепловміст системи в) міра безладу системи |
Виберіть правильну відповідь
Ентальпія утворення газоподібного етилену дорівнює, якщо при взаємодії 2 молей гідрогену та 2 молей карбону поглинулося 52,3 кДж тепла 1) -26,15 кДж/моль; 2) 52,3 кДж/моль; 3) -52,3 кДж/моль; 4) 26,15 кДж/моль.
Енергія Гібса (ΔG°) реакції О2(г) + 2CO(г) = 2CO2(г); ΔH°= -566 кДж (S°(CO2) = 213,66 Дж/моль•K; S°(O2(г)) = 205,04 Дж/моль•K; S°(CO(г))= 197,55 Дж/моль•K) дорівнює 1) 197,55 кДж; 2) -514,5 кДж; 3) -205,04 кДж; 4) -213,66 кДж.
Швидкість реакції збільшиться в ….. раз, якщо початкова концентрація початкових речовин в системі CO + Cl2 ↔ COCl2 дорівнювала (моль/дм3): [CO] = 0,3; [Cl2] = 0,2, а через деякий час концентрації [CO] підвищили до 0,6, а [Cl2] - до 1,2. 1) 6; 2) 8; 3) 12; 4) 10.
Температуру газоподібної суміші слід підвищити для збільшення швидкості реакції в 16 разів (температурний коефіцієнт рівний 2) на 1) 20°; 2) 30°; 3) 40°; 4) 50°.
Константа рівноваги реакції C(графіт) + Н2O(г) ↔ CO(г) + H2(г) 1) Кр = [CO][H2 ] / [Н2O]; 2) Кр = [H2O] / [CO][H2]; 3) Кр = 1/[CO2]; 4) Кр = [H2O] / [C][H2].
