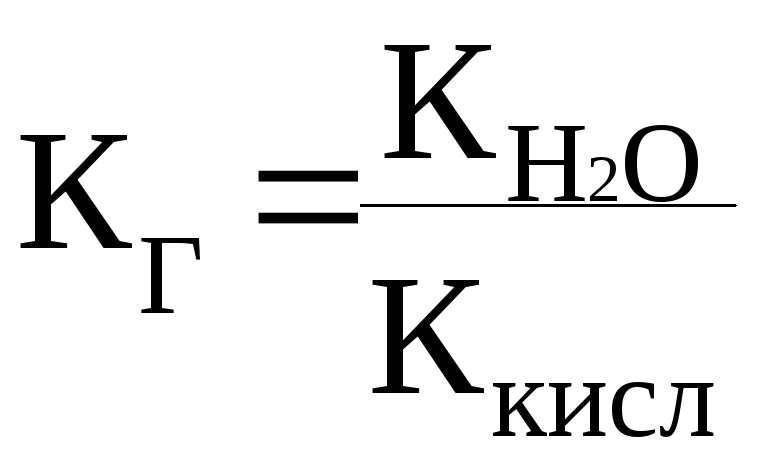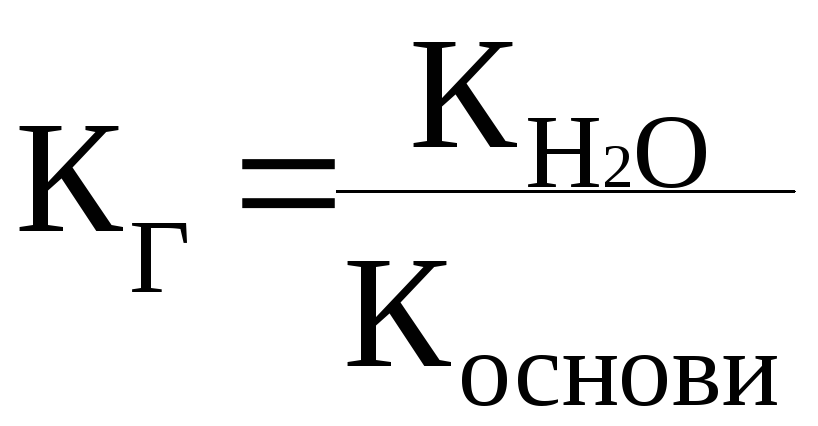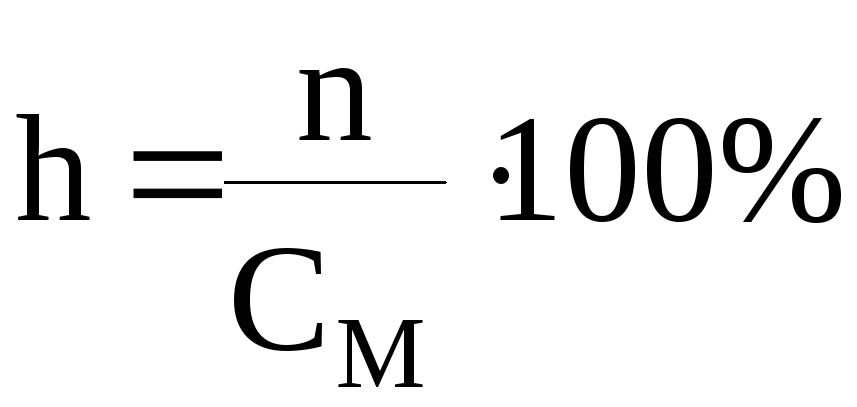- •I. Основні поняття і закони хімії
- •II. Будова атома та періодична система д.І.Менделєєва
- •Ііі. Хімічний зв'язок та будова молекул
- •IV. Розчини. Кількісний склад розчинів
- •V. Теорія електролітичної дисоціації. Рівновага у розчинах малорозчинних сполук. Сучасні теорії кислот та основ
- •Vі. Водневий показник. Гідроліз солей
- •VII. Окиснювально-відновні реакції
- •Vііі. Элементи хімічної термодинаміки. Хімічна кінетика. Хімічна рівновага
- •Тестове завдання 11
- •Тестове завдання 12
- •Тестове завдання 13
- •Тестове завдання 14
- •Тестове завдання 15
- •IX. Елементи електрохімії. Гальванічний елемент. Електроліз
- •Х. Комплексні сполуки
- •Рецензія
- •Рецензія
Vі. Водневий показник. Гідроліз солей
ТЕСТОВЕ ЗАВДАННЯ 1
Доповніть
Від'ємний десятковий логарифм концентрації водневих іонів називається…………….
КН2О = [Н+] [ОН-]; Величина КН2О називається……..…….
Встановіть відповідність
|
Значення водневого показника |
Характер середовища |
|
а) кисле б) лужне в) нейтральне |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить10-3 моль/дм3 1) 2; 2) 3; 3) 11; 4) 5.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 10-5 моль/дм3 1) 5; 2) 8; 3) 7; 4) 9.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 4 1) 10-2; 2) 10-3; 3) 10-4; 4) 10-5.
Концентрація (моль/дм3) іонів ОН- дорівнює, якщо рН= 5 1) 10-2; 2) 10-13; 3) 10-5; 4) 10-9.
Водневий показник (рН) розчину сильної одноосновної кислоти молярної концентрації 0,001моль/дм3 дорівнює 1) 3; 2) 4; 3) 2; 4) 1.
Лакмус забарвлює в червоний колір тільки другий розчин солі з набору: 1) хлорид цинку(II), хлорид натрію; 2) сульфат калію, сульфат алюмінію; 3) сульфат берилію, сульфат натрію; 4) сульфат цезію, сульфат натрію.
Молекулярне та іонно-молекулярне рівняння гідролізу солі СоCl2: 1) СоCl2 + 1) 2HOH ↔ 2HCl + Со(OH)2 Сl- + HOH ↔ HCl + OH-; 2) СоCl2 + HOH ↔ HCl + СоOHCl Со2+ + HOH ↔ H+ + СоOH+; 3) СоCl2 + HOH ↔ 2СоOH + HCl 2Со2+ + Cl- + 2HOH ↔ 2Со+ + 2OH- + HCl; 4) СоCl2 + HOH ↔ СоHCl + HCl Cl- + HOH ↔ HCl + HO-.
ТЕСТОВЕ ЗАВДАННЯ 2
Доповніть
Від'ємний десятковий логарифм концентрації гідроксид-іонів називається ….
Результат поляризаційної взаємодії іонів солі з їх гідратною оболонкою називають……..
Встановіть відповідність
|
Сіль |
Тип гідролізу |
|
а) оборотний б) необоротний |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 10-5 моль/дм3 1) 2; 2) 4; 3) 9; 4) 5.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 10-4 моль/дм3 1) 5; 2) 4; 3) 10; 4) 9.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 2 1) 10-2; 2) 10-3; 3) 10-4; 4) 10-5
Концентрація (моль/дм3) іонів ОН- дорівнює, якщо рН = 4 1) 10-2; 2) 10-10; 3) 10-5; 4) 10-9.
Водневий показник (рН) водного розчину гідроксиду калію концентрацією 0,0001 моль/дм3 (дисоціацію вважати повною) дорівнює 1) 10; 2) 1; 3) 12; 4) 14.
Лакмус змінює забарвлення від червоного в розчині першої солі до фіолетового в розчині другої солі з набору . 1) ZnSO4, K3PO4; 2) AlCl3, KCl; 3) K2S, K2SO4; 4) NaNO3, NaCl.
Молекулярне і іонно-молекулярне рівняння гідролізу соли Na2CO3 1) Na2CO3 + HOH ↔ NaHCO3 + NаOH CO32- + HOH ↔ HCO3- +ОН-; 2) Na2CO3 + 2HOH ↔ 2NaOH + H2CO3 2Na+ + CO32- + 2HOH ↔ 2Na+ + 2OH- + H2CO3; 3)Na2CO3 + HOH ↔ NaHCO3 + H2CO3 CO32- + HOH ↔ H2CO3 + HCO3-; Na2CO3 + HOH ↔ NaHCO3 + NaH2CO3 Na+ + HOH ↔ H+ + OH-.
ТЕСТОВЕ ЗАВДАННЯ 3
Доповніть
Добуток молярних концентрацій іонів водню і гідроксид-іонов при незмінній температурі, називається ……..
Продукти, що виходять в результаті сольволізу, називаються ……..
Встановіть відповідність
|
Сіль |
Тип гідролізу |
|
1) ціанід амонію 2) сульфід амонію |
а) оборотний б) необоротний |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ 2,5•10-5 моль/дм3 1) 4,6; 2) 3,7; 3) 1,9; 4) 5,8.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- 10-5 моль/дм3 1) 5; 2) 8; 3) 7; 4) 9.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 3,2 1) 4,35•10-4; 2) 1,56•10-3; 3) 6,31•10-4; 4) 5,72•10-5
Концентрація (моль/дм3) іонів ОН- дорівнює, якщо рН = 3,7 1) 3,74•10-4; 2) 5,01•10-11; 3) 4,01•10-11; 4) 5,01•10-9.
Водневий показник (рН) розчину сильної одноосновної кислоти молярної концентрації 0,1 моль/дм3 дорівнює 1) 3; 2) 4; 3) 2; 4) 1.
Лакмус забарвлює в червоний колір тільки перший розчин солі з набору: 1) хлорид цинку(II), хлорид натрію; 2) сульфат калію, сульфат алюмінію; 3) сульфат берилію, сульфат натрію; 4) сульфат цезію, сульфат натрію.
Молекулярне та іонно-молекулярне рівняння гідролізу солі FeCl2 1) FeCl2 + 2HOH ↔ 2HCl + Fe(OH)2 Cl- + HOH ↔ HCl + OH-; 2) FeCl2 + HOH ↔ HCl + FeOHCl Fe2+ + HOH ↔ H+ + FeOH+; 3) FeCl2 + HOH ↔ 2FeOH + HCl 2Fe2+ + Cl- + 2HOH ↔ 2Fe+ + 2OH- + HCl; 4) FeCl2 + HOH ↔ FeHCl + HCl Cl- + HOH ↔ HCl + HO-.
ТЕСТОВЕ ЗАВДАННЯ 4
Доповніть
Спеціальні речовини, за допомогою яких можна приблизно оцінити реакцію розчину, називаються …………
Розчини, в яких молярні концентрації іонів водню і гідроксид-іонов однакові, називаються ………….
Встановіть відповідність
|
Сіль |
Тип гідролізу |
|
а) одноступінчатий б) багатоступінчатий |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 3,5•10-3 моль/дм3 1) 1,56; 2) 2,37; 3) 2,46; 4) 3,18.
В результаті проведення реакції Аl(NO3)3 + Na2CO3 + H2O → утворюється осад: 1) карбонату алюмінію; 2) гідроксиду алюмінію; 3) карбонату гідроксоалюмінію; 4) гідрокарбонату алюмінію.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 1,8 1) 0,016; 2) 0,056; 3) 0,031; 4) 0,07.
Концентрація гідроксид-іонів в розчині дорівнює, якщо рН = 8: 1) 5•10-5 моль/дм3; 2) 1•10-8 моль/дм3; 3) 6•10-7 моль/дм3; 4) 1•10-6 моль/дм3.
Водневий показник (рН) водного розчину гідроксиду натрію концентрацією 0,01 моль/дм3 (дисоціацію вважати повною) дорівнює 1) 10; 2) 1; 3) 12; 4) 14.
Лакмус не змінює забарвлення ні від розчину першої солі ні розчину другої солі для такого набору: 1) ZnSO4, K3PO4; 2) AlCl3, KCl; 3) K2S, K2SO4; 4) NaNO3, NaCl.
Молекулярне та іонно-молекулярне рівняння гідролізу солі Zn(NO3)2: 1) Zn(NO3)2 + 2HOH ↔ 2HNO3 + Zn(OH)2 NO3- + HOH ↔ HNO3 + OH-; 2) Zn(NO3)2 + HOH ↔ HNO3 + ZnOHNO3 Zn2+ + HOH ↔ H+ + ZnOH+; 3) Zn(NO3)2 + HOH ↔ 2ZnOH + HNO3 2Zn2+ + NO3 + 2HOH ↔ 2Zn+ + 2OH- + HNO3; Zn(NO3)2 + HOH ↔ ZnHNO3 + HNO3 NO3- + HOH ↔ HNO3 + HO-.
ТЕСТОВЕ ЗАВДАННЯ 5
Доповніть
Розчини, в яких молярна концентрація іонів гідрогену менше гідроксид-іонов, називаються ………..
Взаємодію розчинів двох солей, які взаємно підсилюють гідроліз одна одної, називають………...
Встановіть відповідність
|
Показник |
Формула для обчислення |
|
1) водневий показник 2) гідроксильний показник |
а) рOН = -lg[OH-] б) pH = -lg[H+] |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ складає 3,5•10-5 моль/дм3 1) 1,56; 2) 2,37; 3) 4,46; 4) 3,18.
Водневий показник (рН) 0,01 М розчину гідроксиду натрію дорівнює 1) 12; 2) 2; 3) 4; 4) 8.
Концентрація іонів гідрогену в розчині дорівнює, якщо рН = 4,6 1) 2,5•10-5 моль/дм3; 2) 1,5•10-4 моль/дм3; 3) 1,6•10-5 моль/дм3; 4) 2,5•10-3 моль/дм3.
Концентрація гідроксид-іонів в розчині дорівнює, якщо рН = 5,8: 1) 5,04•10-5 моль/дм3; 2) 1,05•10-8 моль/дм3; 3 6,00•10-9 моль/дм3; 4 1,58•10-6 моль/дм3.
Концентрація іонів ОН- у водному розчині збільшується при гідролізі солі: 1) хлориду хрому(ІІІ); 2) сульфату феруму(ІІІ); 3) сульфіду натрію; 4) сульфату натрію.
Кислотність розчинів солей збільшується в ряду: 1) KCl, Na2CO3; 2) CaCl2, FeCl3; 3) CuSO4, Na2SO4; 4) NaCl, KBr.
Молекулярне і іонно-молекулярне рівняння гідролізу солі К2CO3: 1) К2CO3 + HOH ↔ КHCO3 + КOH CO32- + HOH ↔ HCO3- + OH-; 2) К2CO3 + HOH ↔ КHCO3 + H2CO3 CO32- + HOH ↔ H2CO3 + HCO3-; 3) К2CO3 + HOH ↔ КHCO3 + КOH К+ + HOH ↔ H+ + КOH; 4) К2CO3 + 2HOH ↔ 2КOH + H2CO3 2К+ + CO32- + 2HOH ↔ 2К+ + 2OH- + H2CO3.
ТЕСТОВЕ ЗАВДАННЯ 6
Доповніть
Розчини, в яких молярна концентрація іонів гідрогену більша за гідроксид-іонів, називаються ……….
Реакція обмінної взаємодії речовин з водою називають .…………..
Встановіть відповідність
|
Походження солі |
Характер гідролізу та рН середовища |
|
а) гідролізуються за катіоном. У розчині накопичується надлишок Н+ іонів, внаслідок цього [H+] > [OH-] та рН < 0. Розчин набуває кислої реакції. б) у водних розчинах гідролізу не підлягають. Рівновага практично повністю зміщена ліворуч і розчин не містить помітного надлишку Н+ чи ОН- іонів. Середовище розчину солей такого типу нейтральне (рН=7) в) такі солі найбільш гідролізовані. Гідроліз іде і по катіону і по аніону з утворенням малодисоційованих або малорозчинних сполук. Реакція розчину таких солей близька до нейтральної. г) такі солі гідролізуються за аніоном. Внаслідок гідролізу накопичується деякий надлишок гідроксид-іонів, тому [OH-] > [H+]. Розчини таких солей мають лужну реакцію. |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 10-9 моль/дм3 1) 2; 2) 4; 3) 9; 4) 5.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 10-9 моль/дм3 1) 5; 2) 4; 3) 10; 4) 9.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 5 1) 10-2; 2) 10-3; 3) 10-4; 4) 10-5.
Збільшення концентрації іонів гідрогену у водному розчині відбувається при гідролізі солі: 1) нітриту калію 2) сульфіту натрію 3) нітрату хрому (III) 4) сульфату калію
Водневий показник (рН) водного розчину азотної кислоти концентрацією 0,0001 моль/дм3 (дисоціацію вважати повною) дорівнює: 1) 1; 2) 4; 3) 2; 4) 3.
Лакмус змінює забарвлення, від синього в розчині першої солі до фіолетового в розчині другої солі з набору: 1) ZnSO4, K3PO4; 2) AlCl3, KCl; 3) K2S, K2SO4; 4) NaNO3, NaCl.
Лужність середовища в розчинах солей збільшується в ряду: 1) K3PO4, KCl; 2) Sr(NO3)2, Zn(NO3)2; 3) RbCl, CuCl2; 4) K2HPO4, K3PO4.
ТЕСТОВЕ ЗАВДАННЯ 7
Доповніть
Відношення концентрації гідролізованої солі до її загальної концентрації у розчині називається ……..
Продукти, що виходять в результаті гідролізу, називаються ……….
Встановіть відповідність
|
Сіль |
Іонно-молекулярне рівняння гідролізу |
|
1) фосфат натрію 2) гідрофосфат натрію 3) сульфід натрію 4) гідросульфід натрію
|
а) HS- + H2O ↔ H2S + OH- б) S2- + H2O ↔ HS- + OH- в) PO43- + H2O ↔ HPO42- + OH- г) HPO42- + H2O ↔ H2PO4- + OH- |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ 10-2 моль/дм3 1) 2; 2) 4; 3) 9; 4) 5.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- 10-10 моль/дм3 1) 5; 2) 4; 3) 10; 4) 9.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 3 1) 10-2; 2) 10-3; 3) 10-4; 4) 10-5
Концентрація (моль/дм3) іонів ОН‑ дорівнює, якщо рН = 9 1) 10-2; 2) 10-10; 3) 10-5; 4) 10-9.
Водневий показник (рН) водного розчину азотної кислоти концентрацією 0,01 моль/дм3 (дисоціацію вважати повною) дорівнює 1) 1; 2) 4; 3) 2; 4) 3.
Лакмус змінює забарвлення, від червоного в розчині першої солі до синього в розчині другої солі з набору: 1) ZnSO4, K3PO4; 2) AlCl3, KCl; 3) K2S, K2SO4; 4) NaNO3, NaCl.
Константа дисоціації нітратної кислоти HNO2 Кд = 5,0 • 10-4. Константа гідролизу нітриту натрію дорівнює 1) 2•10-9 2) 2•10-10 3)2•10-11 4) 2•10-12.
ТЕСТОВЕ ЗАВДАННЯ 8
Доповніть
Частка від ділення іонного добутку води на константу дисоціації слабкої кислоти називається ……………
Розчини, в яких молярна концентрація іонів гідрогену менша за концентрацію гідроксид-іонов, називаються ………..
Встановіть відповідність
|
Сіль |
Реакція середовища |
|
а) кисла б) нейтральна в) лужна |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 4,5•10-12 моль/дм3 1) 2,8; 2) 12,5; 3) 9,7; 4) 11,3.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 3,4•10-4 моль/дм3 1) 10,0; 2) 7,9; 3) 10,5; 4) 9,0.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 12,05 1) 7,9•10-12; 2) 8,2•10-13; 3) 8,9•10-13; 4) 9,1•10-12.
Концентрація (моль/дм3) іонів ОН- дорівнює, якщо рН = 10 1) 10-2; 2) 10-10; 3) 10-4; 4) 10-5.
Водневий показник (рН) водного розчину сульфатної кислоти з масовою часткою 0,5 % (ρ = 1 г/см3) дорівнює 1) 1; 2) 4; 3) 2; 4) 3.
Константа дисоціації синільної кислоти HCN Кд = 6,2•10-10. Ступінь гідролізу ціаниду калію в 1М розчині дорівнює 1)1,6•10-5 2) 4•10-4 3)4•10-3 4) 1,6•10-2.
Mолекулярне та іонно-молекулярне рівняння сумісного гідролізу солей Na2S і AlCl3: 1) AlCl3 + 2HOH ↔ 2HCl + Al(OH)3 Cl- + HOH ↔ HCl + OH-; 2) AlCl3 + HOH ↔ 2HCl + AlOHCl Al3+ + HOH ↔ H+ + AlOH2+; 3) Na2S + HOH ↔ 2NaOH + S 2Na+ + S2- + HOH ↔ 2Na+ + 2OH- + NаHS; 4) 2AlCl3 + 3Na2S + 3HOH ↔ 2Al(OH)3 + 3H2S + 6NaCl; 2Al3+ + 3S2- + 3HOH ↔ 2Al(OH)3 + 3H2S.
ТЕСТОВЕ ЗАВДАННЯ 9
Доповніть
Частка від ділення іонного добутку води на константу дисоціації слабкої основи називається …………….
Розчини, в яких молярні концентрації іонів гідрогену та гідроксид-іонов однакові, називаються ………….
Встановіть відповідність
|
Формули |
Визначення |
|
1)
2)
3)
|
а) вираз для знаходження константи гідролізу солі, утвореної сильною кислотою та слабкою основою б) вираз для знаходження константи гідролізу солі, утвореної слабкою кислотою та сильною основою в) вираз для знаходження ступеня гідролізу |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ складає 10-5 моль/дм3 1) 5; 2) 8; 3) 7; 4) 9.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- складає 10-6 моль/дм3 1) 6; 2) 7; 3) 8; 4) 9.
Маса гідроксиду калію, що міститься в 10 дм3 розчину, дорівнює, якщо рН = 12: 1) 5,6 г; 2) 0,56 г; 3) 6,3 г; 4) 0,63 г.
Концентрація гідроксид-іонов в розчині дорівнює, якщо рН = 10,8 1) 2,5•10-5 моль/дм3; 2) 6,31•10-4 моль/дм3; 3) 1,6•10-5 моль/дм3; 4) 2,5•10-3 моль/дм3.
Водневий показник водного розчину сульфатної кислоти еквівалентної концентрації 0,05 н. дорівнює 1) 2,0; 2) 1,7; 3) 2,5; 4) 1,3.
Лакмус змінює забарвлення від синього в розчині першої солі до червоного в розчині другої солі з набору: 1) ZnCl2, BaCl2; 2) Na2S, K2SO4; 3) K2SiO3, KHSO4; 4) Na2CO3, Na2SO4.
Молекулярне і іонно-молекулярне рівняння гідролізу соли Fe(NO3)2 Fe(NO3)2 + 2HOH ↔ 2HNO3 + Fe(OH)2 NO3- + HOH ↔ HNO3 + OH-; Fe(NO3)2 + HOH ↔ HNO3 + FeOHNO3 Fe2+ + HOH ↔ H+ + FeOH+; Fe(NO3)2 + HOH ↔ 2FeOH + HNO3 2Fe2+ + NO3- + 2HOH ↔ 2Fe+ + 2OH- + HNO3; Fe(NO3)2 + HOH ↔ FeHNO3 + HNO3 NO3- + HOH ↔ HNO3 + HO-.
ТЕСТОВЕ ЗАВДАННЯ 10
Доповніть
Продукти, що виходять в результаті сольволізу, називаються ………..
Від’ємний десятковий логарифм концентрації водневих іонів називається …..
Встановіть відповідність
|
Показник |
Формула для обчислення |
|
1) водневий показник 2) гідроксильний показник |
а) рOН = -lg[OH- ] б) pH = -lg[H+] |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 2•10-7 моль/дм3 1) 7,8; 2) 6,7; 3) 7,0; 4) 6,0.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 4,6•10-4 моль/дм3 1) 10,66; 2) 11,00; 3) 11,66; 4) 10,00.
Концентрація іонів гідрогену в розчині дорівнює, якщо рН = 4: 2,5·10-5 моль/дм3; 2) 10·10-4 моль/дм3; 3) 1,6·10-5 моль/дм3; 4) 2,5·10-3 моль/дм3.
Концентрація гідроксид іонів в розчині дорівнює, якщо рН = 9: 1) 1•10-5 моль/дм3; 2) 1•10-8 моль/дм3; 3) 6•10-7 моль/дм3; 4) 1•10-6 моль/дм3.
Водневий показник водного розчину сульфатної кислоти молярної концентрації 0,01 М дорівнює 1) 1,7; 2) 2,3; 3) 2,7; 4) 1,3.
Забарвлення лакмусу змінюється від червоного в розчині першої солі до синього в розчині другої солі з набору: 1) AlCl3, K3PO4; 2 ) Na2S, Na2CO3; 3) Na2SiO3, NaCl; 4) RbNO3, K2S.
Молекулярне та іонно-молекулярне рівняння гідролізу солі CuCl2: 1) CuCl2 + 2HOH ↔ 2HCl + Cu(OH)2 Cl- + HOH ↔ HCl + OH-; 2) CuCl2 + HOH ↔ HCl + CuOHCl Cu2+ + HOH ↔ H+ + CuOH+; 3) CuCl2 + HOH ↔ 2CuOH + HCl 2Cu2+ + Cl- + 2HOH ↔ 2Cu+ + 2OH- + HCl; 4) CuCl2 + HOH ↔ CuHCl + HCl Cl- + HOH ↔ HCl + HO-.
ТЕСТОВЕ ЗАВДАННЯ 11
Доповніть
Продукти, що виходять в результаті гідролізу, називаються ………..
Частка від ділення іонного добутку води на константу дисоціації слабкої основи називається …………….
Встановіть відповідність
|
Індикатор |
Забарвлення при рН>7 |
|
1) фенолфталеїн 2) метилоранж 3) лакмус 4) універсальний індикаторний папір |
а) червоне б) малинове в) безбарвне г) синє д) фіолетове е) зелене |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 1,8•10-6 моль/дм3 1) 8,56; 2) 6,37; 3) 5,74; 4) 3,18.
Водневий показник (рН) 0,0001 М розчину гідроксиду натрію дорівнює 1) 12; 2) 10; 3) 4; 4) 8.
Константа дисоціації NH4OH Кд = 1,8•10-5. Ступінь гідролізу броміду амонію в розчині з масовою часткою солі 0,06% та густиною 1 г/мл дорівнює 1) 5,5•10-10 2) 9,2•10-8 3) 3•10-4 4) 6•10-6
Концентрація гідроксид іонів в розчині дорівнює, якщо рН = 8,8: 1) 5,04•10-5 моль/дм3; 2) 1,05•10-6 моль/дм3; 3) 6,02•10-6 моль/дм3; 4) 6,31•10-6 моль/дм3.
Водневий показник (рН) водного розчину нітратної кислоти концентрацією 0,001 моль/дм3 (дисоціацію вважати повною) дорівнює 1) 1; 2) 4; 3) 2; 4) 3.
Кислотність розчинів солей збільшується в ряду: 1) NaCl, K2CO3; 2) KCl, FeCl3; 3) FeSO4, Na2SO4; 4) NaNO3, KІ.
Молекулярне та іонно-молекулярне рівняння гідролізу солі К2S 1) К2S + HOH ↔ КHS + КOH S2- + HOH ↔ HS- + OH-; 2) К2S + HOH ↔ КHS + H2S S2- + HOH ↔ H2S + HS-; 3) К2S + HOH ↔ КH2S + КOH К+ + HOH ↔ H+ + КOH; 4) К2S + 2HOH ↔ 2КOH + H2S 2К+ + S2- + 2HOH ↔ 2К+ + 2OH- + H2S.
ТЕСТОВЕ ЗАВДАННЯ 12
Доповніть
Відношення концентрації гідролізованої солі до її загальної концентрації у розчині називається ……..
Розчини, в яких молярна концентрація іонів водню менше гідроксид-іонов, називаються ……..
Встановіть відповідність
|
Індикатор |
Забарвлення при рН<7 |
|
1) фенолфталеїн 2) метилоранж 3) лакмус 4) універсальний індикаторний папір |
а) червоне б) малинове в) безбарвне г) синє д) фіолетове е) зелене |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація оцтової кислоти складає 0,01 моль/дм3, а її Kд= 1,7×10−5 1) 2; 2) 4; 3) 9; 4) 5.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- 10-4 моль/дм3 1) 5; 2) 4; 3) 10; 4) 9.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 8 1) 10-6; 2) 10-3; 3) 10-8; 4) 10-5.
Константа дисоціації хлорноватистої кислоти НClO дорівнює 5•10-8. Ступінь гідролізу 0,05 М розчину гіпохлориту натрію дорівнює 1) 2•10-7 2) 4•10-6 3) 2•10-3 4) 4•10-3
Лакмус змінює забарвлення, від червоного в розчині першої солі до синього в розчині другої солі з набору: 1) CuSO4, Na3PO4; 2) ZnCl2, KCl; 3) K2SO3, KCl; 4) KNO3, NaCl.
Константа дисоціації кислоти HCN Кдис. = 6,2 • 10-10. Величина рН розчину цієї кислоти з концентрацією 0,062 моль/л становить: 1) 2; 2) 4; 3) 12; 4) 8.
Водневий показник (рН) водного розчину сульфатної кислоти концентрацією 0,0005 моль/дм3 (дисоціацію вважати повною) дорівнює: 1) 1; 2) 4; 3) 2; 4) 3.
ТЕСТОВЕ ЗАВДАННЯ 13
Доповніть
Частка від ділення іонного добутку води на константу дисоціації слабкої кислоти називається ……………
Розчини, в яких молярні концентрації іонів водню та гідроксид-іонов однакові, називаються ……..
Встановіть відповідність
|
Індикатор |
Забарвлення при рН=7 |
|
1) фенолфталеїн 2) метилоранж 3) лакмус 4) універсальний індикаторний папір |
а) червоне б) малинове в) безбарвне г) синє д) фіолетове е) зелене |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 10-2 моль/дм3 1) 2; 2) 4; 3) 9; 4) 5.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 10-8 моль/дм3 1) 5; 2) 4; 3) 6; 4) 9.
рН розчину фенолу дорівнює, якщо його концентрація (моль/дм3) дорівнює 0,01, а Кдис. фенолу = 1•10-10 1) 2; 2) 4; 3) 6; 4) 8.
Концентрація (моль/дм3) іонів ОН- дорівнює, якщо рН = 11 1) 10-2; 2) 10-3; 3) 10-5; 4) 10-9.
Лакмус змінює забарвлення, від синього в розчині першої солі до фіолетового в розчині другої солі з набору: 1) FeSO4, K3PO4; 2) FeCl3, KCl; 3) K2CO3, K2SO4; 4) KNO3, NaCl.
Кислотність середовища в розчинах солей збільшується в ряду KCl, K2CO3; 2) K2S, Zn(NO3)2; 3) RbCl, NaCl; 4) K2SO4, K3PO4.
Молекулярне та іонно-молекулярне рівняння гідролізу солі К2S 1) К2S + HOH ↔ КHS + КOH S2- + HOH ↔ HS- + OH-; 2) К2S + HOH ↔ КHS + H2S S2- + HOH ↔ H2S + HS-; 3) К2S + HOH ↔ КH2S + КOH К+ + HOH ↔ H+ + КOH; 4) К2S + 2HOH ↔ 2КOH + H2S 2К+ + S2- + 2HOH ↔ 2К+ + 2OH- + H2S.
ТЕСТОВЕ ЗАВДАННЯ 14
Доповніть
Частка від ділення іонного добутку води на константу дисоціації слабкої основи називається …………….
Продукти, що виходять в результаті гідролізу, називаються ……..
Встановіть відповідність
|
Сіль |
Тип гідролізу |
|
1) карбонат алюмінію 2) хлорид міді 3) карбонат натрію |
а) за аніоном б) за катіоном в) за катіоном та аніоном |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 10-6 моль/дм3 1) 4; 2) 8; 3) 11; 4) 6.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 10-8 моль/дм3 1) 5; 2) 6; 3) 7; 4) 9.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 7 1) 10-7; 2) 10-6; 3) 10-4; 4) 10-5
Концентрація (моль/дм3) іонів ОН- дорівнює, якщо рН = 9 1) 10-2; 2) 10-13; 3) 10-5; 4) 10-9.
Водневий показник (рН) розчину оцтової кислоти молярної концентрації 0,001 моль/дм3 (α = 3•10-2) дорівнює 1) 3,52; 2) 4,52; 3) 2,52; 4) 1,52.
Лакмус забарвлює в червоний колір розчин тільки перший розчин солі з набору: 1) хлорид цинку(II), хлорид натрію; 2) сульфат калію, сульфат алюмінію; 3) сульфат натрію, сульфат цинку(II); 4) сульфат цезію, сульфат натрію.
Молекулярне та іонно-молекулярне рівняння гідролізу солі ZnCl2: 1) ZnCl2 + 2HOH ↔ 2HCl + Zn(OH)2 Cl- + HOH ↔ HCl + OH-; 2) ZnCl2 + HOH ↔ HCl + ZnOHCl Zn2+ + HOH ↔ H+ + ZnOH+; 3) ZnCl2 + HOH ↔ 2ZnOH + HCl 2Zn2+ + Cl- + 2HOH ↔ 2Zn+ + 2OH- + HCl; 4) ZnCl2 + HOH ↔ ZnHCl + HCl Cl- + HOH ↔ HCl + HO-.
ТЕСТОВЕ ЗАВДАННЯ N 15
Доповніть
Солі, утворені слабкою основою та сильною кислотою, гідролізуються за ….. та їх розчини мають ……… середовище .
Добуток молярних концентрацій іонів гідрогену та гідроксид-іонов при незмінній температурі, називається ……..
Встановіть відповідність
|
Сіль |
Тип гідролізу |
|
1) сульфід хрому(ІІІ) 2) хлорид заліза(ІІІ) 3) сульфід натрію |
а) за аніоном б) за катіоном в) за катіоном та аніоном |
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів Н+ становить 10-2 моль/дм3 1) 2; 2) 3; 3) 11; 4) 5.
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 10-7 моль/дм3 1) 5; 2) 8; 3) 7; 4) 9.
Концентрація (моль/дм3) іонів Н+ дорівнює, якщо рН = 2 1) 10-2; 2) 10-3; 3) 10-4; 4) 10-5.
Концентрація (моль/дм3) іонів ОН- дорівнює, якщо рН = 6 1) 10-2; 2) 10-13; 3) 10-8; 4) 10-9.
Водневий показник (рН) розчину сульфатної кислоти молярної концентрації 0,01 моль/дм3 (дисоціацію вважати повною) дорівнює
2,7; 2) 4,7; 3) 1,7; 4) 3,7.
Константа дисоціації нітритної кислоти HNO2 дорівнює 5•10-4. Константа гідролізу нітриту натрію дорівнює 1) 4•10-6 2) 2•10-11 3) 2•10-9 4) 4•10-7
Значення констант дисоціації сульфітної кислоти H2S03 дорівнюють: К1=1,7•10-2, К2 = 6.3•10-8. Константа гідролізу сульфіту калію по першому ступеню дорівнює 1)5,8•10-13 2) 7,6•10-13 3)5,8•10-2 4) 1,6•10-7