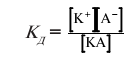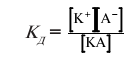- •I. Основні поняття і закони хімії
- •II. Будова атома та періодична система д.І.Менделєєва
- •Ііі. Хімічний зв'язок та будова молекул
- •IV. Розчини. Кількісний склад розчинів
- •V. Теорія електролітичної дисоціації. Рівновага у розчинах малорозчинних сполук. Сучасні теорії кислот та основ
- •Vі. Водневий показник. Гідроліз солей
- •VII. Окиснювально-відновні реакції
- •Vііі. Элементи хімічної термодинаміки. Хімічна кінетика. Хімічна рівновага
- •Тестове завдання 11
- •Тестове завдання 12
- •Тестове завдання 13
- •Тестове завдання 14
- •Тестове завдання 15
- •IX. Елементи електрохімії. Гальванічний елемент. Електроліз
- •Х. Комплексні сполуки
- •Рецензія
- •Рецензія
V. Теорія електролітичної дисоціації. Рівновага у розчинах малорозчинних сполук. Сучасні теорії кислот та основ
ТЕСТОВЕ ЗАВДАННЯ 1
Доповніть
Сполуки, які внаслідок дисоціації утворюють тільки гідроксид-іони, називаються…………
Катіони – це ……… заряджені частинки, які в електричному полі рухаються до …………
Встановіть відповідність
|
Вид солі |
Дисоціюють на |
|
а) катіони гідрогену та аніони кислотного залишку б) катіони металу, гідрогену, та аніони кислотного залишку в) катіони металу, гідроксид-аніони та аніони кислотного залишку. |
Виберіть правильну відповідь
В результаті дисоціації за першим ступенем миш'якової кислоти Н3AsO4 утворюються іони 1) AsO43- та H+ 2) HAsO42- та H+ 3) H2As04- та Н+ 4) AsO43- та OH-
Скорочене іонне рівняння Pb2+ + SO42- → PbSO4 відповідає реакції: 1) сульфіду плюмбуму(II) з сульфатною кислотою 2) гідроксиду плюмбуму(II) з сульфатною кислотою 3) оксиду плюмбуму(II) з сульфатною кислотою 4) нітрату плюмбуму(II) з сульфатом амонію
При дисоціації за першим ступенем катіон із зарядом +1 утворює молекула: 1) хлориду феруму(III) 2) сульфату гідроксокупруму(II) 3) гідрофосфату кальцію 4) хлориду магнію
При утворенні осаду ортофосфату феруму(Ш) при взаємодії хлориду феруму(III) та орто-фосфатної кислоти сума коефіцієнтів в іонному рівнянні реакції дорівнює: 1) чотирьом; 2) шести; 3) восьми; 4) десяти.
Значення рН 0,01% -ного розчину хлорної кислоти HClO4 (густина розчину становить 1 г/см3, ступінь дисоціації хлорної кислоти вважаємо рівною одиниці)) дорівнює: 1) трьом; 2) чотирьом; 3) п’яти; 4) шести.
Константа дисоціації мурашиної кислоти дорівнює 2•10-4. Значення рН 0,017 М розчину цієї кислоти дорівнює 1) 2,74; 2) 3,74; 3) 4,74; 4) 5,74.
Почнеться утворення осаду PbCrO4 з 0,1 М розчину Pb(NO3)2, коли концентрація іонів CrO42- (моль/дм3) досягне (ДРPbCrO4 становить 1,81014): 1) 1,34•10-14 2) 1,8•10-7 3) 1,34•10-7 4) 0,9•10-7.
ТЕСТОВЕ ЗАВДАННЯ 2
Доповніть
Сполуки, які внаслідок дисоціації утворюють тільки катіони гідрогену, називаються…………
Аніони – це ……… заряджені частинки, які в електричному полі рухаються до …………
Встановіть відповідність
|
Електроліти |
Визначення |
|
а) 0,03>α>0 б) 0,3>α>0,03 в) 1>α>0,3 |
Виберіть правильну відповідь
У водному розчині можлива реакція: 1) гідроксид калію + нітрат натрію 2) гідрофосфат калию + гідроксид калію 3) хлорид алюмінію + хлоридна кислота 4) нітрат заліза (II) + хлорид калію
При взаємодії 1 моля гідроксиду цинку з 2 молями хлоридної кислоти сума стехіометричних коефіцієнтів в іонному рівнянні реакції дорівнює 1) чотирьом; 2) п'яти; 3) шести; 4) семи.
У скільки разів зменшиться розчинність BaSO4 в 0,1 М розчину H2SO4 в порівнянні з його розчинністю в чистій воді? (ДР BaSO4 становить 1,11010): 1) 6; 2) 8; 3) 10; 4) 12.
1) Константа дисоціації мурашиної кислоти (НСООН) дорівнює 2•10-4. Значення рН 1,7 М розчину цієї кислоти дорівнює: 1) 3,82; 2) 2,96; 3) 1,73; 4) 4,51.
При значенні рН =10 концентрація (у моль/л) іонів [ОН-] дорівнює 1) 1•10-10; 2) 1•10-4 3) 1•10-6 4) 1•10-8
Масова частка НС1 у водному розчині дорівнює 0,365%. Густина розчину дорівнює 1 г/мл. Значення рН цього розчину дорівнює: 1) 1; 2) 2; 3) 3; 4) 4.
Скорочене іонне рівняння S2- + Cu2+→ CuS відповідає реакції сульфіду калію з: 1) гідроксидом купруму(II); 2) оксидом купруму(ІІ); 3) сульфатом купруму(ІІ); 4) ортофосфатом купруму(ІІ).
ТЕСТОВЕ ЗАВДАННЯ 3
Доповніть
Речовини, розчини та розплави яких проводять електричний струм, називаються…………
Сполуки, які дисоціюють у водному розчині з утворенням катіонів металу та аніонів кислотного залишку називаються…………
Встановіть відповідність
|
Електроліти |
Назви сполук |
|
1) сильні 2) середньої сили 3) слабкі |
а) хлорид натрію б) сульфатна кислота в) гідроксид амонію г) карбонат натрію д) сульфатна кислота е) нітратна кислота є) нітритна кислота ж) гідроксид кальцію з) мурашина кислота
|
Виберіть правильну відповідь
Всі речовини належать до сильних основ (лугів): 1) гідроксид калію, гідроксид натрію, гідроксид кальцію, гідроксид літію, гідроксид барію, гідроксид стронцію; 2) гідроксид натрію, гідроксид магнію, гідроксид кальцію,гідроксид барію, гідроксид стронцію, гідроксид калію, 3) гідроксид калію, гідроксид купруму, гідроксид кальцію, гідроксид літію, гідроксид барію, гідроксид стронцію; 4) гідроксид калію, гідроксид літію, гідроксид кальцію, гідроксид алюмінію, гідроксид натрію, гідроксид стронцію;
У водному розчині можлива реакція: 1) гідроксид цинку + гідроксид натрію; 2) хлорид магнію + хлоридна кислота 3) сульфатна кислота + хлорид феруму(III) 4) нітрат магнію + хлорид кобальту(II)
Сума стехіометричних коефіцієнтів в іонному рівнянні реакції гідроксида амонію з хлоридною кислотою дорівнює: 1) десяти; 2) восьми; 3) шести; 4) чотирьом.
Значення рН 0,1%-ного водного розчину хлоридної кислоти (густина розчину становить 1 г/см3) дорівнює: 1) 3,86; 2) 10,14; 3) 1,57; 4) 12,42.
Розчинність сульфіду плюмбуму становить, якщо константа дисоціації цієї сполуки становить 11026; 1) 4,76•10-11; 2) 1,19•10-11; 3) 2,38•10-11; 4 2,38•10-12.
рН 0,01 М розчину КОН дорівнює: 1) 12; 2) 2; 3) 13; 4) 1.
Константа дисоціації по першому ступеню сульфідної кислоти дорівнює 1,1•10-7. Ступінь дисоціації цієї кислоти в її 0,01 М розчині дорівнює: 1) 1,10•10-5; 2) 2,86•10-4; 3)3,32•10-3; 4) 4,52•10-2
ТЕСТОВЕ ЗАВДАННЯ 4
Доповніть
До лугів (сильних основ) відносяться такі: ……………………………………
Число іонів гідрогену, які відщеплюються внаслідок її дисоціації, визначають ……….
Встановіть відповідність
|
Формула |
Що виражає |
|
|
а) ступінь дисоціації б) константу дисоціації в) закон Оствальда |
Виберіть правильну відповідь
Іонному рівнянню реакції Н+ + ОН- = Н2О відповідає реакція між: 1) гідроксидом магнію та сульфатною кислотою 2) гідроксидом натрію та хлоридною кислотою 3) гідроксидом амонію та нітратною кислотою 4) гідроксидом літію та сульфідною кислотою
Розчинність (моль/дм3) Mg3(PO4)2 становить, якщо у 10 дм3 насиченого розчину цієї солі міститься 3,00 г солі: 1) 0,3; 2) 1,15•10-2 ;3) 1,15•10-4 ; 4) 1,15•10-3.
У реакції повної взаємодії між оцетовою кислотою та гідроксидом барію сума стехіометричних коефіцієнтів в іонній формі рівняння реакції дорівнює 1) десяти; 2) восьми; 3) шести; 4) чотирьом.
Ступінь дисоціації мурашиної кислоти (НСООН) в її водному розчині дорівнює 3%, а константа дисоціації цієї кислоти становить 2•10-4. Концентрація іонів гідрогену (у моль/л) в цьому розчині кислоти дорівнює 1) 1,8•10-6; 2) 2,4•10-5; 3) 9,0•10-4; 4) 6,6•10-3
Константа дисоціації NH4OH дорівнює 1,77•10-5. Концентрація іонів [ОН-] (у моль/л) в 1М розчині цієї основи дорівнює: 1)8,1•10-4; 2) 4,2•10-3; 3)3,6•10-2; 4) 4,8•10-5
Концентрація іонів Н+ (у моль/л) у 0,001 М розчині NаOH дорівнює: 1) 1•10-11; 2) 1•10-3; 3) 1•10-9; 4) 1•10-2.
Значення рН 0,01 М розчину нітратної кислоти дорівнює: 1) п'яти; 2) чотирьом; 3) двом; 4) десяти.
ТЕСТОВЕ ЗАВДАННЯ 5
Доповніть
Відношення числа молекул електроліту, які розпалися у водному розчині на іони, до загального числа розчинених молекул називається…….
Ефективна, умовна концентрація, згідно з якою іони діють у хімічних реакціях, називають ……….
Встановіть відповідність
|
Класи неорганічних сполук |
Утворюють при дисоціації |
|
а) тільки катіони гідрогену б) катіони гідрогену та металу в) аніони кислотного залишку та гідроксид-іони г) тільки гідроксид-аніони д) гідроксид-аніони та катіони металу |
Виберіть правильну відповідь
У водному розчині можлива реакція: 1) гідроксид цинку + гідроксид калію 2) карбонат натрію + ацетат калію 3) нітрат натрію + сульфат магнію 4) сульфат алюмінію + хлорид феруму(Ш)
Скороченому іонному рівнянню Н+ + ОН- = Н2О відповідає реакція між: 1) гідроксидом феруму(III) та нітратною кислотою 2) гідроксидом калію та оцетовою кислотою 3) гідроксидом натрію та нітратною кислотою 4) гідроксидом амонію та сульфатною кислотою
У водному розчині можлива реакція: 1) сульфат калія + хлорид натрію 2) гідроксид хрому(Ш) + гідроксид натрію 3) карбонат натрію + гідроксид натрію 4) нітрат алюмінію+хлорид натрію
У 1 см3 насиченого розчину CaSO4 міститься сіль масою 0,408 міліграм. Добуток розчинності цієї солі становить 1) 9•10-6; 2) 9•10-5; 3) 9•10-7; 4) 3•10-5.
Ступінь дисоціації одноосновної кислоти в її 0,2 М розчині дорівнює 0,4%. Константа дисоціації цієї кислоти дорівнює: 1) 2,4•10-4; 2) 1,6•10-5; 3) 5,8•10-3; 4) 3,2•10-6
Значення рН 0,002 М розчину нітратної кислоти дорівнює 1) 11,3; 2) 2,7; 3) 4,7; 4) 9,3.
Число водних розчинів речовин, які взаємодіють між собою: Рb(NO3)2, H2SO4, NaOH, NH4CI (реакція йде до кінця між двома розчинами різних речовин), дорівнює 1) двом; 2) трьом; 3) чотирьом; 4) п'яти.
ТЕСТОВЕ ЗАВДАННЯ 6
Доповніть
Відношення активності іонів до концентрації розчинів називають …………..
Добуток рівноважних концентрацій іонів малорозчинної сполуки у степені стехіометричних коефіцієнтів у насиченому розчині при даній температурі називається …………………………..
Встановіть відповідність:
|
Показник |
Від чого залежить |
|
а) природи розчиненої речовини, природи розчинника, концентрації розчиненої речовини, температури розчину б) природи розчиненої речовини, природи розчинника, концентрації розчиненої речовини в) природи розчиненої речовини, природи розчинника, температури розчину в) природи розчиненої речовини, концентрації розчиненої речовини, температури розчину |
Виберіть правильну відповідь
У водному розчині карбонату натрію найбільшу концентрацію має іон: l) Na+; 2) HCO3-; 3) CO32- ; 4) Н+.
Скорочене іонне рівняння Fe3+ + ОН- → FeOH2+ відповідає реакції: 1) взаємодії сульфату феруму(III) з надлишком водного розчину аміаку 2) взаємодії гідроксида феруму(Ш) з гідроксидом калію 3) гідролізу хлориду феруму(III) 4) взаємодії нітрату феруму(III) з недостатньою кількістю гідроксиду калію.
Розчинна основа – це: 1) складні речовини, що містять гідроксид-іони 2) електроліти, що утворюють при дисоціації іони металу та гідроксид-іони 3) складні речовини, що реагують у водних розчинах з кислотами 4) електроліти, що утворюють при дисоціації у водних розчинах тільки гідроксид-аніони.
Сума стехіометричних коефіцієнтів в іонному рівнянні реакції взаємодії сульфату цинку та сульфіду натрію дорівнює: 1) двом; 2) трьом; 3) чотирьом; 4) п'яти.
Значення рН 0,001 М розчину НС1 дорівнює 1) 3; 2) 11; 3) 2; 4) 12.
Ступінь дисоціації одноосновної кислоти в її 0,2 М розчині дорівнює 0,95%. Константа дисоціації цієї кислоти дорівнює: 1) 0,1805; 2) 1,805•10-5; 3) 0,19;4) 2,95
Концентрація (моль/дм3) Pb2+- іонів у насиченому розчині PbI2 становить, якщо концентрація у цьому розчині I--іонів становить 1,3∙10-3 моль/дм3. Визначте. 1) 0,63•10-3; 2) 0,65•10-3; 3) 0,85•10-3; 4) 0,315•10-3.
ТЕСТОВЕ ЗАВДАННЯ 7
Доповніть
Наведена формула
 є
математичним виразом закону …………….
є
математичним виразом закону …………….Малорозчинний електроліт випадає в осад, коли добуток рівноважних концентрацій іонів …………… за значення добутку розчинності.
Якщо насичений розчин малорозчинного електроліту, що знаходиться в рівновазі з своїм осадом:
 математичний
вираз константи даної рівноваги має
вигляд: ……………. та називається …………………
математичний
вираз константи даної рівноваги має
вигляд: ……………. та називається …………………
Виберіть правильну відповідь
В водному розчині ступінчасто дисоціює молекула: 1) K2S; 2) А1(ОН)3; 3) A12(S04)3; 4) Na2C03.
В 200 мл насиченого розчину AgCl міститься грам іонів Ag+, якщо ДP(AgCl)= 1,81010: 1) 1,8•10-8; 2) 0,74•100-3; 3) 0,74•10-10; 0,37•10-3.
Значення рН водного розчину дорівнює 9. Концентрація іонів ОН- в цьому розчині дорівнює (у моль/л) 1) 10-9; 2) 10-6; 3) 10-5; 4) 10-8.
Значення рН 0,07%-ного розчину КОН з густиною 1 г/мл дорівнює: 1) 1,9; 2) 12,1; 3) 2,7; 4) 11,3.
При дисоціації за першим ступенем катіон із зарядом +1 утворює молекула 1) сульфіду калію 2) сульфату гідроксоалюмінію 3) гідрокарбонату магнію 4) хлориду магнію
Ступінь дисоціації 0,1 М розчину оцтової кислоти дорівнює 1,36%. Константа дисоціації цієї кислоти дорівнює: 1) 1,69•10-4; 2) 1,85•10-5; 3) 3,76•10-6; 4) 2,82•10-3
Розчинність сульфіду цинку становить, якщо ДР цієї солі - 1,6×10-24: 1) 0,8•10-12;2) 0,6•10-12; 3) 1,2•10-12; 4) 1,6•10-12.
ТЕСТОВЕ ЗАВДАННЯ 8
Доповніть
В насиченому розчині малорозчинного електроліту добуток концентрацій його іонів в ступенях, рівних стехіометричним коефіцієнтам, при даній температурі - …………….та називається …………..
Для рівняння електролітичної дисоціації оцтової кислоти
 вираз для константи дисоціації має
вигляд……….
вираз для константи дисоціації має
вигляд……….
Встановіть відповідність:
|
Формула |
Що виражає |
|
|
а) ступінь дисоціації б) константу дисоціації в) закон Оствальда |
Виберіть правильну відповідь
Скорочене іонне рівняння Ме(ОН)х + хН+ → Мех+ + хH20 відображає нейтралізацію: 1) сильної кислоти сильною основою 2) слабкої кислоти сильною основою 3) слабкої основи сильною кислотою 4) слабкої основи слабкою кислотою
Взаємодії водних розчинів гідрокарбонату калію та гідроксиду калію відповідає іонне рівняння 1) C032- + 2Н+ = Н20 + С02 2) НСО3- + ОН- = СО32- + Н20 3) Н+ + ОН- = Н20 4) КНС03 + ОН- = К+ + CO32- + Н20
Концентрація іонів Н+ у водному розчині дорівнює 1•10-4 моль/л. Значення рН цього розчину дорівнює 1) 4; 2) 10; 3) 5; 4) 9.
Константа дисоціації одноосновної кислоти дорівнює 1,5•10-10. Концентрація іонів гідрогену (у моль/л) в 0,05 М розчині цієї кислоти дорівнює: 1) 5,5•10-5; 2) 2,7•10-6; 3) 2,•10-3; 4) 4,8•10-4.
Молярна концентрація водного розчину NаOH дорівнює 0,01 моль/л. Значення рН цього розчину дорівнює 1) 2; 2) 12; 3) 4; 4) 10.
Значення рН водного розчину НС1 дорівнює 6. Молярна концентрація розчину НС1 (у моль/л) дорівнює 1) 1•10-4; 2) 1•10-6; 3) 1•10-8; 4) 1•10-10
Розчинність РbI2 при 20 °С дорівнює 6,5 ∙ 10-4 моль/л. ДР(РbI2) при 20 °С становить: 1) 1,1 ∙ 10-8 2) 1,1 ∙ 10-10 3) 1,1 ∙ 10-11 ;4) 1,1 ∙ 10-9.
ТЕСТОВЕ ЗАВДАННЯ 9
Доповніть
Формула
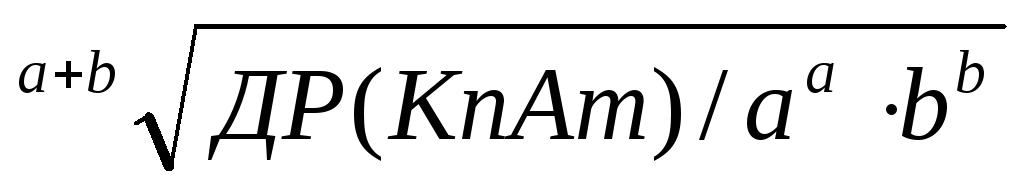 є
математичним
виразом …………………
є
математичним
виразом …………………Відношення активності іонів до концентрації розчинів називають …………..
Сполуки, які внаслідок дисоціації утворюють тільки гідроксид-іони, називаються…………
Виберіть правильну відповідь
Кислота - це 1) речовина, здатна дисоціювати 2) електроліт, що дисоціює у водному розчині на іони гідроксонію та кислотних залишків 3) складні речовини, які утворюють при дисоціації різнойменно заряджені іони 4) електроліти, що дисоціюють у водному розчині з утворенням як катіонів тільки іонів гідрогену
Ортофосфорна кислота поводиться як двоосновна кислота в рівнянні реакції 1) Н3Р04 + ЗКОН → К3Р04 + ЗН20 2) 2Н3Р04 + Са(ОН)2 → Са(Н2Р04)2 + 2Н20 3) 2Н3Р04 + ЗВаО → Ва3(Р04)2 + ЗН20 4) Н3Р04 + 3NaOH → Na2HP04 + 2Н20
У водному розчині можлива реакція 1) хлорид алюмінію + сульфат натрію 2) нітрат цинку + хлорид барію 3) гідроксид хрому + гідроксид калію 4) нітрат купруму (П) + хлорид калію
Значення рОН розчину дорівнює 4. Концентрація іонів гідрогену (у моль/л) в цьому розчині дорівнює: 1) 1•10-4; 2) 1•10-10; 3) 1•10-6; 4) 1•10-8.
Ступінь дисоціації карбонатної кислоти по першому ступеню в 0,1 М розчині дорівнює 0,173%. Константа дисоціації по першому ступеню цієї кислоти дорівнює 1) 3•10-6; 2) 3•10-5; 3) 3•10-7; 4) 3•10-4.
Значення рН 0,13% -ного розчину нітратної кислоти (густина розчину становить 1 г/см3) дорівнює 1) 3,68; 2) 12,03; 3) 1,97; 4)10,32.
Змішали рівні об'єми 0,001 М розчинів СаС12 і Na2S04. Чи утворюється осад CaS04 ? ДР (CaS04) = 2,5 ∙ 10-5. 1) так; 2) ні.
ТЕСТОВЕ ЗАВДАННЯ 10
Доповніть
В загальному вигляді розчинність малорозчинної речовини складу KnAm дорівнює: ………………….
Добуток рівноважних концентрацій іонів малорозчинної сполуки у степені стехіометричних коефіцієнтів у насиченому розчині при даній температурі називається …………………………..
Число іонів гідрогену, які відщеплюються внаслідок її дисоціації, визначають ……….
Виберіть правильну відповідь
Розпізнати розчини хлоридної та сульфатної кислот можна з використанням розчину речовини: 1) фенолфталєїну; 2) нітрату срібла; 3) гідроксиду алюмінію; 4) хлориду калію.
Реакцію, що протікає по рівнянню А13+ + ЗОН-→А1(ОН)3 здійснюють з використанням: 1) води та сульфату алюмінію 2) оксиду алюмінію та води 3) хлориду алюмінію та гідроксиду натрію 4) оксиду алюмінію та гідроксиду калію
При дисоціації по першому ступеню аніон із зарядом (-2) утворює молекула 1) гідросульфату феруму(III) 2) гідрофосфату кальцію 3) хлориду гідроксоалюмінію 4) гідроксиду магнію
При повній дисоціації 0,05 моля гідроксиду кальцію кількість речовини іонів ОН- (у молях) дорівнює: 1) 0,05; 2) 0,10; 3) 0,025; 4) 1,00.
Константа дисоціації нітритної кислоти дорівнює 5•10-4. Ступінь дисоціації кислоти в 1 М розчині дорівнює: 1) 2,24•10-2; 2) 4,56•10-3; 3) 2,24•10-2; 4) 6,25•10-5.
Значення рН розчину дорівнює 5. Концентрація іонів ОН- в цьому розчині дорівнює (у моль/л): 1) 1•10-9; 2) 1•10-5; 3) 1•10-6; 4) 1•10-7.
При кімнатній температурі розчинність MnS дорівнює 1,3756∙10-3 г/дм3. Добуток розчинності цієї солі дорівнює: 1) 2,5•10-7; 2) 2,5•10–10; 3) 2,5•10-9; 4) 1,3756•10-6.
ТЕСТОВЕ ЗАВДАННЯ 11
Доповніть
Якщо добуток рівноважних концентрацій іонів у насиченому розчині дорівнює добутку розчинності малорозчинного електроліту, то гетерогенна система знаходиться у стані ………….
Речовини, розчини та розплави яких проводять електричний струм, називаються…………
Згідно з електронною теорією Льюїса кислот та основ, кислотою є частинка (молекула чи іон), яка………………
Виберіть правильну відповідь
У водному розчині вугільної кислоти найбільшу концентрацію має іон 1) Н+; 2) НСО3- 3) СО32-; 4) ОН-
Найменше піддається дисоціації розчин галогенгідрогену у воді: 1) HF; 2) НС1 3) НВr; 4) HI.
Іонне рівняння NO2- + Н+ → HN02 відповідає молекулярній схемі процесу: 1) KN02 + Са(ОН)2 → ; 2) KNO2 + HCl → ; 3) HN02 + KOH → ; 4) KN02 + NaHC03→ .
Ступінь дисоціації 0,5 M розчину оцтової кислоти дорівнює 0,6%. Концентрація іонів гідрогену в цьому розчині (у моль/л) дорівнює 1) 0,3; 2) 3•10-2; 3) 3•10-3; 4)3•10-4.
Концентрація іонів ОН- у водному розчині дорівнює 1•10-5 моль/л. Величина рН цього розчину дорівнює 1) 5; 2) 9; 3) 7; 4) 6.
При кімнатній температурі розчинність СаСО3 дорівнює 7,07•10-2 г/дм3. Добуток розчинності цієї солі дорівнює: 1) 2,5•10-7; 2) 2,5•10–10; 3) 5•10-9; 4) 5•10-6.
Константа дисоціації одноосновної кислоти дорівнює 1,5•10-10. Концентрація іонів гідрогену (у моль/л) в 0,05 М розчині цієї кислоти дорівнює: 1) 5,5•10-5; 2) 2,7•10-6; 3) 2,•10-3; 4) 4,8•10-4.
ТЕСТОВЕ ЗАВДАННЯ 12
Доповніть
Малорозчинний електроліт випадає в осад, коли добуток рівноважних концентрацій іонів …………….за значення добутку розчинності.
Згідно з електронною теорією Льюїса кислот та основ, основою є частинка (молекула чи іон), яка………………
Ефективна, умовна концентрація, згідно з якою іони діють у хімічних реакціях, називають ……….
Виберіть правильну відповідь
Число водних розчинів речовин НС1, К2С03, CuSO4, NaOH, AICl3, що взаємодіють між собою (реакція йде до кінця між двома розчинами різних речовин) дорівнює: 1) трьом; 2) чотирьом; 3) п'яти; 4) шести.
У іонному рівнянні реакції взаємодії сульфіду заліза (II) та хлоридної кислоти сума стехіометричних коефіцієнтів в іонному рівнянні реакції дорівнює 1) двом; 2) трьом; 3) чотирьом; 4) п'яти.
У водному розчині з утворенням речовини, яка слабо дисоціює, протікає реакція: 1) гідроксид феруму(III)+сульфатна кислота 2) гідросульфат натрію + хлоридна кислота 3) хлорид цинку + сульфат натрію 4) хлорид барію + нітрат натрію
У водному розчині не протікає реакція: 1) КНС03 + Са(ОН)2 -→ 2) NaHC03+KOH → А1(ОН)3 + Ва(ОН)2 → КС1 + NaN03 →
У водному розчині КОН з густиною 1 г/мл масова частка КОН дорівнює 0,56%. Значення рН цього розчину дорівнює: 1; 2) 2; 3) 13; 4) 12.
Константа дисоціації синільної кислоти дорівнює 4,9•10-10. Ступінь дисоціації цієї кислоти в 1 М розчині дорівнює: 1) 2,2•10-10 2) 4,9•10-5; 3) 2,8•10-6; 4) 2,2•10-5.
Добуток розчинності PbCO3 становить 7,51014. Розчинність карбонату плюмбуму(ІІ) становить (г/л): 1) 7,32•10-5; 2) 7,32•10-7; 3) 7,32•10-10; 2,74•10-7.
ТЕСТОВЕ ЗАВДАННЯ 13
Доповніть
Аніони – це ……… заряджені частинки, які в електричному полі рухаються до …………
Згідно з теорією Бренстеда, кислотами є речовини (молекули чи іони), які у даній реакції ………………………………
Відношення числа молекул електроліту, які розпалися у водному розчині на іони, до загального числа розчинених молекул називається…….
Виберіть правильну відповідь
При дисоціації по першому ступеню іон із зарядом +2 утворює молекула: 1) нітрату гідроксоферуму(III) 2) гідроксиду алюмінію 3) сульфатної кислоти 4) фосфату натрію
При повній нейтралізації розчину сульфідної кислоти розчином гідроксиду натрію сума стехіометричних коефіцієнтів в іонному рівнянні реакції дорівнює: 1) восьми; 2) семи; 3) шести; 4) п’яти.
Ступінь дисоціації одноосновної кислоти в її 0,2 М розчині дорівнює 0,4%. Константа дисоціації цієї кислоти дорівнює: 1) 2,4•10-4; 2) 1,6•10-5; 3) 5,8•10-3; 4) 3,2•10-6
Змішали рівні об'єми 0,001 М розчинів Pb(NO3)2 та Na2S. Чи утворюється осад PbS? ДР (PbS) = 11027. 1) так; 2) ні.
Добуток розчинності Fe(OH)3 становить 3,81038. Розчинність гідроксиду феруму(ІІІ) становить (г/л): 1) 7,32•10-19; 2) 2,55•10-9; 3) 2,72•10-10; 2,72•10-11.
Розпізнати розчини карбонату калію та хлориду калію можна з використанням розчину речовини: 1) гідроксиду натрію 2) нітрату натрію 3) сульфатної кислоти 4) нітрату амонію
Ступінь дисоціації карбонатної кислоти по першому ступеню в 0,1 М розчині дорівнює 0,173%. Константа дисоціації по першому ступеню цієї кислоти дорівнює 1) 3•10-6; 2) 3•10-5; 3) 3•10-7; 4) 3•10-4.
ТЕСТОВЕ ЗАВДАННЯ 14
Доповніть
Згідно з теорією Бренстеда, кислота – це ………….протонів, а основа – їх акцептор.
Якщо насичений розчин малорозчинного електроліту, що знаходиться в рівновазі з своїм осадом:
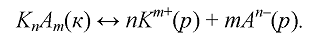 математичний
вираз константи даної рівноваги має
вигляд: ……………. та називається …………………
математичний
вираз константи даної рівноваги має
вигляд: ……………. та називається …………………Речовини, які дисоціюють з утворенням іонів Н+ та ОН- називаються ………
Виберіть правильну відповідь
Основа - це 1) речовина, здатна дисоціювати 2) електроліт, що дисоціює у водному розчині на іони гідроксонію та кислотних залишків 3) складні речовини, які утворюють при дисоціації різнойменно заряджені іони 4) електроліти, що дисоціюють у водному розчині з утворенням як аніонів тільки іонів гідроксилу
У якій послідовності випадатиме осад, якщо до розчинів, що містять однакові концентрації іонів Ca2+, Ba2+, Sr2+ поступово додавати розчин Na2SO4? ДРCaSO4 становить 1,3104, ДРBaSO4 - 1,11010, а ДРSrSO4 - 3,2107: 1) CaSO4, BaSO4, SrSO4;2) BaSO4,CaSO4, SrSO4; 3) SrSO4, BaSO4, CaSO4; 4) BaSO4, SrSO4, CaSO4;
Константа дисоціації мурашиної кислоти (НСООН) дорівнює 2•10-4. Значення рН 1,7 М розчину цієї кислоти дорівнює: 1) 3,82; 2) 2,96; 3) 1,73; 4) 4,51.
Значення рН 0,7%-ного розчину гідроксиду калію, ступінь дисоціації якого становить 1 (густина розчину - 1 г/см3) дорівнює 1) 0,903; 2) 13,097; 3) 2,865; 4) 11, 135.
Сума стехіометричних коефіцієнтів в іонному рівнянні реакції взаємодії карбонату кальцію та оцетової кислоти дорівнює 1) п'яти; 2) шести; 3) семи; 4) восьми.
У розбавленому розчині сульфатної кислоти найбільшу концентрацію має частинка: 1)Н+; 2)S042-; 3) H2S04; 4) HSО4-
Реакції між карбонатною кислотою та карбонатом калію відповідає іонне рівняння: 1) К+ + НСО3- → КНС03 2) СО32- + Н20 + CО2 → 2НСО3- 3) К2С03 + 2Н+ + СО32- → 2К+ + 2НСО3- 4) СО32- + Н20 → НСО3- + ОН-
ТЕСТОВЕ ЗАВДАННЯ 15
Доповніть
Згідно з електронною теорією Льюїса кислот та основ, кислотою є частинка (молекула чи іон), яка………………
Речовини, розчини та розплави яких проводять електричний струм, називаються…………
Ефективна, умовна концентрація, згідно з якою іони діють у хімічних реакціях, називають ……….
Виберіть правильну відповідь
Водневий показник (рН) дорівнює, якщо концентрація іонів ОН- становить 10-5 моль/дм3 1) 5; 2) 8; 3) 7; 4) 9.
Ступінь дисоціації мурашиної кислоти (НСООН) в її водному розчині становить 5%, а константа дисоціації К = 2 • 10-4. Концентрація іонів гідрогену (у моль/л) в цьому розчині дорівнює 1) 8.10-2; 2) 4•10-2; 3) 5•10-4; 4) 4•10-3
У скільки разів зменшиться розчинність BaSO4 в 0,1 М розчину H2SO4 в порівнянні з його розчинністю в чистій воді? (ДР BaSO4 становить 1,11010): 1) 6; 2) 8; 3) 10; 4) 12.
Ступінь дисоціації 0,1 М розчину оцтової кислоти дорівнює 1,36%. Константа дисоціації цієї кислоти дорівнює: 1) 1,69•10-4; 2) 1,85•10-5; 3) 3,76•10-6; 4) 2,82•10-3
У водному розчині можлива реакція: 1) сульфіт натрію + хлоридна кислота 2) хлорид кальцію + нітрат натрію 3) нітрат натрію + гідроксид калію 4) ацетат калію + хлорид натрію
Скорочене іонне рівняння CO32- + 2Н+ → Н20 + С02 відповідає реакції карбонату кальцію з оцетовою кислотою карбонату калі. Хлоридною кислотою карбонату амонію з сульфітною кислотою гідрокарбонату натрію з розбавленою сульфатною кислотою
Газ виділяється в реакції, що відповідає іонній схемі: 1) Н+ + ОН- → 2) 2H+ + CO32- → 3) Са2+ + СО32- → 4)HСО3- + 0H-→