
- •I. Основні поняття і закони хімії
- •II. Будова атома та періодична система д.І.Менделєєва
- •Ііі. Хімічний зв'язок та будова молекул
- •IV. Розчини. Кількісний склад розчинів
- •V. Теорія електролітичної дисоціації. Рівновага у розчинах малорозчинних сполук. Сучасні теорії кислот та основ
- •Vі. Водневий показник. Гідроліз солей
- •VII. Окиснювально-відновні реакції
- •Vііі. Элементи хімічної термодинаміки. Хімічна кінетика. Хімічна рівновага
- •Тестове завдання 11
- •Тестове завдання 12
- •Тестове завдання 13
- •Тестове завдання 14
- •Тестове завдання 15
- •IX. Елементи електрохімії. Гальванічний елемент. Електроліз
- •Х. Комплексні сполуки
- •Рецензія
- •Рецензія
II. Будова атома та періодична система д.І.Менделєєва
ТЕСТОВЕ ЗАВДАННЯ 1
Доповніть
1. Околоядерний простір, в якому з найбільшою вірогідністю може знаходитися електрон, називається ….
2. Квантове число, що характеризує власне обертання електрона навколо своєї осі, називається ….
3. Величина, що характеризує окиснювально-відновні властивості нейтрального атома, називається ….
4. Перші два елементи в кожному періоді, останній електрон у яких йде на зовнішній енергетичний рівень s-підрівня, називаються ….
5. Встановіть відповідність
|
Квантове число |
Характеристика |
|
1) головне 2) орбітальне 3) магнітне 4) спінове |
а) форму електронної хмари б) енергію електрона в) енергетичний стан електрона в підрівні г) власне обертання електрона навколо своєї осі д) орієнтацію орбіталі в просторі е) розміри електронної хмари
|
Виберіть правильну відповідь
Формула вищого оксиду елементу з електронною конфігурацією атома 1s22s22p63s23p64s23d104p2 - це 1) Е2О; 2) Е2О3; 3) ЕО2; 4) ЕО.
Електронній конфігурації атома 1s22s22p63s23p64s23d104p5 відповідає елемент 1) Mn; 2) Se; 3) Br; 4) Kr.
Число нейтронів в ядрі ізотопу 17О дорівнює: 3; 2) 7; 3) 9; 4) 14.
Електронна конфігурація іону Sc3+ 1s22s22p63s23p64s23d1; 2) 1s22s22p63s23p6 3) 1s22s22p63s23p64s23d4 4) 1s22s22p63s23p64s23d14p3.
Головне та орбітальне квантові числа для 4d-підрівня дорівнюють 1) 4, 2; 2) 2, 4; 3) 1, 3; 4) 2, 3.
ТЕСТОВЕ ЗАВДАННЯ 2
Доповніть
Частинка, що несе елементарний негативний заряд, називається ….
Два електрони з однаковими значеннями трьох квантових чисел (n, l, ml), але з протилежно направленими або антипаралельними спинами, називаються ….
Кількісна характеристика окиснювальної активності елементу, називається ….
Орбіталі, які мають однакові головне та орбітальне квантові числа, утворюють ……
Встановіть відповідність
|
Різновид атомів |
Характеристика |
|
1) ізотопи 2) ізобари 3) ізотони 4) хімічний елемент
|
а) Сукупність атомів, які мають мають однаковий заряд ядра б) Сукупність атомів, які мають мають однаковий заряд ядра, але різну кількість нейтронів в) Сукупність атомів, які мають однакове число нейтронів г) Сукупність атомів, які мають однакове масове число
|
Виберіть правильну відповідь
Формула вищого оксиду елементу з електронною конфігурацією атома 1s22s22p63s23p64s23d104p3 – це 1) Е2О; 2) Е2О3; 3) Е2О5; 4) Е2О7.
Елемент, у якого електронна конфігурація атома виглядає таким чином 1s22s22p63s23p64s23d104p65s24d6, - це 1) Mn; 2) Ru; 3) Br; 4) Kr.
Порядковий номер елементу для ізотопу 81Х, в ядрі якого знаходиться 46 нейтронів, дорівнює 1) 35; 2) 46; 3) 80; 4) 81.
Електронна конфігурація, яка відповідає іону Se2- 1) 1s22s22p63s23p64s23d104p4; 2) 1s22s22p63s23p64s23d104p2 3) 1s22s22p63s23p64s23d104р6 4) 1s22s22р63s23р64s23d10.
Головне і орбітальне квантові числа для 3р-підрівня дорівнюють 1) 3, 2; 2) 2, 3; 3) 3, 1; 4) 1, 3.
ТЕСТОВЕ ЗАВДАННЯ 3
Доповніть
Одиничні позитивні заряди в ядрі, називаються .
Електрон, що знаходиться один на орбіталі, називається ……..
Енергія, яка виділяється або поглинається при приєднанні електрона до незбудженого атома, називається ……
Електрони в межах енергетичного підрівня розташовуються спочатку поодинці, а потім якщо електронів більше, ніж орбіталей, то орбіталі заповнюються вже двома електронами або щоб сумарний спин був максимальним - це правило ……..
Встановіть відповідність
|
Постулати Нільса Бора |
Визначення |
|
а) якщо електрон рухається по стаціонарній орбіті, то він не виділяє і не поглинає енергії; б) при переміщенні електрона з віддаленішої орбіти на більш близьку надлишок енергії виділяється у вигляді випромінювання світла певної частоти або певної довжини хвилі; в) електрон в атомі може обертатися навколо ядра тільки по певних, стаціонарних орбітах. |
Виберіть правильну відповідь
Формула вищого оксиду елементу з електронною конфігурацією атома 1s22s22p63s23p64s23d104p1 – це 1) Е2О; 2) Е2О3; 3) Е2О5; 4) Е2О7.
Елемент з електронною конфігурацією атома 1s22s22p63s23p64s23d104p65s24d105p2 – це 1) In; 2) Sn; 3) Te; 4) Xe.
Число нейтронів в ядрі ізотопу 122Sn дорівнює 1) 50; 2) 72; 3) 119; 4) 122.
Електронна конфігурація, яка відповідає іону Sr2+ 1) 1s22s22p63s23p64s23d104p65s2; 2) 1s22s22p63s23p64s23d104p6; 3) 1s22822p63s23p64s23d10465s25р2; 4) 1s2282263s2364s23d24p65s25p6
Головне і орбітальне квантові числа для 6s-підрівня дорівнюють 1) 5, 1; 2) 6, 0; 3) 6, 2; 4) 5, 0.
ТЕСТОВЕ ЗАВДАННЯ 4
Доповніть
Частинки чисельно рівні по масі протону, але позбавлені електричного заряду, називаються ……
У атомі не може бути двох електронів, що характеризуються однаковими набором всіх чотирьох квантових чисел, - це принцип …….
Кількісна характеристика відновної активності атома називається ……..
Сукупність атомів з однаковим числом електронних шарів, називається …….
Встановіть відповідність
|
Періодичний закон |
Формулювання закону |
|
1) сучасна трактовка 2) трактовка, яку надав Д.І. Менделєєв
|
а) властивості простих тіл, а також форми та властивості сполук елементів знаходяться в періодичній залежності від величини атомних мас елементів; б) властивості хімічних елементів, а також форми і властивості з'єднань елементів знаходяться в періодичній залежності від величини заряду атомних ядер. |
Виберіть правильну відповідь
Формула вищого оксиду елементу з електронною конфігурацією атома 1s22s22p63s23p64s23d104p5 – це 1) Е2О; 2) Е2О3; 3) Е2О5; 4) Е2О7.
Електронна формула атома елементу з порядковим номером 72 1) 1s22s22p63s23p64s23d104p65s24d105р66s25d1; 2) 1s22s22p63s23p64s23d104p65s24d105р66s25d14f11; 3) 1s22s22p63s23p64s23d104p65s24d105р66s24f145d2; 4) 1s22s22p63s23p64s23d104p65s24d105р66s24f14
Число протонів в ядрі ізотопу 25Mg дорівнює 1) 12; 2) 13; 3) 24; 4) 25.
Електронна конфігурація, яка відповідає іону N3- 1) 1s22s2; 2) 1s22s22p3; 3) 1s22s22p6; 4) 1s22s22p33d3.
Головне і орбітальне квантові числа для 2p-підрівня дорівнюють 1) 3, 1; 2) 2, 0; 3) 2, 1; 4) 3, 2.
ТЕСТОВЕ ЗАВДАННЯ 5
Доповніть
Частинка, яка може знаходитися в різних станах (протон або нейтрон), називається …..
Атоми різних елементів, що мають однакові масові числа, називаються …..
Квантове число, що характеризує радіус кругової боровської орбіти, енергетичний рівень, розміри електронної хмари, називається ……
Перші два елементи в кожному періоді, останній електрон у яких йде на зовнішній енергетичний рівень s-підрівня, називаються ……
Встановіть відповідність
|
Наслідок з принципу Паулі |
Формулювання |
|
а) на зовнішньому енергетичному рівні не може бути більше 8 електронів, на перед зовнішньому – 18. б) максимальна кількість електронів на даному енергетичному рівні дорівнює 2n2. в) максимальне число електронів на даному енергетичному підрівні дорівнює 2(2l + 1) |
Виберіть правильну відповідь
Формула водневої сполуки елементу з електронною конфігурацією атома 1s22s22p5 – це 1) ЕН; 2) ЕН2; 3) ЕН3; 4) ЕН4.
Електронна формула атома елементу з порядковим номером 64 1) 1s22s22p63s2Зp64s23d104p65s24d105р66s25d14f7 2) 1s22s22p63s2Зp64s23d104p65s24d105р66s25d14f11 3) 1s22s22p63s2Зp64s23d104p65s24d105р66s24f145d2 4) 1s22s22p63s2Зp64s23d104p65s24d105р66s24f14
Порядковий номер елементу для ізотопу 104Х, в ядрі якого знаходиться 58 нейтронів, дорівнює 1) 46; 2) 58; 3) 104; 4) 106.
Число повністю заповнених енергетичних підрівнів в атомі скандію дорівнює 1) 3; 2) 4; 3) 5; 4) 6.
Значення квантових чисел n і l для зовнішніх р-електронів в атомі елементу з порядковим номером 13. 1) 3, 2; 2) 2, 3; 3) 3, 1; 4) 4, 2.
ТЕСТОВЕ ЗАВДАННЯ 6
Доповніть
Неможливо одночасно визначити і швидкість (або імпульс), і положення мікрочастинки (її координати) - це принцип ……..
Заповнення електронних підрівнів із збільшенням порядкового номера атома елементу відбувається від меншого значення (n + l) до більшого значення (n + l), а при рівних значеннях (n + l) заповнюються спочатку енергетичні підрівні з меншим значенням n - це правило …….
Останні шість елементів в кожному періоді, останній електрон у яких йде на зовнішній енергетичний рівень р-підрівня, називаються ……..
Заповнення електронами атомних орбіталей відбувається у порядку збільшення їх енергій. Це принцип ………..
Встановіть відповідність
|
Квантове число |
Характеристика |
|
а) енергію електрона, а також розміри електронної хмари; б) енергетичний стан електрона в підрівні та форму електронної хмари в) орієнтацію електронної хмари в просторі г) власне обертання електрона навколо своєї осі
|
Виберіть правильну відповідь
Електронна формула атома елементу з порядковим номером 52 1) 1s22s22p63s2Зp64s23d104p65s24d105р6; 2) 1s22s22p63s2Зp64s23d104p65s24d105р4; 3) 1s22s22p63s2Зp64s23d104p65s24d105р66s25d1; 4) 1s22s22p63s2Зp64s23d104p65s24d105р66s2.
Елемент з електронною конфігурацією атома 1s22s22p63s2Зp64s23d104p65s24d105р66s25d1 1) La; 2) Pr; 3) Cs; 4) Hf.
Порядковий номер елементу для атома 218Х, в ядрі якого знаходиться 134 нейтрони, дорівнює 1) 34; 2) 84; 3) 218; 4) 252.
Формула водневої сполуки елементу з електронною конфігурацією 1s22s22p63s2Зp64s23d104p65s24d105р5 – це 1) ЕН; 2) ЕН2; 3) ЕН5; 4) ЕН7.
Значення квантових чисел n і l для зовнішніх р-електронів в атомі елементу з порядковим номером 51 1) 5, 2; 2) 4, 1; 3) 6, 0; 4) 5, 1.
ТЕСТОВЕ ЗАВДАННЯ 7
Доповніть
Електрони з однаковим значенням n утворюють в атомі рівень, який називають….. .
Електрон має властивості як……., так і …………..
Енергія, яку треба витратити, щоб відірвати електрон від атома, що знаходиться в незбудженому стані та перенести його в простір, називається ….
Періодична система елементів є графічним (табличним) виразом …….
Встановіть правильну послідовність
Стан електрона в атомі описується: а) спином; б) магнітним квантовим числом; в) орбітальним (побічним) квантовим числом; г) головним квантовим числом.
Виберіть правильну відповідь
Формула вищого оксиду елементу з електронною конфігурацією 1s22s22p63s2Зp64s23d104p65s24d105р3 – це 1) ЕО; 2) Е2О; 3) Е2О3; 4) Е2О5.
Електронна формула атома елементу з порядковим номерів 34 1) 1s22s22p63s2Зp64s23d104p5; 2) 1s22s22p63s2Зp64s23d104p3 3) 1s22s22p63s2Зp64s23d104p6 4) 1s22s22p63s2Зp64s23d104p4.
Число протонів в ядрі атома 51V 1) 74; 2) 51; 3) 28; 4) 23.
Порядковий номер елементу, у якого конфігурація останнього енергетичного шару 5s24d2, дорівнює 1) 40; 2) 30; 3) 28; 4) 16.
Елемент, у якого квантові числа для електронів зовнішнього енергетичного рівня мають такі значення: n = 5,l= 0,ml = 0,8 ms= +1/2: 1) Sr; 2) Ag; 3) Rb; 4) K.
ТЕСТОВЕ ЗАВДАННЯ 8
Доповніть
Сума всіх протонів в атомі називається ………..
Десять елементів, розташованих у великих періодах між s- і р-елементами називаються ……….
Квантове число, яке характеризує орієнтацію електронної хмари в просторі, називається ………
Будь-яка рухома частинка або предмет володіють хвильовими властивостями з частотою, яка пов'язана з їх рухом - це постулат ……….
Встановіть відповідність
|
Правила та принципи |
Формулювання |
|
а) електрони в межах енергетичного підрівня розташовуються спочатку по одному, а потім, якщо електронів більше, ніж орбіта лей, то вони заповнюються вже двома електронами; або щоб сумарний спин був максимальним. б) заповнення електронних підрівнів із збільшенням порядкового номера атома елементу іде від меншого значення (n + l) до більшого значення (n + l), а при рівних значеннях (n + l) заповнюються спочатку енергетичні підрівні з меншим значенням (n); в) у атомі не може бути двох електронів, що характеризуються однаковими набором всіх чотирьох квантових чисел. |
Виберіть правильну відповідь
Формула вищого оксиду елементу 1s22s22p63s23p64s23d104p65s14d5 1) ЕО3; 2) Е2О; 3) Е2О3; 4) Е2О5.
Електронна формула атома елементу з порядковим номером 83 1) 1s22s22p63s2Зp64s23d104p65s24d105р66s25d16p6; 2) 1s22s22p63s2Зp64s23d104p65s24d105р66s25d104f146p3; 3) 1s22s22p63s2Зp64s23d104p65s24d105р66s25d11; 4) 1s22s22p63s2Зp64s23d104p65s24d105р66s2 4f145d11.
Елемент якому відповідає електронна конфігурація атома 1s22s22p63s23p64s23d104p65s24d105р66s2 - це 1) La; 2) Ва; 3) Cs; 4) Hf.
Набір іонів, яким відповідає електронна конфігурація 1s22s22p6, - це 1) Cl-, O2-; 2) Mg2+, F-; 3) Be2+, N3-; 4) Na+, P3-.
Елемент, у якого квантові числа для електронів зовнішнього енергетичного рівня мають такі значення: n = 5; l = 0; ml = 0; ms = ±1/2.
Sr; 2) Ag; 3) Rb; 4) K.
ТЕСТОВЕ ЗАВДАННЯ 9
Доповніть
Величина, що виражає позитивний заряд ядра його атома, тобто кількість протонів в ядрі, називається ………
Атоми, що мають однаковий заряд ядра, а значить і тотожні властивості, але різне число нейтронів, отже, різні масові числа, називаються …….. Електрони в межах енергетичного підрівня розташовуються спочатку поодинці, а потім якщо електронів більш ніж орбіталей, то орбіталі заповнюються вже двома електронами або щоб сумарний спин був максимальним - це правило ……..
Сукупність атомів з однаковим числом протонів називається ……..
Встановіть відповідність
|
Вчений |
Сформульований ним принцип або постулат |
|
1) У. Гейзенберг 2) Л. де Бройль 3) В. Паулі
|
а) Неможливо одночасно визначити і швидкість (або імпульс) і положення мікрочастинки; б) будь-яка частинка, яка рухається, або предмет мають хвильові властивості з частотою, що пов’язана з їх рухом; в) у атомі не може бути двох електронів, що характеризуються однаковими набором всіх чотирьох квантових чисел.
|
Виберіть правильну відповідь
Електронна формула атома елементу з порядковим номером 62: 1) 1s22s22p63s2Зp64s23d104p65s24d105р66s25d1; 2) 1s22s22p63s2Зp64s23d104p65s24d105р66s2; 3) 1s22s22p63s2Зp64s23d104p65s24d105р66s2 4f145d2; 4) 1s22s22p63s2Зp64s23d104p65s24d105р66s2 4f6.
Число неспарених електронів у збудженому стані атома з електронною конфігурацією 1s22s22p2 1) 1; 2) 2; 3) 3; 4) 4.
Порядковий номер елементу для атома 98Х, в ядрі якого знаходиться 56 нейтронів, дорівнює 1) 42; 2) 56; 3) 96; 4) 98.
Набір іонів, яким відповідає електронна конфігурація 1s2, - це 1) Сl-, F- ; 2) Li+, Na+; 3) Be2+, B3+; 4) N3-, O2- .
Елемент, у якого квантові числа для електронів зовнішнього енергетичного рівня мають такі значення: n = 4, l = 1,ml = -1, 0, +1, ms = +1/2, +1/2, +1/2 1) Ga; 2) Ge; 3) As; 4) P.
ТЕСТОВЕ ЗАВДАННЯ 10
Доповніть
Сума всіх протонів і нейтронів в ядрі, називається …..
Розподіл електронів по всіх чотирьох квантових числах, називається ……
Властивості хімічних елементів, а також форми і властивості сполук елементів знаходяться в періодичній залежності від величини заряду атомних ядер – це …….
Періодична система елементів є графічним (табличним) виразом ………
Встановіть відповідність
|
Частинка |
Число електронів у даної частинки |
|
а) 18 б) 12 в) 19 г) 10 |
Виберіть правильну відповідь
Електронна конфігурація, яка відповідає іону Rb+ 1) 1s22s22p63s2Зp64s23d104p65s1; 2) 1s22s22p63s2Зp64s23d104p65s24d105d1 3) 1s22s22p63s2Зp64s23d104p65s2 4) 1s22s22p63s2Зp64s23d104p6.
Число повністю заповнених енергетичних підрівнів в атомі азоту дорівнює 1) 1; 2) 2; 3) 3; 4) 4.
Формула вищого оксиду елементу з електронною конфігурацією атома 1s22s22p63s2Зp64s23d104p65s24d1 – це 1) ЕО; 2) Е2О; 3) Е2О3; 4) Е2О5.
Розподіл електронів по енергетичних рівнях для атома аргону - це 1) 2, 6, 2, 8; 2) 2, 8, 6, 2; 3) 2, 10, 6; 4) 2, 8, 8.
Здатність приймати електрони атомом елементу збільшується в ряду з порядковими номерами 1) 16, 20; 2) 6, 11; 3) 12, 17; 4) 9, 10.
ТЕСТОВЕ ЗАВДАННЯ 11
Доповніть
Електрони, які мають однакові головне та орбітальне квантові числа утворюють……..
Енергія, яка виділяється або поглинається при приєднанні електрона до нейтрального незбудженого атома з утворенням відповідного аніона – це …...
Квантове число, що характеризує просторову орієнтацію орбіталей, називається ……..
Область об’єму атома, в якій імовірність знаходження електрона максимальна, називають
Встановіть відповідність
|
Хімічний елемент |
Характеристика |
|
а) цей елемент відноситься до р-сімейства; б) цей елемент відноситься до s-сімейства; в) атом елементу має 10 електронів на підрівні з n = 3 и l = 2; г) атом елементу має 2 електрони на підрівні з n = 3 і l = 0. |
Виберіть правильну відповідь
Електронна формула атома елементу з порядковим номером 47: 1) 1s22s22p63s2Зp64s23d104p65s24d105p66s25d1 2) 1s22s22p63s2Зp64s23d104p65s24d105p66s25d14f11 3) 1s22s22p63s2Зp64s23d104p65s24d9 4) 1s22s22p63s2Зp64s23d104p65s24d105p66s24f14;
Формула водневої сполуки елементу з електронною конфігурацією 1s22s22p63s2Зp64s23d104p65s24d105p4 1) ЕН2; 2) ЕН4; 3) ЕН5; 4) ЕН6.
Число повністю заповнених енергетичних підрівнів в іоні Са2+ дорівнює 1) 3; 2) 4; 3) 5; 4) 6.
Число протонів і нейтронів в ядрі атома 14С 1) p = 14, n = 6; 2) p = 6, n = 14; 3) p = 6, n = 8; 4) p = 12, n = 6.
Головне і орбітальне квантові числа для 4f-підрівня дорівнюють 1) 4, 1; 2) 2, 4; 3) 2, 3; 4) 4, 3.
ТЕСТОВЕ ЗАВДАННЯ 12
Доповніть
Енергія, необхідна для відриву електрона від нейтрального незбудженого атома називається ……….. Цю енергію вимірюють у …………
Величина, що виражає позитивний заряд ядра його атома, тобто кількість протонів в ядрі, називається ……..
Атоми, що мають однаковий заряд ядра, а значить і тотожні властивості, але різне число нейтронів, отже, різні масові числа, називаються ………..
Електрони в межах енергетичного підрівня розташовуються спочатку поодинці, а потім якщо електронів більш ніж орбіталей, то вони заповнюються вже двома електронами або щоб сумарний спин був максимальним - це правило ………..
Встановіть відповідність:
|
Вчений |
Сформульований ним принцип або постулат |
|
1) У. Гейзенберг 2) Л. де Бройль 3) В. Паулі
|
а) Неможливо одночасно визначити і швидкість (або імпульс) і положення мікрочастинки; б) будь-яка частинка, яка рухається, або предмет мають хвильові властивості з частотою, що пов’язана з їх рухом; в) у атомі не може бути двох електронів, що характеризуються однаковими набором всіх чотирьох квантових чисел.
|
Виберіть правильну відповідь
Електронна формула атома елементу з порядковим номером 62: 1) 1s22s22p63s23p64s23d104p65s24d105р66s25d1; 2) 1s22s22p63s23p64s23d104p65s24d105р66s2; 3) 1s22s22p63s23p64s23d104p65s24d105p66s24f145d2; 4) 1s22s22p63s23p64s23d104p65s24d105р66s24f6.
Число валентних електронів у нормальному стані атома з електронною конфігурацією 1s22s22p63s23p64s23d104p65s24d1: 1) 1; 2) 2; 3) 3; 4) 5.
Порядковий номер елементу для атома 98Х, в ядрі якого знаходиться 56 нейтронів, дорівнює: 1) 42; 2) 56; 3) 96; 4) 98.
Набір іонів, яким відповідає електронна конфігурація 1s2, - це 1) Сl-, F- ; 2) Li+, Na+; 3) Be2+, B3+; 4) N3-, O-2 .
Елемент, у якого квантові числа для електронів зовнішнього енергетичного рівня мають такі значення: n = 4, l = 1,1ml = -1, 0 +1, ms = +1/2, +1/2, +1/2: 1) Ga; 2) Ge; 3) As; 4) P.
ТЕСТОВЕ ЗАВДАННЯ 13
Доповніть
Сукупність атомів з однаковим числом електронних шарів, називається .
Сукупність атомів з однаковою кількістю електронів або з однаковою кількістю протонів в ядрі, називається ………………………….
Останні шість елементів в кожному періоді, останній електрон у яких йде на зовнішній енергетичний рівень р-підрівня, називаються ……………………………
Квантове число, що характеризує орієнтацію орбіталі в просторі, називається ……………..
Встановіть відповідність
|
Хімічний елемент |
Характеристика |
|
а) цей елемент належить до р-елементів; б) цей елемент належить до s-елементів; в) атом елементу має 10 електронів на підрівні з n=3 та l=2; г) атом елементу має 2 електрони на підрівні з n=3 та l=0. |
Виберіть правильну відповідь
Електронна конфігурація, яка відповідає атому криптону: 1) 1s22s22p63s23p64s23d104p34d3; 2) 1s22s22p63s23p64s23d54p34d3; 3) 1s22s22p63s23p64s23d104p6; 4) 1s22s22p63s23p64s23d54p55s25p3.
Формула водневої сполуки елементу з електронною конфігурацією атома 1s22s22p63s23p64s23d104p65s24d105p3: ЕН; 2) ЭН2; 3) ЭН3; 4) ЭН5.
Число протонів і нейтронів в ядрі атома ізотопу 43Са дорівнює: 1) р = 40, n = 43; 2) p = 20, n = 43; 3) p =20, n = 23; 4) p = 20, n = 20.
Число повністю заповнених енергетичних підрівнів в атомі титану дорівнює: 1) 6; 2) 5; 3) 3; 4) 4.
Положення вірне для елементу з порядковим номером 15 і атомною масою 30,97 г/моль:
1) Атом елементу має 5 електронів на підрівні з n = 3 і l = 2.
2) Цей елемент відноситься до неметалів.
3) Енергія іонізації цього елементу більше енергії іонізації натрію.
4) Гідратна форма цього елементу відноситься до основ.
ТЕСТОВЕ ЗАВДАННЯ 14
Доповніть
Атоми різних елементів, що мають однакове число нейтронів в ядрі, називаються ………
Величина, яка вказує на число позитивних зарядів ядра атома, а також число рухомих в полі ядра електронів, називається ……..
Квантове число, що характеризує орієнтацію орбіталі в просторі, називається …….
Властивості простих тіл, а також форми і властивості сполук елементів знаходяться в періодичній залежності від величини атомних мас елементів – це…………….
Встановіть відповідність
|
Характеристика атома |
Визначення |
|
а) кількісна характеристика окиснювально-відновної активності елементу б) радіуси шароподібних частинок, що зблизилися одна до одної при утворенні кристалу в) енергія, яку треба витратити щоб відірвати електрон від атома, який знаходиться в незбудженому атомі та перенести його у простір г) властивість атома в молекулі притягувати до себе електрони |
Виберіть правильну відповідь
Формула вищого оксиду елементу з електронною конфігурацією атома 1s22s22p63s23p64s23d104p65s24d5: 1) ЕО; 2) Э2О; 3) Э2О5; 4) Э2О7.
Елемент 132Х, в ядрі ізотопу якого знаходиться 76 нейтронів, - це 1) сурма; 2) барій; 3) гафній; 4) прометій.
Електронна конфігурація, яка відповідає атому срібла: 1) 1s22s22p63s23p64s23d104p65s24d9; 2) 1s22s22p63s23p64s23d104p65s14d10; 3) 1s22s22p63s23p64s23d104p65s24d8; 4) 1s22s22p63s23p64s23d104p65s24d106s1.
Здатність атомів віддавати електрони збільшується в ряду: 1) Ве, Li, K; 2) Si, Al, C; 3) Br, S, F; 4) Si, P, Cl.
Положення вірне для елементу з порядковим номером 32 і атомною масою 72,6 г/моль
1) Атоми елементу мають 10 електронів на підрівні з n = 4 і l = 2.
2) Ядро атома містить 32 протони і 41 нейтрон.
3) Цей елемент відноситься до d-сімейства.
4) Гідратна форма цього елементу відноситься до основ.
ТЕСТОВЕ ЗАВДАННЯ 15
Доповніть
Кількісна характеристика окиснювально-відновної активності елементу, називається ……
Періодична система елементів є графічним (табличним) виразом …….
Заповнення електронних підрівнів із збільшенням порядкового номера атома елементу відбувається від меншого значення (n + l) до більшого значення (n + l), а при рівних значеннях (n + l) заповнюються спочатку енергетичні підрівні з меншим значенням n - це правило …….
У атомі не може бути двох електронів, що характеризуються однаковими набором всіх чотирьох квантових чисел, - це принцип …….
Встановіть відповідність
|
Хімічний елемент |
Характеристика |
|
а) атом елемента має два електрони на рівні n=6 та l = 2 б) сполуки у вищому ступені окиснення є сильними окисниками в) гідратна форма елементу є основою г) атом елементу має 5 валентних електронів на підрівні з n=3 та l = 2 |
Виберіть правильну відповідь
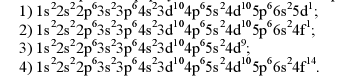
Електронна формула атома елементу з порядковим номером 57: 1) 1s22s22p63s23p64s23d104p65s24d105р66s25d1; 2) 1s22s22p63s23p64s23d104p65s24d105р66s24f1; 3) 1s22s22p63s23p64s23d104p65s24d9; 4) 1s22s22p63s23p64s23d104p65s24d105р66s24f14.
Набір іонів, яким відповідає електронна конфігурація 1s2: 1) Li+, C4+; 2) Be2+, O-2; 3) P3-,Cl-; 4) F-, Na+.
Електронна конфігурація зовнішнього енергетичного рівня атома фосфору у збудженому стані
1) 3s23p3; 2) 3s13p33d1; 3) 3s13p23d2; 4) 3s13p13d3.
Число протонів і нейтронів в ядрі атома ізотопу 41К
1) р = 20, n = 19; 2) p = 39, n = 2; 3) p = 19, n = 20; 4) p = 19, n = 22.
Здатність атомів приймати електрони збільшується в ряду: 1) Br, S, Te; 2) Cl, Br, I; 3) C, Si, Pb; 4) N, O, F.
