
2579
.pdf
этом в небольшом слое рыхлой клетчатки становится видным большеберцовый нерв, идущий вдоль задней стенки вен (реже одной вены), прикрывающих подколенную артерию. Артерию выделяют из сосудисто-не- рвного пучка и берут на держалку.
Для удобного наложения анастомоза подколенную артерию выделяют на протяжении не менее 4 см. В нижней трети разреза выявляется верхнемедиальный край камбаловидной мышцы, которую можно надсечь у внутреннего края большеберцовой кости и отвести кзади; тогда обнажается дистальный отдел подколенной артерии в месте ее деления. Этот доступ также используют при выделении начальных отделов задней болыпеберцовой и малоберцовой артерий — необходимо лишь продлить кожный разрез книзу. После рассечения собственной фасции определяют зону прикрепления камбаловидной мышцы, на этом протяжении медиальный край камбаловидной мышцы сращен
Рис. 7.5. Доступ к передней тибиальной
артерии в верхней трети голени (а, б).
190
только с собственной фасцией голени. Необходимо надсечь камбаловидную мышцу с фасцией, приподняв которую, можно проникнуть в глубокое ложе голени. Затем в проксимальном направлении камбаловидную мышцу отсекают от большеберцовой кости в мышечно-костной зоне прикрепления. Обнажают задние большеберцовые сосуды, которые проходят на расстоянии 2—2,5 см от медиального края болыпеберцовой кости. Для обнажения малоберцовых сосудов из этого доступа следует пересечь внутреннюю часть сухожильной дуги икроножной мышцы. После этого можно отвести кожномышечный лоскут еще кзади и кнаружи и увидеть малоберцовые сосуды. При выделении берцовых артерий следует стремиться, чтобы они были мобилизованы на протяжении не менее 3 см — это необходимо для удобного наложения анастомоза.
Доступ к передней тибиальной артерии в верхней трети голени (рис. 7.5). В
верхней трети голени при доступе к передней тибиальной артерии внешними ориентирами являются передняя борозда голени и передний край болыпеберцовой кости. После определения передней борозды, отступив на 1 см кнутри, проводят параллельно ей разрез длиной 7—8 см, начиная его на уровне бугристости болыпеберцовой кости. После рассечения кожи и подкожной клетчатки определяют промежуток между mm.tibialis anterior и extensor digitorum longus и разводят их. Передняя болынеберцовая артерия находится под m.extensor digitorum longus вбли-
зи малоберцовой кости. Для удобства наложения анастомоза необходимо также выделить артерию на протяжении 4 см.
Доступ к задней болъшеберцовой артерии на уровне нижней трети голени
(рис. 7.6). Задняя болыпеберцовая артерия проходит на этом уровне сравнительно неглубоко между большеберцовой костью и внутренним краем ахиллова сухожилия на протя-

Рис. 7.6. Доступ к задней большеберцовой артерии на уровне нижней трети голени (а, б).
жении 8—9 см выше лодыжки. Поверхностное их расположение зависит от уровня перехода камбаловидной мышцы в сухожилие, отделяющего сосудисто-нервный пучок, который окажется покрытым только фасциальным листком или мышцей. К задней большеберцовой артерии возможны два доступа — выше лодыжки и позади нее.
При доступе выше лодыжки разрез следует проводить на границе задней и средней трети промежутка между большеберцовой костью и ахилловым сухожилием. После рассечения кожи с подкожной клетчаткой на положение сосудисто-нервного пучка может указывать большеберцовый нерв (желтая полоска под фасцией вблизи внутреннего края ахиллова сухожилия). У края кости проходит сухожилие длинного сгибателя пальцев. Фасцию следует рассечь вдоль нерва, после чего выделяют артерию.
При доступе к задней большеберцовой артерии на уровне лодыжки разрез длиной 4—5 см выполняют на 1 см кзади от лодыжки. После рассечения кожи и удерживающей связки легко выделить артерию.
Доступ к малоберцовой артерии
(рис. 7.7). Малоберцовую артерию в ее проксимальной части обнажают через медиальный разрез в верхней
трети голени с частичным рассечением камбаловидной мышцы. При шунтировании доступ к средней части артерии осуществляют через разрез длиной 8—10 см по латеральной поверхности голени в промежутке между длинной и короткой малоберцовыми и камбаловидной мышцей. Последнюю смещают кзади и обнаруживают длинный сгибатель большого пальца, который острым путем отделяют от малоберцовых мышц.
Рис. 7.7. Доступ к малоберцовой артерии
(а, б).
191
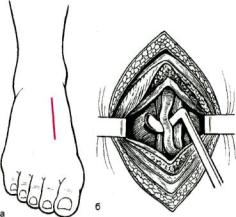

Рис. 7.9. Использование большой подкожной вены по методике in situ (этапы операции).
тальной частью большой подкожной |
образом, что с дистальным концом |
|
вены на уровне верхней трети голе- |
вены формируют |
проксимальный |
ни, лигируя дистальный конец вены. |
анастомоз, а с проксимальным кон- |
|
Иссеченную вену погружают в лоток |
цом вены — дистальный. |
|
с изотоническим раствором натрия |
Использование большой подкожной |
|
хлорида, куда предварительно введе- |
вены in situ (рис. 7.9). Данная методи- |
|
но 5000 ЕД гепарина. В дистальный |
ка имеет свои преимущества при |
|
конец вены вводят тупую канюлю на |
большой длине трансплантата: про- |
|
шприце. Вену сначала промывают, |
исходит лучшая адаптация дисталь- |
|
затем подвергают гидравлической |
ного конца вены к более мелкому |
|
дилатации, одновременно проверяя |
диаметру соответствующего уровня |
|
герметичность перевязанных ветвей. |
артерий и сохраняется кровоснабже- |
|
Имеющиеся дефекты ушивают мо- |
ние венозной стенки. При методике |
|
нофиламентной нитью 6/0 и 7/0. Ве- |
in situ сначала формируют прокси- |
|
ну реверсируют и размещают при |
мальный анастомоз |
с проходимым |
выполнении шунтирования таким |
сегментом артерии, после наложения |
|
|
|
193 |
13-4886 |
|
|
анастомоза пускают кровоток и от- |
Наиболее |
важные моменты |
при |
||||||||||||||||
мечают пульсацию до первого веноз- |
бедренно-подколенно-берцовых ре- |
||||||||||||||||||
ного клапана. Затем выделяют сег- |
конструкциях: |
|
|
|
|
||||||||||||||
мент большой подкожной вены на |
• избегать |
эндартерэктомии |
из |
||||||||||||||||
уровне предполагаемого |
дистально- |
подколенной и берцовых артерий; |
|||||||||||||||||
го анастомоза, вену пересекают, |
• реконструкцию начинать с фор- |
||||||||||||||||||
дистальный конец вены лигируют. В |
мирования дистального анастомоза; |
||||||||||||||||||
проксимальный конец в краниальном |
• дистальный |
анастомоз |
форми- |
||||||||||||||||
направлении вводят инструмент для |
ровать по типу конец в бок. |
|
|
||||||||||||||||
разрушения |
клапанов |
до |
уровня |
Бедренно-подколенное |
шунтирова- |
||||||||||||||
проксимального |
анастомоза. |
Затем |
|||||||||||||||||
ние выше щели коленного |
сустава |
||||||||||||||||||
тракцией |
клапанотома |
к |
стопе |
на |
|||||||||||||||
(рис. 7.10) выполняют при окклюзии |
|||||||||||||||||||
пульсирующем кровотоке разрушают |
|||||||||||||||||||
поверхностной бедренной артерии в |
|||||||||||||||||||
клапаны. Данную манипуляцию вы- |
|||||||||||||||||||
устье, в гунтеровом (приводящем) |
|||||||||||||||||||
полняют несколько раз с вращением |
|||||||||||||||||||
канале и на всем протяжении при со- |
|||||||||||||||||||
инструмента |
по |
оси до |
получения |
||||||||||||||||
хранной проходимости подколенной |
|||||||||||||||||||
пульсирующего |
кровотока |
на |
дис- |
||||||||||||||||
артерии |
после |
выделения бифурка- |
|||||||||||||||||
тальном конце вены, после чего фор- |
|||||||||||||||||||
ции общей бедренной артерии и под- |
|||||||||||||||||||
мируют дистальный анастомоз. При |
|||||||||||||||||||
коленной артерии в месте выхода из |
|||||||||||||||||||
пуске кровотока выраженное систо- |
|||||||||||||||||||
гунтерова канала, а также забора и |
|||||||||||||||||||
лодиастолическое дрожание по ходу |
|||||||||||||||||||
приготовления |
большой |
подкожной |
|||||||||||||||||
трансплантата позволяет |
определить |
||||||||||||||||||
вены. |
Сначала формируют дисталь- |
||||||||||||||||||
крупные |
венозные |
ветки, |
которые |
||||||||||||||||
ный анастомоз по типу конец в бок |
|||||||||||||||||||
лигируют |
через |
единичные |
неболь- |
||||||||||||||||
реверсированной аутовеной с подко- |
|||||||||||||||||||
шие кожные разрезы. |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
ленной |
артерией непрерывным |
об- |
||||||||||||
Гомотрансплантаты |
и |
аллотранс- |
|||||||||||||||||
вивным швом монофиламентной ни- |
|||||||||||||||||||
плантаты используют при рассыпном |
|||||||||||||||||||
тью 5/0 или 6/0. Длина анастомоза — |
|||||||||||||||||||
типе большой подкожной вены, при |
|||||||||||||||||||
более 15 мм. Затем трансплантат про- |
|||||||||||||||||||
ее облитерации |
и |
повторных |
ре- |
||||||||||||||||
водят |
по ходу |
сосудисто-нервного |
|||||||||||||||||
конструкциях, |
когда отсутствует ау- |
||||||||||||||||||
пучка на верхнюю треть бедра и фор- |
|||||||||||||||||||
томатериал. |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
мируют |
проксимальный |
анастомоз. |
||||||||
При реконструкциях ниже пупар- |
|||||||||||||||||||
Существует два варианта формиро- |
|||||||||||||||||||
товой связки применяют аллопротезы |
|||||||||||||||||||
вания проксимального анастомоза: 1) |
|||||||||||||||||||
из политетрафторэтилена |
(ПТФЭ), |
||||||||||||||||||
при |
сохранной |
проходимости |
по- |
||||||||||||||||
которые по |
своим |
свойствам |
лишь |
||||||||||||||||
верхностной |
бедренной |
артерии в |
|||||||||||||||||
незначительно |
уступают |
аутовене. |
|||||||||||||||||
верхней трети анастомоз формируют |
|||||||||||||||||||
Существуют |
конические |
протезы с |
|||||||||||||||||
по типу конец трансплантата в бок |
|||||||||||||||||||
армированными участками для при- |
|||||||||||||||||||
общей бедренной артерии с перехо- |
|||||||||||||||||||
менения в области коленного суста- |
|||||||||||||||||||
ва, а также протезы из ПТФЭ малого |
дом на начальный отдел поверхност- |
||||||||||||||||||
диаметра (до 4 мм), применяемые в |
ной бедренной артерии; 2) при ок- |
||||||||||||||||||
подколенно-берцовой области. |
|
|
клюзии |
поверхностной |
бедренной |
||||||||||||||
В ситуации, когда невозможно ис- |
артерии непосредственно в устье ар- |
||||||||||||||||||
пользовать аутовену или протез из |
терию отсекают, дистальный конец ее |
||||||||||||||||||
ПТФЭ, применяют гомоартериаль- |
перевязывают с прошиванием, а раз- |
||||||||||||||||||
ный трансплантат, который уступает |
рез от устья продлевают на 1,5—2 см |
||||||||||||||||||
вышеуказанным |
трансплантатам, |
но |
по передней стенке общей бедренной |
||||||||||||||||
тем не менее дает возможность выпол- |
артерии |
и |
|
формируют |
косой |
||||||||||||||
нить реконструктивную операцию и |
анастомоз с общей бедренной артери- |
||||||||||||||||||
спасти конечность от ампутации. |
|
ей. Проксимальный анастомоз фор- |
|||||||||||||||||
При бедренно-подколенном шун- |
мируют |
монофиламентной |
нитью |
||||||||||||||||
тировании |
выше |
щели |
коленного |
5/0. При бедренно-подколенной ре- |
|||||||||||||||
сустава используют линейный протез |
конструкции выше щели коленного |
||||||||||||||||||
из дакрона диаметром 7—8 мм. |
|
|
сустава в качестве пластического ма- |
||||||||||||||||
194 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

териала предпочтение отдают синтетическому протезу из ПТФЭ или дакрона.
Бедренно-подколенное шунтирование ниже щели коленного сустава
(рис. 7.11) выполняют при окклюзии поверхностной бедренной артерии с одновременной окклюзией проксимального отдела подколенной артерии. Дистальный анастомоз формируют с подколенной артерией ниже щели коленного сустава по типу конец в бок монофиламентной нитью 6/0. Длина анастомоза больше 10 мм. Затем трансплантат проводят на верхнюю треть бедра. На уровне коленного сустава предпочтительнее провести его по ходу сосудисто-нервно- го пучка, чтобы избежать большого отклонения оси трансплантата по отношению к артерии. На бедре возможно подкожное проведение трансплантата. Проксимальный анастомоз формируют аналогично описанной выше методике при бедренно-подко- ленном шунтировании выше щели коленного сустава. При бедренноподколенной реконструкции ниже щели коленного сустава в качестве пластического материала можно использовать аутовену, как реверсированную, так и по методике in situ, или армированный протез из ПТФЭ.
Бедренно-тибиальное шунтирова-
ние (при условии, что берцовые артерии проходимы в верхней трети голени) (рис. 7.12). Данную реконструкцию выполняют при окклюзии подколенной артерии на всем протяжении с одновременными изменениями в поверхностной бедренной артерии. В этой ситуации предпочтительнее наложение дистального анастомоза в тибиоперонеальный ствол по типу конец в бок непрерывным обвивным швом монофиламентной нитью 6/0. В связи с тем что уровень дистального анастомоза значительно ниже щели коленного сустава, трансплантат можно провести подкожно, при этом угол между артерией и трансплантатом не будет слишком большим. Проксимальный анасто-
13*
Рис. 7.10. Бедренно-подколенное шунтирование выше щели коленного сустава.
Рис. 7.11. Бедренно-подколенное шунтирование ниже щели коленного сустава.
моз формируют с общей бедренной артерией аналогично методике, опи-
санной выше (см. Бедренно-подколен- ное шунтирование выше щели коленно-
го сустава). Даже при сохраненной проходимости поверхностной бедренной артерии до уровня гунтерова (приводящего) канала не рекомендуется формировать анастомоз с данной артерией, так как она часто поражена атеросклеротическим процессом.
В качестве пластического материала при бедренно-берцовых реконструкциях предпочтение отдают использованию аутовены по методике in situ. При отсутствии аутопласти-
195

Рис. 7.12. Бедренно-заднетибиальное шунтирование.
Рис. 7.13. Бедренно-переднетибиальное шунтирование.
ческого материала можно применять армированный тонкостенный протез из ПТФЭ конической формы диаметром 7—5 мм.
При окклюзии тибиоперонеального ствола и сохранной проходимости начальных отделов берцовых артерий выполняют бедренно-заднебольше- берцовое шунтирование. Техника операции не отличается от описанной выше с дистальным анастомозом с тибиоперонеальным стволом.
При проходимости лишь передней тибиальной артерии выполняют бед- ренно-переднебольшеберцовое шунтирование (рис. 7.13). Следует выделить переднюю тибиальную артерию в верхней трети голени и выполнить медиальный доступ к трифуркации подколенной артерии. Через эти до-
196
ступы удобно сформировать отверстие в межкостной мембране для проведения трансплантата. Дистальный анастомоз формируется с передней тибиальной артерией по типу конец в бок непрерывным обвивным швом монофиламентной нитью 6/0. После наложения дистального анастомоза реверсированную аутовену выводят через заранее образованное отверстие в межкостной мембране на медиальную поверхность голени и далее подкожно по медиальной поверхности нижней конечности проводят на верхнюю треть бедра, где формируют проксимальный анастомоз по описанной выше методике. При реконструкции с использованием вены по методике in situ после формирования проксимального анастомоза и разрушения клапанов в стволе большой подкожной вены дистальный мобилизованный конец вены через межкостную мембрану проводят на латеральную поверхность голени и формируют дистальный анастомоз с передней тибиальной артерией. При реконструкции передней тибиальной артерии проведение трансплантата по латеральной поверхности области коленного сустава и бедра также возможно, но нежелательно.
Ранний послеоперационный период.
Все раны после операции активно дренируют на протяжении суток. Необходимо проводить наблюдение за пульсацией трансплантата и периферических артерий, если после операции на них появилась пульсация. При невозможности определить пульсацию пальпаторно используют ультразвуковое допплеровское исследование. При развитии тромбоза трансплантата показано экстренное оперативное вмешательство, направленное на выявление и устранение причин тромбоза. При раннем послеоперационном тромбозе показано выполнение интраоперационной ангиографии, которая дает возможность увидеть тактические и технические ошибки первичной реконструкции.

Причиной раннего послеоперационного тромбоза у больных после реконструктивной операции ниже уровня паховой складки могут быть нестабильная гемодинамика (тенденция к гипотонии) и гиперкоагуляция. Поэтому больные после таких реконструктивных операций первые сутки должны находиться в отделении интенсивной терапии, где им проводят круглосуточный мониторинг центральной гемодинамики и через каждые 3—6 ч определяют уровень гемоглобина и показатель гематокрита. Всем больным рекомендовано поддерживать уровень гемоглобина в пределах 110 г/л и гематокрита ниже 35 ед. Этих показателей удается придерживаться в случае использования аутокрови, взятой у больного в объеме 350—400 мл за сутки до операции.
Больные в раннем послеоперационном периоде должны получать дезагреганты и реологические растворы. У пациентов с нарушениями лимфовенозного дренирования и при реконструкции артерий голени показано назначение прямых антикоагулянтов. Гепарин вводят через инфузомат в суточной дозе 20 000—25 000 ЕД под контролем времени свертывания крови (не менее 15 мин) в течение 3—5 сут с последующим переводом пациента на подкожное введение в
течение 7 дней.
Перед выпиской пациента оценивают дистанцию безболевой ходьбы (тредмил-тест) и определяют ЛПИ. На амбулаторном этапе лечения после реконструктивных операций больным рекомендуют постоянно принимать ацетилсалициловую кислоту по 100 мг в день постоянно (если нет заболеваний желудка), 2—3 раза в год проходить 1—2-месячные курсы лечения таблетированными препаратами в сочетании с физиотерапевтическим лечением.
После сосудистых операций больные нетрудоспособны в течение 1 — 3 мес. Летальность при реконструктивных операциях на артериях ниж-
Таблица 7.1. Проходимость
реконструированных сосудов через год после операции
них конечностей составляет менее 1 %, причина летальных исходов — в основном осложнения ИБС.
Проходимость сосудов через год после операции представлена в табл.
7.1.
Как видно из табл. 7.1, на проходимость реконструированных сосудов влияет как уровень наложения дистального анастомоза, так и используемый пластический материал.
Благоприятный прогноз течения окклюзирующего процесса в артериях нижних конечностей сомнителен, так как без адекватного лечения прогрессирование ишемии приводит к ампутации нижней конечности. Таким образом, при выявлении окклюзии магистральных артерий конечности показано комплексное лечение, соответствующее степени ишемии конечности.
Проводимое лечение должно быть ориентировано не только на сохранение конечности, но и на сохранение и улучшение качества жизни пациента.
197
7.2. Облитерирующий тромбангиит (болезнь Винивартера — Бюргера)
Облитерирующий тромбангиит (ОТ) — хроническое воспалительное заболевание артерий среднего и мелкого калибра, вен с преимущественным вовлечением дистальных отделов сосудов верхних и нижних конечностей (редко церебральных и висцеральных) и с последующим распространением патологического процесса на проксимальные зоны сосудистого русла [Olin J., 1994].
Сосудистые заболевания, сопровождающиеся гангреной дистальных отделов конечностей, были известны еще до нашей эры в Египте и Греции. Первым описал гангрену конечностей у мужчин молодого возраста Фукидид, живший в Афинах (430 лет до н.э.). Активное изучение происхождения гангрены нижних конечностей приходится на конец XIX в. Большинство исследователей того времени причину омертвения тканей видели в необратимых изменениях стенки сосуда с закрытием их просвета. Первый, кто высказал в 1869 г. предположение о первичном воспалительном процессе в сосудистой стенке, был Winiwarter, причем тромбоз, по его мнению, был следствием воспаления. Термин "облитерирующий эндартериит" предложил патологоанатом Fridlander в 1876 г., хотя первое классическое клиническое описание данного заболевания принадлежит опять же Winiwarter (1878). На основании клинико-анатомических исследований Buerger (1908) пришел к выводу, что повышение свертываемости и вязкости крови в сочетании с воспалительными изменениями сосудистой стенки приводит к развитию множественного тромбоза. Он же первым установил, что при этом заболевании поражаются не только артерии, но и вены, и придавал большое значение мигрирующему тромбофлебиту. Buerger назвал это заболевание облитерирующим тромбангии-
198
том и считал необходимым выделить его в отдельную нозологическую форму (1910). И лишь в 1955 г. на Международной ангиологической комиссии термин "облитерирующий тромбангиит", обозначающий отдельную нозологическую форму, был официально принят.
Gruber (1917) впервые высказал предположение об аллергической природе ОТ с клиническим проявлением гиперергической аллергической реакции. Поддержал и развил аллергическую теорию А.И.Абрикосов (1933). Параллельно появилась теория гиперадреналинемии, предложенная В.А.Оппелем (1911), который причину болезни видел в гиперфункции надпочечников. Помимо этих теорий, в развитии ОТ в различное время были предложены нейрогенная [Введенский А.А., 1892], кортикоорганная [Вишневский А. В., 1934] и нейрогуморальная [Шаповалов И.П., 1958] теории. В 70-е годы активное развитие иммунологии подтвердило возможность аутоиммунной природы ОТ.
Эпидемиология. Специальных эпидемиологических исследований распространенности ОТ в общей популяции не проводилось. По данным клиники Мейо (Рочестер, Миннесота, США), заболеваемость ОТ с конца 50-х до середины 80-х годов неуклонно снижалась. В 1986 г. она находилась на уровне 12,6 случая на 100 000 больных, обратившихся в эту клинику [Lie J., 1987, 1989]. В Испании с 1982 по 1990 г. было зарегистрировано 11 случаев на 100 000 боль-
ных [Fernandez-Miranda С. et al.,
1993]. ОТ встречается у 2,6—6,7 % больных с патологией сосудов нижних конечностей; чаще болеют лица, проживающие на Ближнем Востоке, в Юго-Восточной Азии, Японии, Восточной Европе и Южной Амери-
ке [Tanade Т., 1994].
Этиология и патогенез. Этиология ОТ, несмотря на экспериментальные исследования и многочисленные клинические наблюдения, до настоящего времени остается во многом неясной. Продолжают дискутироваться основные положения этой сложной проблемы, причем ни одна из выдвинутых концепций не раскрывает в полной мере происхождения данного заболевания.
При тщательном анализе зарубежной и отечественной литературы за последние десятилетия удалось выявить некоторую закономерность в механизме развития ОТ.
Первичным звеном в этиопатогенезе ОТ некоторые авторы считают его наследственную обусловленность, или генетическую предрасположенность. В последние годы, однако, возникла новая концепция, свидетельствующая об исключительной роли собственных антигенов гистосовместимости в реализации ряда ключевых функций иммунитета, что создает предпосылки для расшифровки механизмов взаимосвязи между HLA-антигенами и болезнями. Гены HLAсистемы главным образом связаны с регуляцией иммунного ответа и/или являются посредниками в иммунологических реакциях
[Aerbajinai W. et al., 1997]. Отмечено,
что антигены А1, В8, В9, В5, В7, DRW2 чаще встречаются у больных ОТ, чем у здоровых. Так, при наличии В5-антигена HLA-системы риск развития этого заболевания состав-
ляет 78,2 %.
Вполне вероятно, что не существует единых антигенов, ответственных за развитие ОТ, и их разнообразие объясняется этническими или региональными особенностями. Однако в любом случае представляют интерес механизмы реализации иммуногенетической предрасположенности к ОТ. Наследственная предрасположенность может оказаться нереализованной без провоцирующих факторов внешней среды. Таким фактором, в частности, является табакокуре-
ние, которое усугубляет развитие заболевания и снижает эффект лечения. Само заболевание определяется даже как disease of young tabacco smokers (болезнь молодых курильщиков). Более 98 % больных ОТ являются злостными курильщиками, а по некоторым данным, ими являются все больные ОТ [Sayin A. et al., 1993].
Сравнительный анализ частоты ампутаций среди групп больных, продолжающих и прекративших курение, показал, что количество больших ампутаций у больных, продолжающих курить, в 18—22 раза больше, а эффект от проведенного оперативного и терапевтического лечения, как правило, оказывается непродолжительным. Ампутацию у больных, продолжающих курить, многие рассматривают как закономерный исход заболевания [Levesque H. et al., 1994].
Влияние табачного дыма на организм человека разнообразно. Самые вредные компоненты курения — монооксид углерода, котинин (основной метаболит никотина) и гликопротеидный антиген, являющийся основным в пусковом механизме аутоиммунного процесса. Эти компоненты табачного дыма выступают в роли антигенов и повышают аллергическую "настроенность" организма, что подтверждается увеличением содержания IgE в сыворотке крови длительно курящих людей. Никотин и карбоксигемоглобин вызывают функциональные и структурные изменения эндотелиальных клеток.
Курение нарушает биосинтез тромбоксана А2 и простациклина, что приводит к нарушению реологических свойств крови и дисфункции эндотелия. В то же время некоторые авторы не исключают возможности изменения антигенной структуры интимы сосудов вследствие гиперчувствительности к компонентам табачного дыма. Таким образом, курение следует рассматривать как фактор риска развития ОТ — этот провоцирующий фактор на фоне генетичес-
199
