
Химия Соснина
.pdfМинистерство транспорта РФ ФАЖТ
ГОУ ВПО «ДВГУПС»
Кафедра «Химия и экология»
Н.А. Соснина
ХИМИЯ ОСНОВНЫЕ РАЗДЕЛЫ
ЧАСТЬ 1
Рекомендовано Методическим советом ДВГУПС
в качестве учебного пособия для практических занятий
и самостоятельной работы студентов
Хабаровск Центр дистанционного образования
2010
Рецензенты:
Кафедра «Химия и география» Дальневосточного государственного гуманитарного университета
(заведующий кафедрой кандидат педагогических наук,
доцент Н.П. Панова)
Кандидат химических наук, научный сотрудник Института материаловедения
Н.Ф. Карпович
С 664 |
Соснина, Н. А. Химия. Основные разделы. Ч. 1 : учеб. пособие / Н. А. |
|
Соснина. – Хабаровск : Изд-во ДВГУПС, 2010. – 131 с. : ил. |
Учебное пособие соответствует ГОС ВПО направления подготовки дипломированных специалистов 190400 «Системы обеспечения движения поездов», специальности 190402.65 «Автоматика, телемеханика и связь на железнодорожном транспорте» по дисциплине «Химия».
Составлено согласно обязательному минимуму образовательной программы по дисциплине и дидактическим единицам (ДЕ) ГОС.
Первая часть представляет краткое изложение теоретического материала, образцы решения задач и индивидуальные задания по разделам: «Строение вещества» и «Основные закономерности протекания химических процессов».
Предназначено для практических занятий и самостоятельной работы студентов 1-го курса всех форм обучения.
ПРЕДИСЛОВИЕ
Согласно ГОС изучение дисциплины «Химия» для специальности 190402.65 предусматривает включение следующих разделов:
–общая и неорганическая химия;
–физическая химия;
–аналитическая химия;
–органическая химия и химия ВМС.
При колоссальном объеме обязательного минимума образовательной программы, а также крайне ограниченном объеме аудиторных (36 ч) и самостоятельных (34 ч) занятий практически все разделы изучаются на уровне общих понятий и представлений. Поскольку при изучении химии студентами данной специальности в учебный процесс не включается лабораторный практикум, раздел «аналитическая химия» дается в крайне усеченном варианте в виде основных понятий. При желании более подробно с материалом каждого из излагаемых разделов студенты могут ознакомиться в обязательной учебной литературе, перечень которой приводится в конце пособия.
Первая часть учебного пособия освещает следующие разделы:
–понятие «вещество», классификация веществ и основные химические свойства неорганических соединений;
–строение вещества в свете современных представлений (строение атома, периодические изменения свойств химических элементов, химическая связь, строение твердых веществ, свойства проводников, полупроводников, изоляторов);
–общие закономерности протекания химических процессов (элементы химической термодинамики, химическая кинетика и равновесие).
Каждый раздел включает краткое изложение теоретического материала, согласно наименованию дидактических единиц (ДЕ) ГОС, образцы выполнения индивидуальных заданий и 30 вариантов индивидуальных заданий. Последние составлены в форме традиционных задач, решение которых позволяет развивать логическое мышление студентов. Кроме того, после каждого раздела приводятся тесты для промежуточного контроля знаний студентов. Содержание и форма контрольных заданий и тестов аналогична тем, которые представлены в итоговом интернет-экзамене по дисциплине.
В учебном пособии дано приложение, содержащее весь необходимый справочный материал для выполнения индивидуальных заданий, и список основной и вспомогательной учебной и учебно-методической литературы.
Несмотря на ограниченность объема часов, до 10 % аудиторных занятий и самостоятельной работы студентов данного направления подготовки отводится на изучение разделов химии, связанных непосредственно с будущей специальностью студентов: зонная теория строения кристаллов, структура и свойства проводников, полупроводников, изоляторов, химизм процесса собственной и примесной проводимости полупроводников.
Учебное пособие обеспечит студентам освоение обязательного минимума образовательной программы по химии, согласно требованиям ГОС, повышающим интеллектуальный уровень формирования личности, позволит расширить кругозор будущих инженеров и развить творческий подход к профессиональной деятельности.
...
1. ВВЕДЕНИЕ В ДИСЦИПЛИНУ
1.1. Предмет и задачи химии. Вещество
Химия как одна из естественных наук изучает конкретную форму движения вещественной материи – химические процессы, т. е. качественное изменение вещества, превращение одних веществ в другие.
Примеры процессов:
1)J2(Т)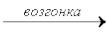 J2(Г) – физический процесс;
J2(Г) – физический процесс;
2)2Na + 2H2O = 2NaOH + H2↑ – химический процесс.
Химия – это наука о составе, внутреннем строении, свойствах веществ, их превращениях и тех явлениях, которыми сопровождаются превращения веществ.
Вещество – это определённая форма материи, представляющая собой устойчивую совокупность частиц (атомы, молекулы или ионы), обладающих массой покоя и характеризующихся при определённых условиях конкретными физическими и химическими свойствами.
1.2. Атомно-молекулярное учение о строении вещества
Вопрос о том, из чего состоит вещество, волновал ещё философов древней Греции. Демокрит, Эпикур, Левкипразработали учения об атомах, как мельчайшей
неделимой основе вещества. Однако учение носило абстрактный характер и не опиралось на фактические данные. В средние века в период господства алхимии древнегреческая атомистика была забыта. Основной задачей алхимии (так химию называли арабы) было получение благородных металлов из неблагородных с помощью философского камня. В этот период химия развивалась медленно, но было открыто много новых химических соединений и изучены их свойства.
После крушения алхимии огромный вклад в развитие учения о строении вещества внёс М.В. Ломоносов (Россия). В1741 г. в работе «Элементы математической химии» он сформулировал основные положения корпускулярной (молекулярной) теории строения
вещества. Независимо от Ломоносова атомистическую теорию строения вещества разрабатывал Дж. Дальтон (1766–1844, Англия).
За 270 лет, прошедших с того времени, идеи об атомистическом строении вещества прошли всестороннюю проверку и были полностью подтверждены. Атомно-молекулярное учение о строении вещества было дополнено работами Д.И. Менделеева, А.М. Бутлерова и рядом других учёных. В настоящее время на этом учении базируются все наши представления о строении материи, свойствах веществ, природе физических и химических явлений.
● Основные положения атомно-молекулярного учения о строении вещества.
1.В основе учения о строении вещества лежит принцип дискретности, т. е. вещество не является сплошным, а состоит из отдельных мельчайших частиц (атомы, молекулы или ионы).
Молекула – это наименьшая нейтральная частица вещества, состоящая из атомов и являющаяся носителем его химических свойств.
Атом – это наименьшая нейтральная частица химического элемента, состоящая из элементарных частиц, обладающая его химическими свойствами.
Химический элемент – это вид атомов, характеризующийся определённой величиной положительного заряда ядра и совокупностью свойств.
2.При соединении друг с другом атомов одного и того же химического элемента образуются простые вещества. Если соединяются атомы разных элементов,
образуются сложные вещества.
Химические элементы: H, O, N.
Простые вещества: H2, O2, O3, N2.
Сложные вещества: H2O, NH3, HNO3.
3.Атомы и молекулы в веществе находятся в постоянном движении, характер которого зависит от агрегатного состояния вещества. Чем выше температура, тем интенсивнее движение частиц.
4.В состав молекул может входить различное число атомов. Молекулы инертных газов состоят из одного атома:He, Ar. Молекулы простых газов состоят из двух, реже трёх
атомов: Н2, N2, O3. В состав молекулы серной кислоты H2SO4 входит 7 атомов, молекулы многих полимерных веществ насчитывают сотни и тысячи атомов: [-CH2-CH2-]n.
5.Образуя молекулы, атомы могут соединяться друг с другом не только в различных количествах, но и разным образом в пространстве, увеличивая тем самым многообразие веществ (явление получило название «изомерия» и наиболее распространено среди органических веществ).
Н |
Н |
С2Н6О |
Н |
Н |
|
│ |
│ |
│ |
│ |
||
|
|||||
Н—С—С—О—Н |
|
Н—С— О—С—Н |
|||
│ |
│ |
|
│ |
│ |
|
Н |
Н |
|
Н |
Н |
|
Этиловый спирт |
|
Диметиловый эфир |
|||
6. Существуют вещества, в которых носителями свойств являются не молекулы, а атомы (атомные кристаллы, металлы), ионы (растворы солей, кислот и т. д.) или их комбинации.
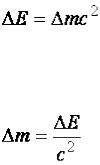
Окончательному утверждению атомно-молекулярного учения в химии способствовало развитие количественных методов анализа химических веществ и открытие стехиометрических (количественных) законов.
1.3. Основные количественные (стехиометрические) законы
1.3.1. Общие сведения 1.3.2. Закон сохранения массы вещества (материи)
1.3.3. Закон постоянства состава вещества 1.3.4. Закон эквивалентов 1.3.5. Закон кратных отношений
1.3.1. Общие сведения
Законы устанавливают количественные соотношения между веществами в химических реакциях и подтверждают принцип дискретности в строении вещества:
–закон сохранения массы вещества (материи) сформулирован и экспериментально обоснован М.В. Ломоносовым в 1760 г., унифицирован А. Эйнштейном (США) в 1903 г.;
–закон постоянства состава вещества сформулирован французским химиком Ж.
Прустом в 1801–1808 гг.;
–закон эквивалентов был открыт в результате работ И. Рихтера (Германия) в 1797– 1800 гг.;
–закон кратных отношений предложен Д. Дальтоном в 1803 г.
1.3.2. Закон сохранения массы вещества (материи)
Масса веществ, вступающих в реакцию, равна массе продуктов реакции.
На этом законе основаны количественные анализы в химии и расчёты по уравнениям реакций.
В 1903 г. А. Эйнштейн установил, что в реакциях, протекающих на уровне атомных ядер, выделяется колоссальное количество энергии, что может вызвать изменение массы всей системы (уравнение Эйнштейна–Ферми):
, |
(1) |
где 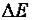 – энергия, выделяющаяся в процессе реакции;
– энергия, выделяющаяся в процессе реакции;  – дефект масс,
– дефект масс,  – скорость света (2,9975·108 м/с или 300 000 км/с).
– скорость света (2,9975·108 м/с или 300 000 км/с).
. |
(2) |
Вобычных химических реакциях  = 300…400 кДж/моль, поэтому дефект масс для них столь незначителен, что не может быть отмечен самыми точными приборами, следовательно, для химических процессов применим закон Ломоносова.
= 300…400 кДж/моль, поэтому дефект масс для них столь незначителен, что не может быть отмечен самыми точными приборами, следовательно, для химических процессов применим закон Ломоносова.
Внастоящее время закон стал универсальным и получил название закона со-
хранения материи: в изолированных системах сумма масс и энергий есть величина постоянная.
1.3.3. Закон постоянства состава вещества
Каждое химически чистое соединение молекулярной структуры характеризуется одним и тем же количественным составом независимо от способов получения.
Пример: углекислый газ СО2 может быть получен разными способами:
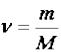
C + O2 = CO2;
2CO + O2 = 2CO2;
CaCO3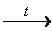 CaO + CO2;
CaO + CO2;
NaHCO3 + HCl = NaCl + H2O + CO2.
Но каким бы способом не был получен СО2, это вещество всегда содержит по массе:
27,29 % С и 72, 71 % О.
1.3.4. Закон эквивалентов
В химии количество вещества выражается в г, кг, л, молях, эквивалентах.
Моль – это количество вещества, содержащее столько структурных единиц (атомы, молекулы или ионы), сколько их содержится в 12 г изотопа углерода -12 (12С).
Число структурных единиц в одном моле любого вещества равно 6,02·1023 и называется числом Авогадро. Масса 1 моля вещества, выраженная в граммах, называется мо-
лярной массой вещества  , г/моль.
, г/моль.
, |
(3) |
где 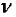 – количество молей вещества;
– количество молей вещества; 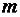 – масса вещества, г;
– масса вещества, г; 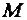 – молярная масса вещества, г/моль.
– молярная масса вещества, г/моль.
Применяя понятие «молярная масса вещества», необходимо указывать, какие структурные единицы массы имеются в виду: атомные, молекулярные или ионные.
Например: 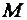 (Н) = 1 г/моль,
(Н) = 1 г/моль, 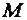 (Н+) = 1 г/моль,
(Н+) = 1 г/моль, 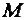 (Н2) = 2 г/моль.
(Н2) = 2 г/моль.
Эквивалентом элемента или соединения (Э) называется его реальная или условная частица, которая может присоединять, замещать, высвобождать или быть каким либо другим способом эквивалентна одному иону (атому) водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Пример:
H2 |
HCl |
H2O |
NH3 |
ЭH = H |
ЭCl = Cl |
ЭO = 1/2O |
ЭN = 1/3N |
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
ЭCa(OH)2 = 1/2Ca(OH)2, т. е. 1/2 моля Ca(OH)2 реагирует в реакции с 1 молем HCl.
Моль эквивалентов вещества 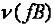 содержит 6,02·1023 эквивалентов вещества.
содержит 6,02·1023 эквивалентов вещества.

Масса 1 моль-эквивалента вещества (элемента), выраженная в граммах, называ-
ется молярной массой эквивалента вещества 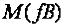 , г/моль, где
, г/моль, где 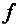 – фактор экви-
– фактор экви-
валентности.
, (4)
где 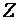 – валентность элемента, а
– валентность элемента, а 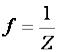 .
.
Таким образом, если элемент в соединениях проявляет переменную валентность,
его 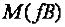 не является величиной постоянной.
не является величиной постоянной.
Пример: Cr6+O3; |
Cr23+O3; |
Cr2+O. |
= 56/6 = 9,3 г/моль; |
56/3 = 18,6 г/моль; |
56/2 = 28 г/моль. |
Закон эквивалентов: Все вещества реагируют между собой в эквивалентных количествах.
= |
, |
(5) |
где 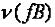 – число моль-эквивалентов вещества. Для уравнения, записанного в общем виде:
– число моль-эквивалентов вещества. Для уравнения, записанного в общем виде: 
,
или |
, |
(6) |
где  , г. %;
, г. %; 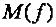 , г/моль.
, г/моль.
Если одно из веществ, вступающих или полученных в результате реакции – газ, то математическое выражение закона эквивалентов примет вид:
, |
(7) |
где 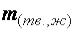 – масса твёрдого или жидкого вещества, г;
– масса твёрдого или жидкого вещества, г; 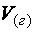 – объём газа,
– объём газа,
л; 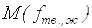 – молярная масса эквивалента твёрдого или жидкого вещества,
– молярная масса эквивалента твёрдого или жидкого вещества,
г/моль;  – молярный объём эквивалента газообразного вещества при нормальных условиях, л/моль.
– молярный объём эквивалента газообразного вещества при нормальных условиях, л/моль.
Молярный объём эквивалента вещества – это объём, который занимает при нормальных условиях 1 моль-эквивалентов данного газообразного вещества.
Если 1 моль любого газа при нормальных условиях занимает объём, равный 22,4 л/моль, то для газообразного водорода Н2 молярный объём эквивалента будет равен:
22,4 л – занимает 1 моль молекул Н2, т. е. – 2 г;
хл – занимает объём 1 моль-эквивалентов Н, т. е. – 1 г
х= 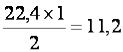 л/моль, т. е.
л/моль, т. е. 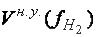 = 11,2 л/моль.
= 11,2 л/моль.
Аналогичным образом рассчитывается 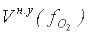 :
:
22,4 л – занимает 1 моль молекул кислорода О2, т. е. – 32 г;
хл – занимает объём 1 моль-эквивалентов О, т. е. – 8 г.
х= 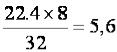 л/моль, т. е.
л/моль, т. е. 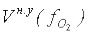 = 5,6 л/моль.
= 5,6 л/моль.
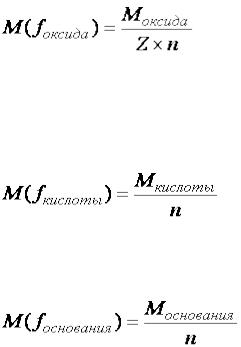
Расчёт молярных масс эквивалентов сложных соединений:
, |
(8) |
где 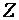 – валентность элемента, образующего оксид;
– валентность элемента, образующего оксид; 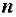 – число атомов элемента, образующего оксид;
– число атомов элемента, образующего оксид;
, |
(9) |
где 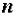 – основность кислоты;
– основность кислоты;
, |
(10) |

где – кислотность основания; |
|
, |
(11) |
где 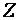 – валентность металла, образующего соль;
– валентность металла, образующего соль;  – число атомов металла, образующего соль.
– число атомов металла, образующего соль.
1.3.5. Закон кратных отношений
Если 2 элемента образуют между собой несколько различных соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.
Пример: азот образует 5 соединений с кислородом: N2O – на 28 в.ч. N приходится 16 в.ч. О;
NO – на 28 в.ч. N приходится 32 в.ч. О;
N2O3 – на 28 в.ч. N приходится 48 в.ч. О;
NO2 – на 28 в.ч. N приходится 64 в.ч. О;
N2O5 – на 28 в.ч. N приходится 80 в.ч. О.
Весовые количества О, приходящиеся на одно и то же количество N (28 в.ч.) относятся друг к другу как простые целые числа:
16 : 32 : 48 : 64 : 80 = 1: 2 : 3 : 4 : 5.
1.4. Классификация веществ. Химические свойства неорганических соединений основных классов
При сравнительно небольшом количестве химических элементов (открыто 118 элементов, часть из них получена только искусственным путём) существует бесконечное многообразие химических соединений.
На рис. 1 представлена упрощенная классификация веществ.
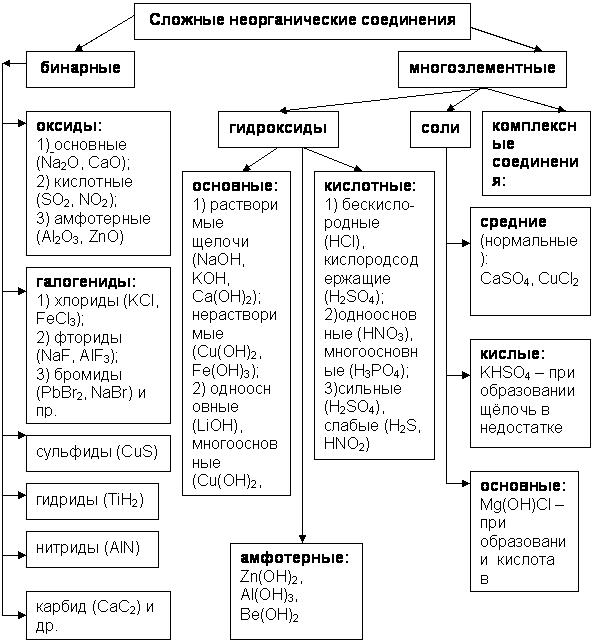
Рис. 1. Упрощенная классификация веществ
По составу, свойствам и наличию различных функциональных групп все сложные неорганические и органические вещества делятся на классы. Классификация сложных неорганических соединений представлена на рис. 2.
Рис. 2. Классификация основных сложных неорганических соединений
Среди сложных неорганических соединений выделяются следующие основные классы: оксиды, гидроксиды, соли.
Оксиды – это соединения атомов элементов с кислородом. По составу и химическим свойствам оксиды делятся на основные, кислотные и амфотерные.
Основные оксиды – соединения атомов металлов с кислородом (Na2O, CaO, MgO и пр.). Получаются при непосредственном взаимодействии металла с кислородом: 2Na +
O2 = 2Na2O, либо при термическом разложении солей: CaCO2 CaO + CO2.
CaO + CO2.
