
Химия Соснина
.pdfОсновные оксиды взаимодействуют с кислотами и кислотными оксидами, образуя соли:
1) CaO + H2SO4 = CaSO4 + H2O
CaO + 2H+ + SO42- = Ca2+ + SO42- + H2O CaO + 2H+ = Ca2+ + H2O,
2) СaO + CO2 = CaCO3.
При взаимодействии некоторых растворимых основных оксидов с водой образуются основания (щелочи):
K2O + H2O = KOH K2O + H2O = K+ + OH-.
Кислотные оксиды – соединения атомов неметаллов или некоторых металлов в высшей степени окисления (V+5, Mn+7, Cr+6 и др.) с кислородом. Образуются при взаимодействии атомов элементов непосредственно с кислородом: S + O2 = SO2, при
разложении некоторых кислот: H2CO3  CO2 + H2O, либо в ходе окислительновосстановительных реакций: 2SO2 + O2 = 2SO3.
CO2 + H2O, либо в ходе окислительновосстановительных реакций: 2SO2 + O2 = 2SO3.
Кислотные оксиды взаимодействуют с растворимыми основаниями и основными оксидами с образованием солей:
1) SO2 + 2KOH = K2SO3 + H2O
SO2 + 2K+ + 2OH- = 2K+ + SO32- + H2O SO2 + 2OH- = SO32- + H2O,
2)SiO2 + CaO  CaSiO3,
CaSiO3,
3)Mn2O7 + 2NaOH = 2NaMnO4 + H2O
Mn2O7 + 2Na+ + 2OH- = 2Na+ + 2MnO4- + H2O Mn2O7 + 2OH- = 2MnO4- + H2O.
При взаимодействии некоторых кислотных оксидов с водой образуются кислоты:
SO3 + H2O = H2SO4
SO3 + H2O = 2H+ + SO42-.
Амфотерные оксиды – соединения атомов амфотерных элементов с кислородом (Al2O3, ZnO, BeO, Cr2O3, PbO2и др.). Образуются при непосредственном окислении атомов элементов кислородом или косвенным путем, проявляют свойства как основных, так и кислотных оксидов:
1) ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2H+ + SO42- = Zn2+ + SO42- + H2O ZnO + 2H+ = Zn2+ + H2O,
2) ZnO + 2NaOH  Na2ZnO2 + H2O
Na2ZnO2 + H2O
ZnO + 2Na+ + 2OH- = 2Na+ + ZnO22- + H2O ZnO + 2OH- = ZnO22- + H2O.
ZnO + 2OH- = ZnO22- + H2O.
Гидроксиды – это продукты прямого взаимодействия оксидов с водой, либо косвенных процессов. Они делятся на кислотные, основные и амфотерные.
Кислоты – вещества, диссоциирующие в растворах с образованием ионов водорода (т. е. доноры протонов). По составу молекул кислоты делятся на бескислородные (HCl, H2S, HJ и др.) и кислородсодержащие (HNO3, H2SO4, H3PO4 и др.) (см. названия основных неорганических кислот и их солей в табл. 1 приложения). По количеству катионов водорода в молекуле кислоты бывают одно- (HNO3, HCl, HJ) и многоосновные (H2SO4, H3PO4, H2S). По характеру диссоциации на ионы в растворе кислоты делятся на сильные (HNO3, H2SO4, HCl) и слабые (H3PO4, H2CO3), (см. величины констант диссоциации сильных и слабых электролитов в табл. 2 приложения). При записи ионно-молекулярных уравнений реакций в растворах слабые кислоты на ионы не расписываются.
Характерными химическими свойствами кислот является способность реагировать с основными оксидами, основаниями, амфотерными оксидами и гидроксидами и солями с образованием солей, как одного из продуктов реакции:
1) 2HCl + CaO = CaCl2 + H2O
2H+ + 2Cl- + CaO = Ca2+ + 2Cl- + H2O
2H+ + CaO = Ca2++ H2O,
2) 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
2H+ + 2NO3- + Cu(OH)2 = Cu2+ + 2NO3- + 2H2O 2H+ + Cu(OH)2 = Cu2+ + 2H2O,
3) H2SO4 + BaCl2 = BaSO4↓+ 2HCl
2H+ + SO42+ + Ba2+ + 2Cl- = BaSO4↓+ 2H+ + 2Cl- SO42+ + Ba2+ = BaSO4↓.
Растворы кислот реагируют с активными металлами (Mg, Zn, Al, Ca и пр.) с образованием солей и выделением газообразного водорода:
H2SO4 + Mg = MgSO4 + H2↑
2H+ + SO42- + Mg0 = Mg2+ + SO42- + H20↑ 2H+ + Mg0 = Mg2++ H20↑.
Иначе ведет себя азотная кислота (HNO3). Наличие в ней активного окислителя (N5+) позволяет реагировать даже с малоактивными металлами (Cu, Ag и др.), однако водород при этом не выделяется:
4HNO3 + Cu = Cu(NO3)2 +2NO2 + 2H2O.
Более подробно о реакциях кислот различной концентрации и состава с металлами см. в основной учебной литературе.
Основания – вещества, диссоциирующие в растворах с образование гидроксидионов. По числу гидроксид-ионов в молекуле основания делятся на одно- (NaOH, AgOH) и многокислотные (Ca(OH)2, Fe(OH)3). Большинство оснований нерастворимо в воде. Растворимыми являются основания, образованные щелочными и щелочноземельными металлами (NaOH, KOH, Ca(OH)2, Ba(OH)2 и др.).
Основания реагируют с кислотами, кислотными и амфотерными оксидами, солями:
1) Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O,
2)Ca(OH)2 + CO2 = CaCO3↓ + H2O Ca2+ + 2OH- + CO2 = CaCO3↓ + H2O,
3)2NaOH + BeO + H2O = Na2[Be(OH)4]
2Na+ + 2OH- + BeO + H2O = 2Na+ + [Be(OH)4]2- 2OH- + BeO + H2O = [Be(OH)4]2-,
4) 2KOH + CuSO4 = Cu(OH)2↓ + K2SO4
2K+ + 2OH- + Cu2+ + SO42- = Cu(OH)2↓ + 2K+ + SO42- 2OH- + Cu2+ = Cu(OH)2↓.
Некоторые гидроксиды обладают не только основными, но и кислотными свойствами, их называют амфотерными.К ним относятся гидроксиды амфотерных металлов: Zn(OH)2, Be(OH)2, Al(OH)3, Pb(OH)2, Sn(OH)2, Cr(OH)3 и др. Например:
1)Zn(OH)2 + 2KOH = K2[Zn(OH)4] Zn(OH)2 + 2K+ + 2OH- = 2K+ + [Zn(OH)4]2- Zn(OH)2 + 2OH- = [Zn(OH)4]2-,
2)Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Zn(OH)2 + 2H+ + 2Cl- = Zn2+ + 2Cl- + 2H2O Zn(OH)2 + 2H+ = Zn2+ + 2H2O.
Соли – продукты полного или частичного замещения ионов водорода в молекуле кислоты ионами металлов или продукты полного или частичного замещения гидроксидионов в молекуле основания кислотными остатками.
При полном замещении ионов водорода в молекуле кислоты на ионы металлов образуются средние (нормальные) соли:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2H+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + 2H2O 2H+ + 2OH- = 2H2O.
Na2SO4 – сульфат натрия (средняя соль).
Кислые соли (гидросоли) образуются при неполном замещении ионов водорода в молекуле кислоты на ионы металлов. Это наблюдается при
взаимодействии многоосновных кислотс основаниями в тех случаях, когда количество взятого основания недостаточно для образования средней соли:
H2CO3 + KOH = KHCO3 + H2O
недостаток
H2CO3 + K+ + OH- = K+ + HCO3- + H2O H2CO3 + OH- = HCO3- + H2O.
KHCO3 – гидрокарбонат калия (кислая соль).
Основные соли (гидроксосоли) образуются при частичном замещении гидроксидионов в молекуле основания кислотными остатками.
Основные соли могут быть образованы только многокислотными основаниями в тех случаях, когда количества кислоты недостаточно для получения средней соли:
Cu(OH)2 + HNO3 = CuOH(NO3) + H2O
недостаток
Cu(OH)2 + H+ + NO3- = CuOH+ + NO3- + H2O Cu(OH)2 + H+ = CuOH+ + H2O.
CuOH(NO3) –нитрат гидроксомеди (II) (основная соль).
Соли вступают в химические реакции с кислотами, растворимыми основаниями и другими солями. Обязательным условием последнего процесса является растворимость обеих солей в воде (см. табл. 3 приложения).
Примеры:
1) BaCl2 + H2SO4 = BaSO4↓+ 2HCl
Ba2+ + 2Cl- + 2H+ + SO42+ = BaSO4↓+ 2H+ + 2Cl- Ba2+ + SO42+ = BaSO4↓,
2) CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
Cu2+ + SO42- +2K+ + 2OH- = Cu(OH)2↓ + 2K+ + SO42- Cu2+ + 2OH- = Cu(OH)2↓,
3) NaCl + AgNO3 = AgCl↓ + NaNO3
Na+ + Cl- + Ag+ + NO3- = AgCl↓ + Na+ NO3-
Cl- + Ag+ = AgCl↓.
1.5. Примеры выполнения индивидуальных заданий по разделу «Свойства
неорганических соединений.Закон эквивалентов»
Пример 1. Осуществить превращения веществ согласно схеме: Cu→CuCl2→Cu(OH)2→Cu(OH)(NO3) →Cu(NO3)2
↓
Cu(NO3)2→Cu(OH)2, уравнения реакций записать в молекулярном и ионно-молекулярном виде.
При составлении уравнений реакций пользуются теоретическим материалом разд. 1 и табл. 1–3 приложения (названия неорганических кислот и их солей, таблица констант диссоциации некоторых кислот и оснований, таблица растворимости кислот, оснований и солей в воде).
При составлении ионно-молекулярных уравнений реакций, протекающих в водной среде, необходимо помнить, что формулы газообразных веществ, нерастворимых в воде соединения, а так же веществ, не распадающихся в воде на ионы (слабые электролиты, оксиды) записывают в виде молекул.
1)Cu→CuCl2 – реакцию можно осуществить путем непосредственного взаимодействия меди с хлором (активным галогеном):
Cu + Cl2 = CuCl2.
2)CuCl2→Cu(OH)2 – реакция взаимодействия соли с растворимым основанием:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu2+ + 2Cl- + 2Na+ + 2OH- = Cu(OH)2 + 2Na+ + 2Cl- Cu2+ + 2OH- = Cu(OH)2.
3)Cu(OH)2→Cu(OH)(NO3) – реакция основания с недостатком кислоты и получением гидроксосоли:
Cu(OH)2 + HNO3 = CuOH(NO3) + H2O
недостаток
Cu(OH)2 + H+ + NO3- = CuOH+ + NO3- + H2O Cu(OH)2 + H+ = CuOH+ + H2O.

4) Cu(OH)(NO3) →Cu(NO3)2 – реакция гидроксосоли с избытком кислоты и получением средней соли:
Cu(OH)(NO3) + HNO3 = Cu(NO3)2 + H2O
CuOH+ + NO3- + H+ + NO3- = Cu2+ + 2NO3- + H2O CuOH+ + H+= Cu2+ + H2O.
5)Cu→Cu(NO3)2 – реакция меди с раствором азотной кислоты:
4HNO3 + Cu = Cu(NO3)2 +2NO2↑ + 2H2O
++ 4NO3- + Cu0 = Cu2+ + 2NO3- + 2NO2 + 2H2O4H
4H+ + 2NO3- + Cu0 = Cu2+ + 2NO2 + 2H2O.
6) Cu(NO3)2→Cu(OH)2 – реакция соли с растворимым основанием:
Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
Cu2+ + 2NO3- + 2K+ + 2OH- = Cu(OH)2↓ + 2K+ + 2NO3- Cu2+ + 2OH- = Cu(OH)2↓.
Пример 2. Определить молярную массу эквивалента Se  в соединениях: Na2Se, SeO2, H2SeO4. Рассчитать молярную массу эквивалента каждого из этих соединений.
в соединениях: Na2Se, SeO2, H2SeO4. Рассчитать молярную массу эквивалента каждого из этих соединений.
Для расчета  в указанных соединениях воспользуемся формулой (4), предварительно определив валентность (Z) Se в каждом из соединений. Валентность Se определяем из условия, что сумма степеней окисления атомов в
в указанных соединениях воспользуемся формулой (4), предварительно определив валентность (Z) Se в каждом из соединений. Валентность Se определяем из условия, что сумма степеней окисления атомов в
молекуле равна нулю:
Na2+ Se-2, Se+4O2-2, H2+Se+6O4-2. Молярная масса атома Se равна 79 г/моль.
 в Na2Se
в Na2Se  г/моль;
г/моль;
в SeO2 |
г/моль; |
в H2SeO4 |
г/моль. |
Таким образом, если элемент проявляет переменную валентность в соединениях, его эквивалент и молярная масса эквивалента не является величиной постоянной.
Для определения молярной массы эквивалента каждого соединения воспользуемся формулами (8)–(11), определив предварительно класс каждого из веществ:
Na2Se – соль; SeO2 – оксид, H2SeO4 – кислота.
 г/моль;
г/моль;
 г/моль;
г/моль;
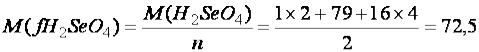 г/моль.
г/моль.
Пример 3. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найти молярную массу эквивалента железа, если валентность серы в сульфиде равна 2.
Так как сульфид железа – бинарное соединение, то масса серы в нем равна: 8,8 – 5,6 = 3,2 г. Согласно закону эквивалентов (см. формулу (6)), массы взаимодействующих веществ пропорциональны их молярным массам эквивалентов, следовательно:

.
Для расчета  дополнительно по формуле (4) рассчитаем:
дополнительно по формуле (4) рассчитаем:
 г/моль.
г/моль.
 г/моль.
г/моль.
Пример 4. 1,75 г 2-валентного металла вытесняет из кислоты 700 мл водорода (нормальные условия). Определить: какой это металл.
Для решения задачи воспользуемся формулой закона эквивалентов 7, когда одно из веществ в реакции – газ:
.
Зная, что молярный объем эквивалента водорода
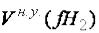 = 11,2 л/моль (см. п. 1.3.4),
= 11,2 л/моль (см. п. 1.3.4),
рассчитаем г/моль. Учитывая, что валентность металла равна 2, по формуле (4) определим молярную
массу металла:  г/моль. По периодической системе элементов определяем, что данный металл – железо (Fe).
г/моль. По периодической системе элементов определяем, что данный металл – железо (Fe).
1.6.Индивидуальные задания
1.6.1.№ 1 Свойства неорганических соединений
Осуществить превращения веществ согласно указанной схеме (табл. 1). Записать уравнения реакций в молекулярной и ионно-молекулярной
форме. Указать класс веществ и дать названия основным исходным веществам и продуктам реакции.
Таблица 1
Номер |
Схема процесса превращения веществ |
|
варианта |
||
|
||
|
Mg→MgSO4→Mg(OH)2→MgCO3→MgO→ Mg |
|
1 |
↓ |
|
|
MgCl2→Mg |
|
|
MnO→MnCl2→Mn(OH)2→Mn(OH)4→Mn(SO4)2 |
|
2 |
↓ |
|
|
Na2[Mn(OH)6] |
|
|
C→CO2→H2CO3→CaCO3→Ca(HCO3)2→NaHCO3. |
|
3 |
↓ |
|
|
СaO |
|
|
Al→Al2(SO4)3→Al(OH)3→Na[Al(OH)4] |
|
4 |
↓ |
|
|
AlCl3→Al |
|
|
|

Продолжение табл. 1 |
||
|
|
|
Номер |
Схема процесса превращения веществ |
|
варианта |
||
|
||
|
CrO→Cr(OH)3→CrCl3→Cr→Cr2(SO4)3 |
|
5 |
↓ |
|
|
K3[Cr(OH)6] |
|
|
S→SO2→SO3→H2SO4→ZnSO4 |
|
6 |
↓ |
|
|
SO2 |
|
7 |
H2→H2O→NaOH→NaHCO3→H2O→H2 |
|
|
Cu→CuSO4→Cu(OH)2→Cu(OH)(NO3) →Cu(NO3)2 |
|
8 |
↓ |
|
|
Cu→ CuCl2 |
|
|
Fe→Fe(OH)3→FeOHCl2→FeCl3→Fe(SCN)3 |
|
9 |
↓ |
|
|
FeSO4→Fe2(SO4)3 |
|
10 |
CaCO3→CaO→Ca(OH)2→ CaCO3→Ca(HCO3)2→CaCl2 |
|
|
Zn→ZnSO4→Zn(OH)2→ZnOHCl→ZnCl2 |
|
11 |
↓ |
|
|
Na2[Zn(OH)4] |
|
|
N2→NO→NO2→HNO3→Cu(OH)NO3→Cu(NO3)2 |
|
12 |
↓ |
|
|
NO2 |
|
|
BeCl2→Be→Be(NO3)2→Be(OH)2→Na2[Be(OH)4] |
|
13 |
↓ |
|
|
BeO→Be |
|
|
Fe→FeSO4→Fe(OH)2→Fe(OH)3→FeCl3 |
|
14 |
↓ |
|
|
Fe(OH)NO3→Fe(NO3)2 |
|
|
Ni→Ni(NO3)2→Ni(OH)2→ NiOHCl→NiCl2 |
|
15 |
↓ |
|
|
NiO→Ni |
|
16 |
CaO→CaCO3→ CaO→Ca→CaSO4→Ca(OH)2→ CaCO3→Ca(HCO3)2 |
|
|
|
|
|
Na→NaOH→NaHCO3→Na2CO3→Na2SO4 |
|
17 |
↓ |
|
|
NaCl→Na→ NaOH→Na2[Be(OH)4] |
|
|
Ba→BaCl2→Ba(OH)2→BaCO3→BaO |
|
18 |
↓ |
|
|
BaSO4 |
|
|
Cd→Cd(NO3)2→Cd(OH)2→[Cd(NH3)6](OH)2→CdSO4 |
|
19 |
↓ |
|
|
CdCl2→Cd |
|
|
Pb→Pb(NO3)2→Pb(OH)2→Na4[Pb(OH)6] →PbSO4 |
|
20 |
↓ |
|
|
PbJ2 |
|
Окончание табл. 1 |
||
|
|
|
Номер |
Схема процесса превращения веществ |
|
варианта |
||
|
||
|
SnCl2→Sn(OH)2→Na2[Sn(OH)4] |
|
21 |
↓ |
|
|
|
|

|
SnCl4→H2SnO3→ Na2[Sn(OH)6] |
|
FeS→H2S→SO2→Na2SO3→H2SO3→KHSO3 |
22 |
↓ |
|
H2SO4→BaSO4 |
|
Ag→AgNO3→AgOH→Ag2O |
23 |
↓ |
|
AgCl→[Ag(NH3)2]Cl |
|
K→K2O→KOH→K2CO3→KOH→K2[Zn(OH)4] |
24 |
↓ |
|
K2SO4 |
|
Cl2→HCl→CuOHCl→CuCl2→Cu→Cu(NO3)2 |
25 |
↓ |
|
AgCl |
|
Ca→CaCl2→Ca(OH)2→CaCO3→Ca(HCO3)2 |
26 |
↓ |
|
CaO→Ca |
|
KMnO4→MnSO4→Mn(OH)2→ Mn(OH)4 |
27 |
↓ |
|
Mn→MnCl2 |
|
Сu→CuCl2→Cu(OH)2→(CuOH)2SO4→CuSO4 |
28 |
↓ |
|
Cu→Cu(NO3)2 |
|
B→B2O3→H3BO3→Na3BO3 |
29 |
↓ |
|
HBO2→ B2O3 |
|
Al→Al2O3→AlCl3→Al(OH)3→Al2(SO4)3 |
30 |
↓ |
|
Al→ Al(OH)3→Na[Al(OH)4] |
|
|
1.6.2. № 2 |
Эквивалент, закон эквивалентов |
||
Таблица 2 |
|
||
|
|
|
|
Номер |
Условия задач |
||
варианта |
|||
|
|
||
|
1. |
Рассчитать молярную массу эквивалента хрома M(fCr) в соединениях: |
|
|
CrCl3, H2Cr2O7, CrO. |
||
1 |
2. |
Вычислить молярную массу эквивалента азота M(fN) в оксиде, содер- |
|
|
жащем 36,86 % азота. Определить валентность азота в этом соединении и |
||
|
составить формулу оксида. |
||
|
1. |
Рассчитать молярную массу эквивалента ванадия M(fV) в соединениях: |
|
2 |
VH, V2O5, V(OH)2. |
||
2. |
При растворении 0,0547 г металла в кислоте выделилось 50,4 мл во- |
||
|
|||
|
дорода (условия нормальные). Определить M(fМе). |
||
Продолжение табл. 2 |
|||
|
|
|
|
Номер |
Условия задач |
||
варианта |
|||
|
|
||
|
1. |
Рассчитать молярную массу эквивалента соединений: CrCl3, H2Cr2O7, CrO. |
|
3 |
2. |
Определить молярную массу эквивалента металла M(fМе), если его оксид |
|
|
содержит 60 % кислорода. |
||
|
1. |
Рассчитать молярную массу эквивалента серы M(fS) в соединениях: SO2, |
|
|
H2S, Na2SO4. |
||
4 |
2. |
1 г 4-валентного металла соединяется с 0,27 г кислорода. Вычислить |
|
|
молярную массу эквивалента металла M(fМе) и молярную массу металла |
||
|
M(Ме). |
||
|
|
|
|

|
1. |
Рассчитать молярную массу эквивалента марганца M(fMn) в соединениях: |
|
|
KMnO4, H2MnO4, Mn(OH)2. |
||
5 |
2. |
2 г 2-валентного металла вытесняют из кислоты 1,12 л водорода (условия |
|
|
нормальные). Вычислить молярную массу эквивалента металла M(fМе) и |
||
|
молярную массу металла M(Ме). |
||
|
1. |
Рассчитать молярную массу эквивалента соединений: KMnO4, H2MnO4, |
|
6 |
Mn(OH)2. |
||
2. |
При сгорании 1,19 г металла образовалось 1,51 г оксида. Вычислить |
||
|
|||
|
молярную массу эквивалента металла и его оксида. |
||
|
1. |
Рассчитать молярную массу эквивалента хлора M(fCl) в соединениях: |
|
|
Cl2O5, HClO4, KCl. |
||
7 |
2. |
1,6 г Са и 2,62 г другого металла вытесняют из кислоты одинаковые |
|
|
объемы водорода. Вычислить молярную массу эквивалента этого металла |
||
|
M(fMе). |
||
|
1. Рассчитать молярную массу эквивалента соединений: Cl2O5, HClO4, KCl. |
||
8 |
2. |
Сульфид металла содержит 48 % S. Определить M(fMе), учитывая, что |
|
валентность серы в сульфиде равна 2. Рассчитать молярную массу экви- |
|||
|
|||
|
валента сульфида M(fMехSу). |
||
|
1. |
Рассчитать молярную массу эквивалента азота M(fN) в соединениях: NH3, |
|
9 |
NO2, Cu(NO3)2. |
||
2. |
На нейтрализацию 2, 25 г кислоты израсходовано 2 г NaOH. Вычислить M(f |
||
|
|||
|
кислоты). |
||
1. Рассчитать молярную массу эквивалента соединений: NH3, NO2, Cu(NO3)2.
102. Определить молярную массу эквивалента элемента M(fЭ), если его водородное соединение содержит 5 % Н. Определить молярную массу эквивалента всего соединения.
1.Рассчитать молярную массу эквивалента фосфора M(fP) в соединениях:
11PH3, P2O5, H3PO4.
3.Определить процентное содержание металла в оксиде, если M(fМе) равна
9г/моль.
1. Рассчитать молярную массу эквивалента соединений: P2O5, H3PO4,
Cu3(PO4)2.
122. Оксид хрома содержит 31,6 % кислорода. Рассчитать M(fCr) в этом соединении, определить валентность Cr и записать химическую формулу оксида.
Продолжение табл. 2
Номер |
Условия задач |
|
варианта |
||
|
||
|
1. Определить молярную массу эквивалента металла М(fMe) в соединениях: |
13PbO2, Al2(SO4)3, MnО.
2. На окисление 5 г металла пошло 1,4 л О2 (условия нормальные). Определить М(fMe) и М(f оксида).
1. Рассчитать молярную массу эквивалента соединений: PbO2, Al2(SO4)3, HMnO4.
142. Оксид хрома содержит 48 % кислорода. Рассчитать M(fCr) в этом соединении, определить валентность Cr и записать химическую формулу оксида.
1.Определить молярную массу эквивалента молибдена М(fMо) в соеди-
15нениях: Mo2O3, H2Mo2O7, Mo(SO4).
2.0,18 г металла соединяется с 84 мл О2 (условия нормальные). Вычислить M(fМе) и M(f оксида).
1. Рассчитать молярную массу эквивалента оксидов M(f оксидов): J2O5, MgO,
16CrO3.
2. Из 43,4 г оксида получено 40,2 г металла. Определить M(fМе) и M(f оксида).

1. Рассчитать молярную массу эквивалента элемента, образующего оксид:
17J2O5, MgO, CrO3.
2. 0,1325 г соли реагирует с 0, 0925 г Ca(OH)2. Вычислить M(f соли).
1. Определить молярную массу эквивалента хрома М(fCr) в соединениях:
18K2Cr2O7, Cr2(SO4)3, CrO3.
2. При восстановлении 2,32 г оксида вольфрама водородом образовалось0,54 г воды. Определить M(f W) в оксиде.
1. Определить молярную массу эквивалента соединений: K2Cr2O7, Cr2(SO4)3, CrO3.
192. 4 г 2-валентного металла вытесняет из кислоты 2, 24 л Н2 (нормальные условия). Вычислить М(fМе), молярную массу металла М(Ме), назвать металл.
1. Определить молярную массу эквивалента иода М(fJ) в соединениях: KJ,
J2O7, HJO3.
202. В оксиде на 2 атома металла приходится 3 атома кислорода. Вычислить молярную массу металла и определить, какой это металл, если содержание кислорода в оксиде равно 47 %.
1.Определить молярную массу эквивалента брома М(fBr) в
21соединениях: NaBr, HBrO3, KBrO4.
2.Для растворения 16,86 г металла потребовалось 14,7 г H2SO4. Определить М(fМе).
1. Определить молярную массу эквивалента соединений: H2SO4, Na2SO3,
22FeS.
2. Определить молярную массу эквивалента металла, если при соединении3,6 г этого металла с хлором было получено 14,1 г хлорида металла.
Окончание табл. 2 |
||
|
|
|
Номер |
Условия задач |
|
варианта |
||
|
||
|
1. Определить молярную массу эквивалента соединений: PbJ2, J2O7, HJO3. |
|
23 |
2. 0,18 г 2-валентного металла соединяется с 0,12 г кислорода. |
|
Определить М(fМе) и молярную массу металла. Какой металл вступил в |
||
|
||
|
реакцию? |
|
1. Определить молярную массу эквивалента серы М(fS) в соединениях:
H SO , Na SO , FeS.
242. При сжигании 10 г простого вещества было получено 20 г оксида. Определить молярную массу эквивалента элемента и образовавшегося оксида.
1.Определить молярную массу эквивалента мышьяка М(fAs) в соединениях:
As2O3, HAsO3, Ni(AsO2)2
252. Какое весовое количество металла, М(fМе) равна 29,36 г/моль, вытесняет из кислоты 105 мл Н2 (условия нормальные)?
1.В каком количестве Cr(OH)3 содержится столько же эквивалентов, сколько в 174,96 г Mg(OH)2?
262. При взаимодействии 3.24 г 3-валентного металла с кислотой выде-
лилось4,03 л Н2 (н.у.). Вычислить: М(fМе) и молярную массу металла М(Ме).
1.Определить молярную массу эквивалента селена М(fSe) в соединениях:
27H2SeO4, SeO2, Na2Se.
2.В 2,48 г оксида металла содержится 1,84 г металла. Вычислить молярную массу эквивалента металла и его оксида.2 4 2 3
1. Определить молярную массу эквивалента соединений: H2SeO4, SeO2,
28Na2Se.
2. Некоторое количество металла, М(fМе) равна 27,9 г/моль, вытесняет из кислоты 700 мл Н2 (н.у.). Определить массу металла.

1. Определить молярную массу эквивалента соединений: As2O3, HAsO3,
29Ni(AsO2)2.
2. Оксид мышьяка содержит 65,2 % As. Определить: молярную массу эквивалента мышьяка М(fAs), его валентность и записать формулу оксида.
|
1. Определить молярную массу эквивалента хлора М(fCl) в соединениях: |
||
30 |
ClO2, KClO4, CaCl2. |
|
|
2. 8,34 г 2-валентного металла окисляются 0,680 л О2 |
(н.у.). Рассчитать М(fМе), |
||
|
|||
|
молярную массу металла М(Ме) и определить, какой это металл. |
||
|
1.6.3. Тесты промежуточного контроля |
|
|
1. Число Авогадро равно:
а) 22,4 л/моль – объем 1 моля газа (н.у); б) 6,02·1023 – количество структурных единиц (атомов, ионов, молекул) в одном
моле любого вещества; в) 101,325 кПа – нормальное атмосферное давление;
г) числу атомов, входящих в состав молекулы, переменная величина.
2.Установить соответствие:
1)K2O, MgO – а) амфотерные оксиды,
2)SO3, P2O5 – б) основные оксиды,
3)Al2O3, ZnO – в) кислотные оксиды,
4)CaО, SO2 – г) основной и кислотный оксиды.
3.Совместное присутствие в растворе следующих соединений не возможно в случае:
а) Ba(OH)2 и HCl; б) CaCl2 и NaOH;
в) NaCl и AgNO3;
г) KCl и NaNO3, ответ обосновать уравнениями.
4. Молярная масса S (серы) М(S) = 32 г/моль, а молярная масса эквивалента серы М(fS) = 5,33 г/моль в соединении:
а) H2S;
б) SO2;
в) Na2SO3;
г) H2SO4.
5. При одинаковых условиях взяты равные объёмы N2 и O2. Установить верное равенство:
а) mO2 = mN2;
б) ۷молейO2 = ۷молейN2; в) МО2 = МN2.
6.Mолем вещества называется: количество вещества, содержащее столько структурных единиц (атомов, молекул или ионов), сколько их содержится в
……………………...
7.Указать последовательность соединений Mn, в которых валентность его возрастает от 2 до 7:
а) MnSO4, MnO3, KMnO4, Mn(OH)4; б) MnO, Mn2O3, Mn(OH)4, KMnO4;
в) K2MnO4, Mn2O5, MnCl4, HMnO4;
г) MnO3, Mn(OH)4, MnSO4, H2MnO4.
8. Основаниями называются:
а) вещества, диссоциирующие в растворах с образованием гидроксид-ионов или способные присоединять ионы водорода;
