
Химия Соснина
.pdf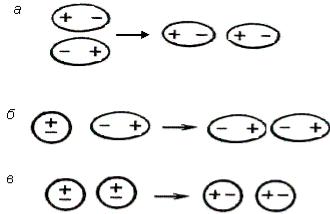
В результате поляризующего действия катиона внешнее электронное облако аниона смещается. Происходит частичный обратный перенос электронного заряда от аниона к катиону. Следовательно, ионную связь можно рассматривать как предельный случай полярной ковалентной связи. Поляризация ионов оказывает заметное влияние на свойства образуемых ими соединений. Так как с усилением поляризации ионов возрастает степень ковалентности связи, это сказывается на ослаблении диссоциации солей
вводных растворах.
2.2.5.Межмолекулярное взаимодействие
К основным видам взаимодействия между молекулами в жидком и твердом состоянии вещества следует отнести вандерваальсовы силы, водородные связи и донорноакцепторные связи.
Донорно-акцепторное взаимодействие между молекулами (ионами) чаще всего проявляется при образованиикомплексных или координативных соединений . Если одна из двух молекул (ионов) имеет атом со свободными орбиталями, а другая – с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, приводящее к образованию ковалентной связи. Более подробно процесс образования данного вида ковалентной связи описан в п. 2.2.1.
В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Позднее эти силы получили название вандерваальсовых сил. Они включают три составляющие: ориентационное, индукционное и дисперсионное взаимодействие (рис. 16).
Рис. 16. Вандерваальсовы взаимодействия молекул: а – ориентационное, б – индукционное; в – дисперсионное
Ориентационное взаимодействие (диполь-дипольное) возникает при сближении полярных молекул, ориентированных друг к другу противоположно заряженными полюсами. Чем больше расстояние между молекулами, тем слабее энергия взаимодействия ЕОР.
Индукционное взаимодействие возникает между диполями и неполярными молекулами, причем полярная молекула индуцирует (поляризует) неполярную молекулу. Энергия индукционного взаимодействия ЕИНД возрастает с увеличением поляризуемости молекул, однако она значительно меньше энергии ориентационного взаимодействия.
Дисперсионное взаимодействие возникает между неполярными молекулами. В любой молекуле возникают флуктуации электрической плотности, что приводит к появлению мгновенных диполей, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. Энергия дисперсионного взаимодействия ЕДИС очень слабая, однако, для неполярных молекул этот вид взаимодействия является единственной составляющей вандерваальсовых сил.
Практически в конденсированном состоянии вещества проявляются все три типа взаимодействия. Общая энергия взаимодействия между молекулами ЕОБЩ является суммарной величиной:
ЕОБЩ = ЕОР + ЕИНД + ЕДИС. |
(15) |
Соотношение между величинами этих видов энергии определяется типом молекул, преобладающих в данном конденсированном веществе.
Особым видом межмолекулярного взаимодействия является водородная связь. Водородной связью называется химическая связь, образованная положительно поляризованным атомом водорода Н одной молекулы и
электроотрицательным атомом О, N, F и др. другой молекулы. Водородные связи характерны как для жидкого, так и для твердого состояния вещества. В жидком состоянии водородные связи приводят к образованию ассоциированных молекул: димеров, тримеров (Н2О)3, в твердом состоянии – к образованию кристаллов.
Образование водородной связи обусловлено тем, что в полярных молекулах HF, H2O
ипр. поляризованный атом водорода Н характеризуется очень малым размером, полным отсутствием электронной оболочки атома и значительным сдвигом общей электронной пары к атому с высокой электроотрицательностью. Такой атом водорода способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома (аниона), вызывая ее сильную деформацию. Таким образом, природа водородной связи – электростатическое взаимодействие поляризованных атомов и, частично, образование донорно-акцепторных связей:
Энергия водородной связи занимает промежуточные значения между энергией ковалентной связи и вандерваальсовых сил и увеличивается с ростом электроотрицательности соседнего атома.
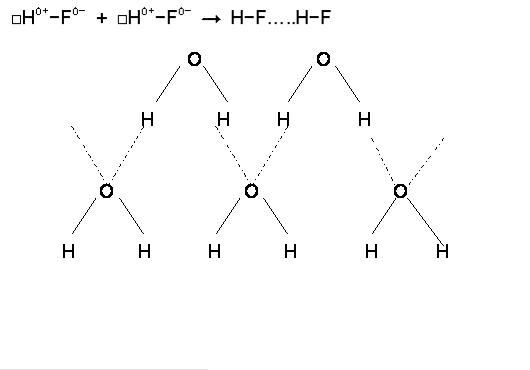
Пример: схемы образования водородных связей между молекулами фтороводорода
иводы:
Образование водородных связей приводит к изменению свойств конденсированного вещества: изменяется вязкость, диэлектрическая проницаемость, температура кипения, плавления и пр., важную роль водородные связи играют в природных полимерах.
В настоящем учебном пособии даются только основные понятия ММО и общие принципы при изображении энергетических схем наиболее простых молекул. Более подробно с ММО можно ознакомиться в основной учебной литературе.
Более подробно о структуре и свойствах этих соединений смотрите в основной учебной литературе.
2.3. Строение и свойства твердых веществ

2.3.1. Характерные особенности веществ в различных агрегатных состояниях 2.3.2. Аморфное и кристаллическое состояние вещества, типы кристаллических
структур 2.3.3. Понятие о зонной теории строения кристаллов. Проводники, полупроводники,
изоляторы 2.3.4. Реальные кристаллы, полупроводники с примесными дефектами
2.3.1. Характерные особенности веществ в различных агрегатных состояниях
Вещества могут находиться в трех физических состояниях: газообразном, жидком и твердом. При очень высоких температурах возможно особое состояние сильно разряженных газообразных веществ – плазма.
Газообразные вещества имеют, в основном, молекулярную структуру. Молекулы находятся друг от друга на значительном расстоянии, взаимодействие между ними практически отсутствует. Движение частиц (молекул) – хаотичное, беспорядочное. Кинетическая энергия молекул газа больше потенциальной (ЕК > ЕП).
В жидком состоянии расстояния между частицами (молекулами, ионами) соизмеримы с размерами самих частиц и значительно меньше, чем в газообразном состоянии. В структуре наблюдается некоторая временная упорядоченность частиц, которые постоянно соприкасаются друг с другом. Между частицами существуют силы межмолекулярного взаимодействия. Частицы подвижны относительно друг друга, поэтому жидкости обладают текучестью. Кинетическая энергия частиц жидкости соответствует потенциальной (ЕК ≈ ЕП).
В твердом состоянии частицы (атомы, молекулы, ионы) сближены друг с другом на min допустимые расстояния. Между частицами действуют прочные связи различного типа. Частицы находятся в колебательном движении. Кинетическая энергия частиц
твердого вещества меньше потенциальной (ЕК частиц в твердом веществе |
< ЕП). |
|||||||
|
Соответственно свойства веществ в различных физических состояниях существенно |
|||||||
различаются (табл. 3). |
|
|
|
|
|
|||
|
Таблица 3 |
|
|
|
|
|
||
Свойства веществ в различных физических состояниях |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Физическое состояние |
|
|
|
|
Свойство |
|
|
|
|
|
|
|
|
|
газообразное |
|
жидкое |
|
твердое |
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
1. |
Объем |
|
Совпадает |
|
Совпадает |
|
Фиксированный |
|
|
|
|
|
с объемом сосуда |
|
с объемом сосуда |
|
|
2. Зависимость |
|
Высокая |
|
Малая |
|
Очень малая |
||
объема от темпе- |
|
|
|
|
|
|
||
ратуры и давления |
|
|
|
|
|
|
||
3. |
Форма |
|
Принимает форму |
|
Принимает |
|
Фиксированная |
|
|
|
|
|
сосуда |
|
форму сосуда |
|
|
4. |
Сжимаемость |
|
Очень высокая |
|
Незначительная |
|
Практически |
|
|
|
|
|
|
|
|
|
отсутствует |
5. |
Текучесть |
|
Очень |
|
Высокая |
|
При обычных |
|
|
|
|
|
высокая |
|
|
|
температурах |
|
|
|
|
|
|
|
|
отсутствует |
6. |
Диффузия |
|
|
|
Медленная |
|
Очень медленная |
|
7. |
Плотность |
|
Быстрая |
|
От средней |
|
Большая |
|
|
|
|
|
Низкая |
|
до большой |
|
|
|
|
|
|
|
|
|
|
|
2.3.2. Аморфное и кристаллическое состояние вещества, типы кристаллических структур
В зависимости от расположения частиц в пространстве твердые вещества могут находиться в аморфном и кристаллическом состоянии (рис. 17).

Вещества в аморфном состоянии не имеют упорядоченной структуры, т. е. для них, как и для жидкостей характерен ближний порядок. Такие вещества изотропны, т.е. имеют одинаковые свойства (механические, оптические, магнитные) во всех направлениях. Некоторые из них, подобно жидкости, обладают текучестью (смола хвойных деревьев на плоской поверхности в теплом помещении растекается и принимает форму диска). Кроме того, аморфные вещества плавятся не при строго определенной температуре, а в некотором температурном интервале. Неупорядоченность структуры аморфных веществ приводит к их высокой внутренней энергии, поэтому такие вещества термодинамически не стабильные и имеют низкую распространенность в природе (оксиды кремния, бора, смола). Чаще аморфной структурой обладают вещества, полученные искусственным путем: полимеры, стекло и пр.
,
Некоторые металлы и сплавы (Ti, Au, Sr и др.) в последнее время пытаются получить в аморфном состоянии, хотя обычно они имеют кристаллическую структуру. Обладая изотропностю, такие сплавы на 30–40 % прочнее кристаллических, у них в десятки раз выше коррозионная стойкость,
очень высокая магнитная проницаемость. Недостатком аморфных сплавов является температурная нестабильность.
При достижении определенной температуры аморфная структура сплава нарушается, появляются центры кристаллизации и теряются ценные свойства.
Подавляющее большинство твердых веществ находится в кристаллическом состоянии. Кристаллами называются твердые вещества, которые имеют правильное периодическое расположение частиц (атомов, молекул или ионов), т. е. характеризуются дальним порядком (трехмерная периодическая структура по всему объему твердого тела). Упорядоченная структура вещества характеризуется меньшей
величиной внутренней энергии. Кристаллическое состояние вещества термодинамически более устойчиво, чем аморфное, поэтому вещества в таком состоянии очень часто встречаются в природе. Однако существуют твердые вещества, для которых аморфное состояние термодинамически более выгодно, чем кристаллическое (пластмассы, органические стекла и пр.). Сложная специфическая форма макромолекул таких веществ делает энергетически не выгодной периодически правильную упаковку в структуре.
Кристаллические вещества делятся на моно- и поликристаллы, которые состоят из множества кристаллов различной величины, ориентированных по разным осям координат. Монокристаллы – выпуклые многогранники,
характеризующиеся однородностью, симметрией и анизотропией. Анизотропия монокристаллов проявляется в зависимости свойств от направления в пространстве. В поликристаллических телах анизотропия не проявляется. Все монокристаллы характеризуются способностью к самоогранению, которая подчиняется закону «гранных углов»: как бы ни была искажена форма кристалла при его произрастании в природе, углы, под которыми сходятся грани кристалла, относящегося к одной и той же полиморфной модификации, при одинаковых условиях постоянны.
Кристаллические вещества плавятся при определенной температуре, которая называется температурой плавления. При нагревании кристаллического вещества практически невозможно превысить его температуру плавления, пока вещество полностью не расплавится.
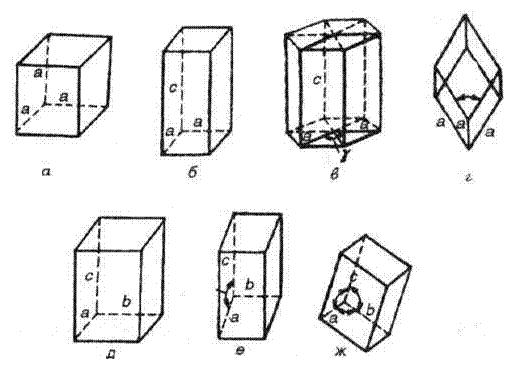
Геометрические формы кристаллов различны (см. рис. 18) и зависят от природы и размера частиц, образующих кристалл, вида химической связи между ними и других факторов.
Рис. 18. Геометрическая форма кристаллов: а – кубическая; б – тетраэдрическая; в – гексагональная; г – ромбоэдричесая; д – орторомбическая; е – моноклинная; ж – триклинная
Внешняя форма кристалла является следствием его внутреннего строения. Определенное расположение частиц в пространстве, обусловливающее структуру и свойства данного кристалла, называют пространственной кристаллической решеткой.
Кристаллы характеризуются энергией, постоянной кристаллической решетки и координационным числом.
Энергией кристаллической решетки ЕКР, кДж/моль, называют энергию,
необходимую для разрушения 1 моля кристаллического вещества и удаления частиц его образующих, за пределы их взаимодействия. Величина ЕКРявляется мерой прочности кристалла, чем она выше, тем прочнее кристалл.
Постоянная кристаллической решетки d, Ǻ – это расстояние между центрами частиц в узлах кристаллической решетки в направлении характеристических осей.
Координационным числом (к.ч.) называют число частиц, непосредственно примыкающих к данной частице в кристалле. К.ч. может принимать значения от 2 до 12 в зависимости от строения внешнего энергетического уровня атомов, образующих кристалл. Чем больше величина к.ч., тем плотнее упаковка кристалла.
Некоторые вещества близкой химической природы, например, Ca2SiO4 и Mg2SiO4 образуют одинаковые кристаллические структуры. Такие вещества
называются изоморфными. Кристаллические решетки изоморфных веществ отличаются необычной подвижностью и взаимозаменяемостью отдельных компонентов, что возможно в случае, если размеры частиц, образующих решетки, отличаются не более чем на 15 %. Многие простые вещества или соединения могут существовать в двух или более
кристаллических структурах. Такое явление называется полиморфизмом (пример – аллотропные модификации углерода: алмаз, графит, карбин, фуллерен). Проявление полиморфизма наблюдается в том случае, когда один и тот же атом имеет разную степень возбуждения валентных электронных орбиталей, а, следовательно, и степень гибридизации.
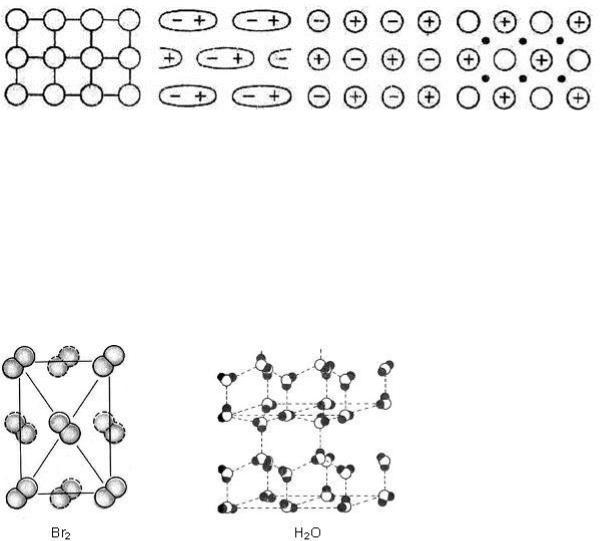
В зависимости от природы частиц, находящихся в узлах кристаллической решетки, а также от характера связи между ними все кристаллы делятся на молекулярные, атомноковалентные, ионные и металлические (рис. 19). Кроме того, существуют кристаллы со смешанными химическими свойствами.
атомная |
молекулярная |
ионная |
металлическая |
Рис. 19. Основные типы структур твердого вещества
Молекулярные кристаллы. В узлах решетки находятся полярные или неполярные молекулы, связанные слабыми межмолекулярными связями (вандерваальсовы силы, водородные связи, см. п. 2.2.5). Это и определяет свойства молекулярных кристаллов: малая прочность, хрупкость, низкая температура плавления, небольшая плотность, многие вещества обладают характерным перламутровым блеском, летучестью, являются хорошими изоляторами. К кристаллам с подобного типа кристаллической решеткой относятся газы в твердом состоянии (N2, CO2, CH4, O2), многие органические кислоты в твердом состоянии, твердые инертные газы, твердые иод J2, бром Br2, вода и др. (рис.
20).
Рис. 20. Структуры молекулярных кристаллов
Атомно-ковалентные кристаллы. В узлах кристаллической решетки находятся атомы, связанные друг с другом прочными ковалентными связями, что обусловливает высокую энергию кристаллической решетки. Такие вещества обладают высокой твердостью и плотностью, очень высокой температурой плавления, бесцветны или окрашены в светлые тона, нерастворимы в полярных растворителях. Вещества с атомноковалентной структурой кристаллической решетки могут быть либо изоляторами, либо полупроводниками, что объясняется различной прочностью ковалентной связи. К веществам такой структуры относятся простые вещества элементов IVA группы (алмаз С, кремний Si, германий Ge), а также бор B и ряд сложных соединений: карборунд SiC, нитрид алюминия AlN и др. (рис. 21).
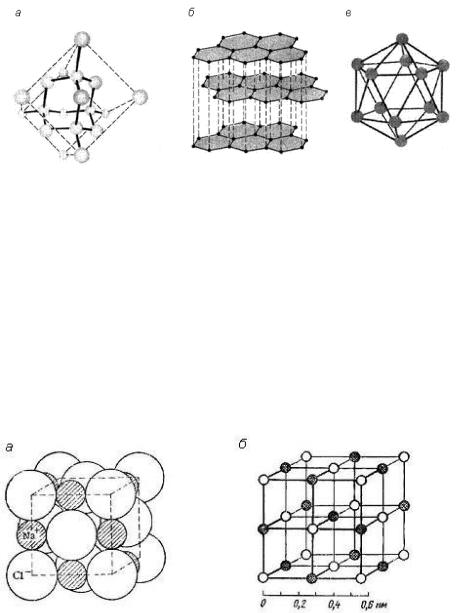
Рис. 21. Структуры атомно-ковалентных кристаллов: а – алмаза; б – графита; в – бора (В12)
Ионные кристаллы. Структурными единицами кристаллов этого типа являются (+) и (–) заряженные простые и сложные ионы (рис. 22), которые связаны между собой электростатическим взаимодействием, что характеризует достаточно высокую энергию кристаллической решетки. Однако прочность связей уступает ковалентным связям в атомно-ковалентных кристаллах, так как наряду с силами притяжения существуют и силы отталкивания между одноименно заряженными ионами. Поэтому плотность, температура плавления, твердость у таких кристаллов ниже, чем у атомно-ковалентных, но выше, чем у молекулярных. К ионным кристаллам относятся соли, оксиды, гидроксиды, комплексные соединения. Многие из этих веществ растворимы в полярных растворителях и при комнатной температуре относятся к классу диэлектриков, однако, с увеличением температуры их электропроводность возрастает, хотя на 20 порядков ниже электропроводности металлов.
Рис. 22. Ионная кристаллическая структура хлорида натрия: а – упаковка ионов в кристалле; б – элементарная ячейка
Металлические кристаллы. В узлах кристаллов этого типа находятся (+) ионы металла, которые погружены в электронный «газ», представляющий собой свободно перемещающиеся в объеме кристалла валентные электроны атомов металлов (рис. 23).
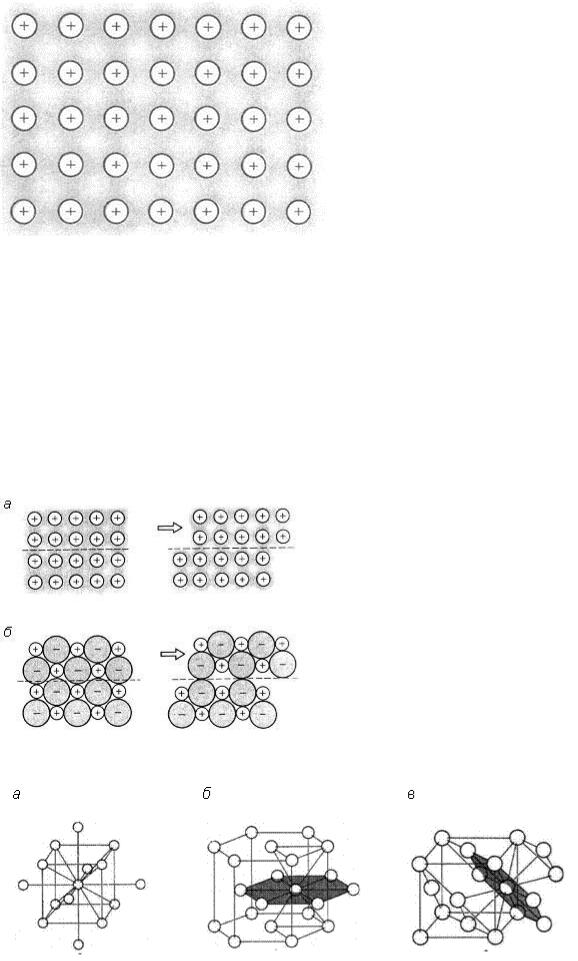
Рис. 23. Схематичное изображение электронного газа в кристалле металла
Таким образом, в кристалле металла устанавливается
равновесие: 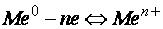 . Связь между атомами металлов в жидком или твердом состоянии вещества, основанная на обобществлении валентных электронов всех атомов является особым типом химической связи и называется металлической связью. Металлическая связь объясняет все специфические свойства металлов: электропроводность, теплопроводность, термоэлектронную эмиссию и пр. Металлическая связь позволяет также значительное смещение (+) ионов относительно друг друга без разрушения связи, поэтому металлы ковки и пластичны (рис. 24). Металлы обладают характерным металлическим блеском и хорошей отражательной способностью, что также объясняется присутствием в структуре кристаллов свободно перемещающихся валентных электронов. На рис. 25 представлены наиболее распространенные кристаллические структуры металлов.
. Связь между атомами металлов в жидком или твердом состоянии вещества, основанная на обобществлении валентных электронов всех атомов является особым типом химической связи и называется металлической связью. Металлическая связь объясняет все специфические свойства металлов: электропроводность, теплопроводность, термоэлектронную эмиссию и пр. Металлическая связь позволяет также значительное смещение (+) ионов относительно друг друга без разрушения связи, поэтому металлы ковки и пластичны (рис. 24). Металлы обладают характерным металлическим блеском и хорошей отражательной способностью, что также объясняется присутствием в структуре кристаллов свободно перемещающихся валентных электронов. На рис. 25 представлены наиболее распространенные кристаллические структуры металлов.
Рис. 24. Сдвиговая деформация: а – кристалла металла без разрушения; б – ионного кристалла с разрушением структуры
Рис. 25. Наиболее распространенные кристаллические структуры металлов: а – объемно-центрированная кубическая (Na,V, Ba); б– гексагональная плотноупакованная (Mg, Cd); в – гранецентрированная кубическая (Al, Cu, Au).
Однако на физические и химические свойства металлов оказывает значительное влияние положение атомов в ПСЭ, поэтому величина энергии кристаллической решетки металлов колеблется от средней (натрий, магнии, алюминий) до очень высокой (титан, марганец, хром); температура плавления – от очень низкой (ртуть, галлий) до очень высокой (вольфрам); широкий диапазон механических свойств. Щелочные металлы мягкие и режутся ножом, хром, кобальт и марганец – сверхтвердые.
Жидкие кристаллы. Некоторые органические вещества в жидком состоянии характеризуются высокой степенью упорядоченности частиц, которая приближается к кристаллическим веществам, одновременно, как жидкости, они обладают текучестью, для них характерна серо-черная окраска. Чаще всего молекулы таких веществ (азосоединения, производные азолитинов и стероидов) имеют удлиненную веретенообразную форму. Структура жидких кристаллов изменяется под влиянием электрических и магнитных полей, механического воздействия. Наличие специфических свойств позволило применять жидкие кристаллы для изготовления экранов телевизоров, дисплеев, мониторов, микрокалькуляторов и пр. При определенной температуре
(t0просветления) их упорядоченная структура нарушается, вещества переходят в обычное жидкое состояние, становятся прозрачными и теряют свои специфические свойства.
Поэтому в паспорте на изделия из жидких кристаллов часто указывается температурный интервал их применения.
2.3.3. Понятие о зонной теории строения кристаллов. Проводники, полупроводники, изоляторы
Все кристаллические вещества по величине электропроводности делятся на 3 группы:
1– проводники I рода (металлы), σ = 104…..106 ом–1·см–1;
2– изоляторы (диэлектрики), σ = 10–22…..10–10 ом–1·см–1;
3– полупроводники, σ = 10–10…..104 ом–1·см–1.
Объяснение этому явлению дает зонная теория строения кристаллов, которая рассматривает твердое вещество как единый комплекс взаимодействующих частиц. Зонная теория – это теория молекулярных орбиталей для систем с очень большим числом атомов.
Основные положения теории.
1.При взаимодействии атомов одного и того же элемента в кристалле происходит перекрытие их атомных орбиталей АО и образование новых молекулярных орбиталей МО. Процесс называется расщеплением атомных орбиталей.
2.Число образующихся МО равно общему числу перекрывающихся АО, они
равноценно принадлежат всем атомам кристалла, но обладают разным уровнем энергии,
т. е. образуются разрешенные молекулярные энергетические уровни. Рассматривая
процесс на конкретном примере кристалла Na (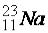 : 1s2 2s2 2p6 3s1), следует отметить, что в образовании структуры кристалла от одного атома Na участвует только одна внешняя 3s1 орбиталь. Если взаимодействуют 2 атома натрия, то образуется 2 МО, 3 атома – 3 МО и т. д.
: 1s2 2s2 2p6 3s1), следует отметить, что в образовании структуры кристалла от одного атома Na участвует только одна внешняя 3s1 орбиталь. Если взаимодействуют 2 атома натрия, то образуется 2 МО, 3 атома – 3 МО и т. д.
3. С ростом числа взаимодействующих атомов в кристалле увеличивается число разрешенных молекулярных энергетических уровней, а энергетический порог между ними уменьшается. Таким образом, в кристалле образуетсянепрерывная энергетическая зона (рис. 26).

Е
Рис. 26. Построение энергетических зон при последовательном присоединении атомов в кристалле
4.Заполнение электронами МО непрерывной энергетической зоны кристалла происходит в порядке возрастания энергии орбитали и согласно принципу Паули: не более 2 электронов с противоположными спинами на одной МО. Если в образовании
кристалла Na участвует n атомов натрия, образуется n МО, но только половина их будет заполнена электронами, поскольку на внешнем 3s1 энергетическом уровне атома Na находится только один электрон.
5.Совокупность МО, заполненных электронами, составляют
валентную зону кристалла. МО, незаполненные электронами, называют зоной проводимости кристалла.
6. В кристаллах металлов валентная зона находится в непосредственной близости от зоны проводимости (рис. 27), т. е. энергетический барьер между ними ∆Е ≈ 0. При незначительном возбуждении электроны валентной зоны легко переходят на свободные МО зоны проводимости, что обеспечивает высокую электропроводность металлов.
Рис. 27. Зонная структура проводников, полупроводников и изоляторов
7.С повышением температуры колебания атомов в узлах кристаллической решетки металлов усиливаются, что затрудняет свободное направленное движение электронов из валентной зоны в зону проводимости. Электропроводность металлов падает.
8.У изоляторов (диэлектриков) зона проводимости отделена от валентной зоны большим энергетическим барьером (запрещенная зона ∆Е > 4 эВ). Даже при передаче большой величины энергии валентным электронам, они не могут преодолеть энергетический барьер и попасть в зону проводимости, а, следовательно, свободно
