
Химия Соснина
.pdfб) соединения элементов с кислородом; в) вещества, диссоциирующие в растворах с образованием ионов водорода, или
являющиеся донорами протонов; г) продукты замещения ионов водорода в кислотах на ионы металлов или другие
сложные катионы.
9.В основе строения вещества лежит принцип ……………….
10.Перечислить основные классы сложных неорганических соединений:
а) металлы, неметаллы, инертные соединения; б) спирты, альдегиды, карбоновые кислоты, амины;
в) бинарные соединения (оксиды, галогениды и пр.), гидроксиды (кислоты, основания), соли;
г) средние, кислые и основные соли.
11.Какие из перечисленных оксидов являются амфотерными: K2O, SO3, Al2O3, ZnO, P2O5, NiО?
12.Какая реакция в растворе необратима?
а) CuSO4 + KCl→;
б) Ba(OH)2 + NaNO3→;
в) H2SO4 + MgCl2→;
г) NaOH + HCl→.
13.С каким веществом будет реагировать Ba(OH)2: HCl; NaOH; CaO? Возможную реакцию записать в молекулярном и ионно-молекулярном виде.
14.В каком из соединений HCl, NaClO4, Cl2O5 молярная масса эквивалента
хлора М(fСl) равна 5,1 г/моль?
15. Сложными называются вещества, молекулы которых……………
2. СТРОЕНИЕ ВЕЩЕСТВА
2.1. Строение атома и периодическая система элементов Д.И. Менделеева
2.1.1. Открытия в области строения атома, мир элементарных частиц 2.1.2. Квантово-механическая модель атома 2.1.3. Строение многоэлектронных атомов
2.1.4. Периодический закон и периодическая система Д.И. Менделеева 2.1.5. Периодические свойства, электроотрицательность элементов
2.1.1. Открытия в области строения атома, мир элементарных частиц
Современным представлениям о строении атома предшествовал ряд открытий конца
XIX – начала ХХ в. В 1897 г. Дж. Томсон (Англия) открыл электрон – частицу, несущую
отрицательный заряд и обладающую 1/2000 массы атома водорода. В 1909 г. Р.
Малликен определил заряд электрона (1,6∙10–19 Кл). В 1904 г. Дж. Томсон предложил
модель строения атома, которую можно представить как положительно заряженную
сферу с вкрапленными электронами.

Изучая в 1910 г. бомбардировку металлической фольги  -частицами, Э. Резерфорд
-частицами, Э. Резерфорд
(Англия) установил, что некоторые  -частицы отражаются от фольги. Резерфорд заключил, что в атоме имеется положительно заряженное ядро малого размера, окруженное электронами, и предложил ядерную планетарную модель атома: «Электроны движутся вокруг тяжелого ядра по орбитам, подобно планетам солнечной системы». Но подобная модель атома противоречила теории классической электродинамики, электроны в таком состоянии должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро. Однако практика этого не подтверждала. Резерфорд предсказал также существование протона и указал его массу, которая в 1800 раз превышает массу электрона.
-частицы отражаются от фольги. Резерфорд заключил, что в атоме имеется положительно заряженное ядро малого размера, окруженное электронами, и предложил ядерную планетарную модель атома: «Электроны движутся вокруг тяжелого ядра по орбитам, подобно планетам солнечной системы». Но подобная модель атома противоречила теории классической электродинамики, электроны в таком состоянии должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро. Однако практика этого не подтверждала. Резерфорд предсказал также существование протона и указал его массу, которая в 1800 раз превышает массу электрона.
При нагревании вещество испускает лучи. При разложении излучения на монохроматические компоненты получаютспектр излучения вещества. Спектры, получающиеся при излучении свободными или слабосвязанными атомами (например,
газы), называются атомными спектрами.
В 1900 г. М. Планк (Германия) высказал предположение, что вещества поглощают и испускают энергию дискретными порциями (квантами). Энергия
кванта  пропорциональна частоте излучения
пропорциональна частоте излучения  :
:
, |
(12) |
|
где – постоянная Планка (6,626∙1014 Дж∙с); |
; – скорость света; – длина |
|
волны излучения. |
|
|
Датский физик Н. Бор в 1910 г., используя модель Резерфорда и теорию Планка, предложил модель строения атома водорода. Согласно этой модели, электроны движутся в атоме по разрешенным (стационарным) орбитам, на которых они обладают определенной энергией.
Каждая орбита имеет номер  (1, 2, 3 … .), который назвали главным квантовым числом. Энергия электрона (эВ) зависела от значения
(1, 2, 3 … .), который назвали главным квантовым числом. Энергия электрона (эВ) зависела от значения  :
:
. |
(13) |
Отрицательный знак энергии означает устойчивость системы (атома). При переходе электрона со стационарной на более низкую орбиту атом излучает квант энергии и наоборот. Теория Бора получила экспериментальное подтверждение. Однако она не смогла объяснить строение многоэлектронных атомов.
В1905 г. А. Эйнштейн предсказал, что любое излучение – это поток квантов энергии (фотонов), следовательно, свет имеет двойственную (корпускулярно-волновую) природу.
В1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-волновой двойственностью. Это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее
волновые свойства электрона ( – длина волны излучения) и его вещественные свойства (
– длина волны излучения) и его вещественные свойства ( – масса,
– масса,  – скорость перемещения в пространстве):
– скорость перемещения в пространстве):
. |
(14) |
Таким образом, как частица электрон обладает массой покоя (9,1095∙10–28 г), min существующим в природе отрицательным зарядом (1,602∙10–19 Кл), размерами (de = 10–
13…10–14 м).

Как электромагнитная волна, электрон движется по всему объему атома, координаты нахождения его в пространстве не определяются, он может находиться в одно и то же время в любой точке атомного пространства.
В 1926 г. Э. Шредингер (Австрия) вывел математическое описание поведения электрона в атоме, а В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения микрочастицы принципиально
невозможно определить в любой момент времени с абсолютной точностью. Таким образом, работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга,
Шредингера заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц. Последующие открытия показали, что мир микрочастиц неисчерпаем.
В настоящее время известно больше элементарных частиц, чем химических элементов в ПСЭ. Все частицы делятся на 3 класса: лептоны, мезоны, барионы. Существуют промежуточные частицы – переносчики какого-то взаимодействия: фотоны, гравитоны и пр. (рис. 3).
Рис. 3. Упрощенная классификация элементарных частиц
Мезоны и барионы – делимые частицы и состоят из кварков. Кварки отличаются друг от друга зарядом и массой (см. приложение, табл. 4 «Двенадцать элементарных кирпичиков, составляющих материю»). При образовании мезонов и барионов кварки обмениваются квантами «цветовой энергии» – глюонами. Лептоны же, как показывают современные исследования, не обладают кварковой структурой.
2.1.2. Квантово-механическая модель атома
Согласно современным квантово-механическим представлениям, атом – это сложная нейтральная система, состоящая из положительно заряженного ядра, вокруг которого на орбиталях находятся отрицательно заряженные электроны, создающие электронную оболочку атома. Заряд электрона равен заряду протона, но противоположен по знаку. Так как атом электронейтрален, число электронов в атоме равно числу протонов в ядре атома.
Под электронным облаком или орбиталью условно принимается область пространства вокруг ядра атома, в которой сосредоточена ≈ 90 % массы и заряда
электрона. Плотность электронного облака не одинакова, она выше там, где больше вероятность нахождения электрона.
Протонно-нейтронная модель строения атомного ядра предложена в 1932 г. коллективом авторов.
Диаметр ядра среднего атома равен 10–14…10–15 м (dатома ≈ 10–8 м). В ядре сосредоточена основная масса атома ≈ 99,97 %. Плотность ядерного вещества в 1015 раз больше плотности атома.
Ядро состоит из элементарных частиц: протонов р и нейтронов n, которые характеризуются массой, зарядом и спином.
Протон р – частица с массой, равной 1 ат. ед. массы, зарядом +1 и спином ±1/2. Сумма протонов в ядре определяет величину его положительного заряда и соответствует порядковому номеру Z химического элемента в ПСЭ.
Масса нейтрона n так же равна 1 ат. ед. массы, заряд отсутствует, спин ±1/2. Сумма протонов и нейтронов в ядре (∑р +∑n = А) составляет массовое число атома
А, которое так же указывается в ПСЭ. Например:  . Протоны и нейтроны в ядре при определенных условиях могут взаимно превращаться.
. Протоны и нейтроны в ядре при определенных условиях могут взаимно превращаться.
Атомы, имеющие в ядре одинаковое число протонов, но различное число нейтронов, называются изотопами, они обладают одинаковыми химическими
свойствами: 
Атомы, имеющие одинаковое число нуклонов в ядре А называются изобарами, число протонов и нейтронов у них различно, их химические свойства так же
различны: 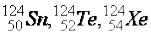 .
.
Установлено, что в ходе обычных химических реакций ядро атома остается неизменным, изменяется структура электронной оболочки атома.
Для характеристики поведения электрона в атоме введены квантовые числа: главное, орбитальное, магнитное, спиновое.
Главное квантовое число n определяет общий запас энергии электрона, размер электронного облака и степень удаления электрона от ядра. Оно принимает значения: 1, 2, 3, 4, 5 … и характеризует энергетический уровень, на котором находится электрон. Первый энергетический уровень располагается в непосредственной близости от ядра, электрон, находящийся на нем обладает min энергией, но наиболее прочно связан с ядром. Общее число энергетических уровней атома, на которых располагаются его электроны, равно номеру периода, в котором находится элемент в ПСЭ. Электроны последнего энергетического уровня атома, обладают max запасом энергии, но наиболее слабо связаны с ядром. Они могут покинуть атом и перейти в распоряжение другого

атома, такие электроны называются валентными. Переход электронов с более высо-
кого на более низкий уровень сопровождается выделением квантов энергии. Орбитальное квантовое число l – определяет форму электронного облака и
принимает значения от 0 до (n – 1): n l
10
20 1
30 1 2
40 1 2 3 для 5, 6, 7 периодов так же
подуровни → s p d f
Следовательно, каждый энергетический уровень делится на подуровни, число которых равно номеру главного квантового числа n. Орбитальное квантовое число характеризует, также энергетический подуровень, на котором находится электрон. Находясь на соответствующих подуровнях, электроны называются соответственно: s-, p-, d-, f-электро- нами.
Для s-орбитали форма электронного облака |
, |
|
p-орбитали |
, |
|

 d-орбитали ,
d-орбитали ,
f-орбитали – 8-лепестковая фигура.
Магнитное квантовое число m – характеризует ориентацию электронного облака в пространстве вокруг ядра по отношению к внешним магнитным полям. От ориентации электронного облака изменяется энергия электронов, находящихся на одном энергетическом уровне. Магнитное квантовое число m принимает значения от –l, через 0
до +l.
Пример: l = 2 (d-подуровень), m = –2, –1, 0, +1, +2 (итого 5 ориентаций в пространстве), следовательно, на одном подуровне может располагаться несколько орбиталей, их число на подуровне равно (2l+1):
На рис. 4 представлены формы электронных орбиталей и их ориентации в пространстве в зависимости от величины магнитного квантового числа.

Рис. 4. Формы и ориентации в пространстве различных атомных орбиталей
Атомная орбиталь (АО) – это состояние электрона в атоме, которое характеризуется значением 3-квантовых чисел: n, l, m.
Спиновое квантовое число ms имеет два значения: +1/2 и –1/2. Его можно представить как собственный механический момент движения электрона (вращение вокруг оси). Положительное и отрицательное значение msсвязаны с направлением вращения электрона. Электроны с антипараллельными спинами обозначаются: ↑↓.
2.1.3. Строение многоэлектронных атомов
Запись распределения электронов в атоме по уровням, подуровням и орбиталям получила название электронной конфигурации (формулы) атома элемента,
например:  1s22s22p63s2.
1s22s22p63s2.
В многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание от других электронов, экранирующих их от ядра атома, поэтому последовательность возрастания энергии орбиталей усложняется.
При составлении электронной конфигурации многоэлектронных атомов учитывают: принцип min энергии, принцип Паули, правила Гунда и Клечковского.
Принцип min энергии: электроны заполняют орбитали в порядке повышения уровня энергии орбиталей.
Принцип запрета Паули: в атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел: n, l, m, ms. Следовательно, на каждой атомной орбитали может быть не более 2 электронов, причем они должны иметь
противоположные спины:  .
.
Правило Гунда: устойчивому состоянию электронов в атоме соответствует такое распределение их по орбиталям в пределах подуровня, при котором абсолютное значение суммарного спина ms электронов максимально. В соответствии с этим правилом заполнение орбиталей одного подуровня осуществляется одиночными электронами с
одинаковыми спинами:  .
.
После того как одиночные электроны займут все орбитали на данном подуровне, при наличии электронов, эти же орбитали заполняются вторыми электронами с
противоположными спинами:  .
.
Правило Клечковкого: последовательность заполнения электронами энергетических подуровней происходит в порядке возрастания ∑n+l, а при равной сумме – в порядке возрастания значения главного квантового числа n.
Пример: какой подуровень будет заполняться электронами в первую очередь: 3d или
4s?
3d n =3, l = 2, n + l = 3 + 2 = 5 4s n = 4, l = 0, n + l = 4 + 0 = 4
Подуровень 4s будет заполняться электронами раньше, чем 3d.
Пример: на трех подуровнях (3d, 4p, 5s) n + l = 5, в первую очередь заполняется электронами подуровень 3d, затем 4p и 5s.
Исключение составляют некоторые атомы, у которых наблюдается отклонение от правила Клечковкого (провал электронов): Cu, Ag, Cr, Mo, Pd, Pt и др.
Основной характеристикой атома, определяющей его поведение в химических реакциях, а также свойства простых веществ, является строение внешнего (и частично – предвнешнего) энергетического уровня атома, число неспаренных (валентных) электронов и их энергия относительно ядра атома.
2.1.4. Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон, открытый Д.И. Менделеевым в 1869 г. на основе глубоких знаний в области химии и гениальной интуиции, является фундаментальным законом природы и теоретической базой химии: «Свойства простых веществ, а также формы и свойства соединений элементов, находятся в периодической зависимости от величины атомных весов элементов».
Позднее закон получил теоретическую интерпретацию на основе современных представлений о строении атома: «Свойства простых веществ, а также свойства соединений химических элементов, находятся в периодической зависимости от заряда ядра их атомов, т. е. – повторяющихся сходных электронных конфигураций внешних и, частично, предвнешних энергетических уровней атомов». Наглядным выражением закона служит Периодическая система элементов Д.И. Менделеева (ПСЭ).
Все 118 открытых химических элементов (см. приложение, ПСЭ), последние из которых еще не имеют названия, в зависимости от строения электронных орбиталей невозбужденных атомов, располагаются в ПСЭ в периодах, группах и подгруппах.
В таблице насчитывается 7 периодов, первые три – малые и четыре последующих – большие, последний период – незавершенный.

Период – это последовательный ряд элементов, расположенных в порядке возрастания заряда ядра атомов, у которых происходит заполнение электронами одинаковых количеств энергетических уровней, при этом электронная конфигурация атомов элементов изменяется с ns1 до ns2np6 (или до ns2 у элементов 1-го
периода). Номер периода № указывает на величину последнего главного квантового числа n атомов элементов, находящихся в данном периоде.
1-й период состоит из 2 элементов: |
. Ядро атома водорода имеет заряд (+1), |
в поле которого находится 1 электрон, он располагается на 1s-подуровни:  – 1s1. У
– 1s1. У
атома гелия заканчивается формирование 1s-подуровня:  – 1s2, единственный и последний энергетический уровень атома гелия является завершенным. Атомом гелия
– 1s2, единственный и последний энергетический уровень атома гелия является завершенным. Атомом гелия
заканчивается формирование 1-го энергетического уровня, обозначим его  . 2-й период включает 8 элементов, у которых полностью заполнен
. 2-й период включает 8 элементов, у которых полностью заполнен
1-й энергетический уровень  и формируется 2-й. Начинается период с атома лития
и формируется 2-й. Начинается период с атома лития  , три электрона которого располагаются на 2 уровнях:
, три электрона которого располагаются на 2 уровнях:  2s12p0, причем имеются свободные орбитали р-подуровня. У следующего атома
2s12p0, причем имеются свободные орбитали р-подуровня. У следующего атома :
:  2s22p0; 2s-
2s22p0; 2s-
подуровень завершен. У остальных 6 элементов периода (от  до
до  ) происходит
) происходит
заполнение электронами 2р-подуровня, который полностью завершен у атома 
:  2s12p6.
2s12p6.
3-й период также включает 8 элементов, однако, в отличие от атомов элементов второго периода на 3-м энергетическом уровне появляется d-подуровень, который у элементов этого периода, согласно правилу Клечковского, не заполняется электронами. У
первых 2 элементов периода:  и
и  , последние электроны формируют 3s-
, последние электроны формируют 3s-
подуровень, электронная конфигурация атома магния ( ) имеет вид:
) имеет вид: 
3s23p03d0. Далее следуют 6 элементов ( ), последний электрон которых располагается на 3р-подуровне. Завершается формирование 3р-подуровня у атома
), последний электрон которых располагается на 3р-подуровне. Завершается формирование 3р-подуровня у атома
аргона ( ):
):  3s23p63d0. Наличие свободных 3d-орбиталей у атомов элементов 3 периода создает различие в свойствах с аналогичными элементами 2 периода.
3s23p63d0. Наличие свободных 3d-орбиталей у атомов элементов 3 периода создает различие в свойствах с аналогичными элементами 2 периода.
4-й период включает 18 элементов, у которых формируется 4-й энергетический
уровень, включающий 4 подуровня: s, p, d, f. У атомов  и
и  последние электроны идут на 4s-подуровень, при этом конфигурация энергетических уровней атома
последние электроны идут на 4s-подуровень, при этом конфигурация энергетических уровней атома
кальция ( ) имеет вид:
) имеет вид:  3d04s24p04d04f0. 3d-подуровень у атомов этих элементов остается свободным, так как согласно правилу Клечковского, 4s-подуровень характеризуется более низким уровнем энергии электронов, чем 3d-подуровень. Далее
3d04s24p04d04f0. 3d-подуровень у атомов этих элементов остается свободным, так как согласно правилу Клечковского, 4s-подуровень характеризуется более низким уровнем энергии электронов, чем 3d-подуровень. Далее
следуют 10 элементов, от  до
до  , у которых заполняется электронами 3d-
, у которых заполняется электронами 3d-
подуровень, конфигурация энергетических уровней атома  имеет вид:
имеет вид:  3d104s24p04d04f0. На внешнем энергетическом уровне у атомов этих элементов остается 2 электрона, такие элементы называются переходными, а химические свойства их с повышением порядкового номера элемента изменяются незначительно.
3d104s24p04d04f0. На внешнем энергетическом уровне у атомов этих элементов остается 2 электрона, такие элементы называются переходными, а химические свойства их с повышением порядкового номера элемента изменяются незначительно.
У следующих 6 элементов периода ( –
–  ) формируется 4р-подуровень,
) формируется 4р-подуровень,
который завершается у  :
:  3d104s24p64d04f0. Таким образом, у атомов элементов 4-го периода остаются незаполненными электронами 4d- и 4fподуровни.
3d104s24p64d04f0. Таким образом, у атомов элементов 4-го периода остаются незаполненными электронами 4d- и 4fподуровни.
5-й период включает 18 элементов и по своей структуре аналогичен 4-му периоду. 6-й период содержит 32 элемента. Аналогично элементам 5-го периода, после
заполнения электронами у атомов элементов  и
и  6s-подуровня начинается формирование d-подуровня 5-го энергетического уровня, поэтому электронная
6s-подуровня начинается формирование d-подуровня 5-го энергетического уровня, поэтому электронная
конфигурация атома  имеет вид:
имеет вид:  4f05d1 5f06s26p06d06f0. Однако у следующего элемента
4f05d1 5f06s26p06d06f0. Однако у следующего элемента  энергетически выгоднее формирование 4f-подуровня по сравнению с
энергетически выгоднее формирование 4f-подуровня по сравнению с
5d, поэтому после лантана следует 14 элементов:  , с формирующимся f-
, с формирующимся f-
электронами 4f-подуровня. Таким образом, в одной клетке ПСЭ с лантаном  отводится место 14 элементам – лантаноидам, химические свойства которых, практически одинаковы, благодаря отсутствию различий в строении внешних и предвнешних энергетических уровней атомов. Затем, с ростом заряда ядра атомов, продолжается заполнение электронами орбиталей 5d-подуровня, процесс завершается у
отводится место 14 элементам – лантаноидам, химические свойства которых, практически одинаковы, благодаря отсутствию различий в строении внешних и предвнешних энергетических уровней атомов. Затем, с ростом заряда ядра атомов, продолжается заполнение электронами орбиталей 5d-подуровня, процесс завершается у
атома ртути  :
:  4f145d105f06s26p06d06f0. Начиная с атома таллия
4f145d105f06s26p06d06f0. Начиная с атома таллия  и заканчивая атомом радона
и заканчивая атомом радона  , заполняется оставшийся 6р-подуровень, который у
, заполняется оставшийся 6р-подуровень, который у
атома радона является завершенным:
является завершенным:  4f145d105f06s26p66d06f0. 7-й период начинается и продолжается аналогично 6-му периоду, однако
4f145d105f06s26p66d06f0. 7-й период начинается и продолжается аналогично 6-му периоду, однако
формирование его не завершено. Он также формирует d-подуровень 6-го энергетического уровня и 14 5f-элементов ( ), которые располагаются в
), которые располагаются в
одной клетке ПСЭ с актинием .
.
ПСЭ включает 8 групп элементов, каждая из которых делится на главную А и побочную В подгруппы. Группы включают в себя химические элементы, сходные по своим химическим свойствам. В главные подгруппы входят элементы малых и больших периодов, в побочные – только d-элементы больших периодов. Лантаноиды и актиноиды образуют вторые побочные подгруппы. Номер группы, как правило, указывает на максимально возможное число валентных электронов атома элемента. У элементов I–VIII
(A) групп валентность атомов определяется общим числом электронов на внешнем энергетическом уровне,
I–VIII (В) – общим числом электронов на внешнем s-подуровне и неспаренных электронов на d-предвнешнем энергетическом уровне атома (более подробно о валентности атомов элементов см. п. 2.2.1.).
По типу формирующего электрона атома (подуровень, на который идет последний электрон атома) в ПСЭ выделяют 4 семейства элементов (s-, p-, d-, f-):
s-семейство (ns1…ns2): I – II (A) подгруппы;
р-семейство (ns2npN, где N от 1 до 6): III – VIII (A) подгруппы; d-семейство (ns2(n-1)dN, где N от 1 до 10): I – VIII (B) подгруппы; f-семейство (ns2(n-2)fN, где N от 1 до 14): лантаноиды, актиноиды.
2.1.5. Периодические свойства, электроотрицательность элементов
Так как электронные конфигурации атомов элементов изменяются периодически, то соответственно периодически изменяются и свойства элементов, которые определяются их электронным строением: размерами атомов, энергетическими характеристиками, окислительно-восстановительнымим свойствами.
В зависимости от строения внешних и предвнешних энергетических уровней атомов химические элементы условно делятся на металлы, неметаллы, инертные элементы. В группу металлов включены также переходные элементы от металлов до неметаллов.
У атомов инертных элементов внешние электронные оболочки завершенные с конфигурацией: ns2 или ns2np6(элементы VIII(A) подгруппы). Элементы характеризуются отсутствием реакционной способности, во всех агрегатных состояниях существуют в виде отдельных атомов.
Атомы металлов на внешнем энергетическом уровне имеют от 1 до 3 электронов: ns1, ns2, ns2np1, ns2(n-1)dN, ns2(n-2)fN. К атомам металлов относятся элементы I, II, III(A)
групп (за исключением бора  ), а также многие d- и f-элементы.
), а также многие d- и f-элементы.
Атомы металлов легко отдают электроны с внешних энергетических уровней, т. е. окисляются, и переходят в положительно заряженные катионы с устойчивой конфигурацией энергетических уровней атомов инертных элементов: Ме0 – ne→Men+. Таким образом, все металлы проявляют свойства восстановителей.
Энергия, необходимая для удаления одного моля электронов от одного моля атомов какого либо элемента, называется первой энергией ионизации I1, кДж/моль или эВ. Её величина характеризует восстановительную способность элемента и возрастает по периоду ПСЭ. Наименьшее значение I1 имеют щелочные металлы, находящиеся в начале периодов.
Атомам неметаллов недостает до завершения внешних электронных оболочек (аналогично инертным элементам) от 1 до 4 электронов, конфигурация их внешних энергетических уровней: ns2npN, где N от 5 до 2 (IV – VII(A) группы). Образуя соединения с другими элементами, атомы неметаллов R способны принимать электроны (восстанавливаться) на внешние уровни, переходя в отрицательно заряженные ионы с устойчивой конфигурацией атомов инертных элементов: R + ne →Rn-, таким образом, неметаллы проявляют свойства окислителей.
Энергия, выделяющаяся при присоединении моля электронов к молю нейтральных атомов называется сродством к электрону Еср, кДж/моль или эВ. Сродство к электрону зависит от положения элемента в ПСЭ, возрастает по периодам и имеет max значение для атомов галогенов.
Для сравнительной оценки окислительно-восстановительных свойств атомов введено понятиеэлектроотрицательность (ЭО) – это количественное
выражение способности атома притягивать электрон при образовании соединений с другими атомами. ЭО измеряется по шкале Л. Полинга (США) в относительных литиевых единицах (ЭОLi = 1), (см. табл. 5 приложения).
Следовательно, главным химическим свойством атомов элементов является их окислительная или восстановительная способность, которая определяется положением элемента в ПСЭ. В пределах периода с ростом заряда ядра атома увеличивается количество электронов на внешнем энергетическом уровне, но количество уровней остается неизменным, радиус атома уменьшается, так как электронная оболочка сильнее стягивается к ядру. Чем меньше электронов на внешнем энергетическом уровне и чем больше радиус атома, тем легче электроны отрываются от атома, т. е. сильнее выражены его восстановительные (металлические) свойства. Чем больше электронов на внешнем энергетическом уровне и меньше радиус атома, тем сильнее выражены окислительные (неметаллические) свойства элемента. Следовательно, в периодах от начала к концу
