
Химия Соснина
.pdf
ослабляется восстановительная активность атомов и возрастает окислительная, т. е. наблюдается переход от атомов с типичными свойствами металлов к атомам с типичными свойствами неметаллов, электроотрицательность атомов при этом возрастает.
В пределах группы элементов (главной подгруппы) с ростом заряда ядра атомов увеличивается количество энергетических уровней атомов, т. е. растет радиус атомов, количество же электронов на внешнем уровне остается неизменным, однако, они все далее отстают от ядра атома и такие электроны легче оторвать от атома. Таким образом, восстановительная активность атомов по группам сверху вниз возрастает, а окислительная – снижается, уменьшается и величина ЭО атомов.
Самые сильные окислители (неметаллы) находятся в правом верхнем углу ПСЭ: F, Cl, O. Самые сильные восстановители (металлы) находятся в левом нижнем углу: Fr, Ba,
Ra.
2.2. Химическая связь
2.2.1. Метод валентных связей (МВС), ковалентная связь 2.2.2. Пространственная структура молекул 2.2.3. Метод молекулярных орбиталей (ММО)
2.2.4. Ионная связь
2.2.5. Межмолекулярное взаимодействие
Следующим шагом в понимании строения вещества служит выявление взаимодействия между атомами при образовании молекулы, т. е. химическая связь. Под химической связью понимаются те силы, которые удерживают атомы в молекуле, молекулярном ионе, кристалле. Чем прочнее химическая связь, тем больше энергии нужно затратить для ее разрушения. Условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов. Согласно современным представлениям, химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла.
Познание характера такого взаимодействия оказалось возможным на основании работ английского физика Г. Дэви (идея об электрической природе химической связи, 1807 г.), шведского химика И. Берцелиуса (электрохимическая теория химической
связи, 1812–1818 гг.), теории химического строения вещества, предложенной в 1861 г. выдающимся русским химиком А. М. Бутлеровым. Согласно теории Бутлерова свойства веществ определяются не только их качественным и количественным составом, но и определенным порядком соединения между собой атомов, образующих молекулу. Атомы же в молекуле соединяются последовательно согласно их валентности и оказывают взаимное влияние друг на друга. На базе работ, выполненных в 1916 г. немецким ученым В. Косселем и американцем Г. Льюисом, была высказана идея, что при образовании молекул возникают устойчивые внешние электронные конфигурации атомов в результате обобществления их электронов. Исследования и расчеты, выполненные в 1927 г. В. Гейтлером и Ф. Лондоном (Германия), позволили сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам:
Представления об образовании химической связи, развитые Гейтлером и Лондоном, были распространены на более сложные молекулы.
2.2.1. Метод валентных связей (МВС), ковалентная связь

Метод валентных связей (МВС), разработанный на основе теории химической связи Гейтлера и Лондона, дал теоретические объяснения важнейших свойств химической связи, позволил понять строение большого числа молекул и является наглядным, однако приближенным и упрощенным.
В основе метода лежат следующие положения.
1.Сближение атомов с противоположными спинами валентных электронов приводит
кперекрытию их электронных облаков (рис. 5).
Рис. 5. Схема образования химической связи в молекуле водорода по МВС
2.Плотность электронных облаков в межъядерном пространстве возрастает. Положительно заряженные ядра двух связывающихся атомов притягиваются к области повышенной плотности электронных облаков.
3.Валентные электроны атомов занимают место на орбиталях обоих атомов одновременно.
Для наглядности электронная структура молекулы изображается в виде валентной схемы, где электроны, находящиеся на внешнем энергетическом уровне, обозначаются точками, располагаемыми вокруг химического символа атома: Н• + •Н → Н׃Н. Схема показывает, что при соединении двух атомов водорода в молекулу каждый из атомов приобретает устойчивую 2-электронную оболочку, подобную электронной оболочке атома инертного газа (гелия).
Валентность Z – это способность атома присоединять или замещать определенное число других атомов с образованием химических связей. Количественной мерой валентности по МВС считают число неспаренных электронов в основном (нормальном) или возбужденном состоянии атома.
Пример: в основном состоянии атом  проявляет валентность равную 1, так как имеет один неспаренный электрон на внешнем энергетическом уровне:
проявляет валентность равную 1, так как имеет один неспаренный электрон на внешнем энергетическом уровне:
[Ne]3s23p53d0 или
При образовании химической связи атом хлора может переходить в возбужденное
состояние  в результате передачи атому энергии и распаривания электронов на 3р- и 3s-подуровнях и переходе неспаренных электронов на свободные орбитали 3dподуровня. При этом атом хлора может проявлять валентность Z, равную 3, 5 и 7:
в результате передачи атому энергии и распаривания электронов на 3р- и 3s-подуровнях и переходе неспаренных электронов на свободные орбитали 3dподуровня. При этом атом хлора может проявлять валентность Z, равную 3, 5 и 7:

Химическая связь, образованная путем обобществления пары электронов двумя атомами, называетсяковалентной связью.
Прочность ковалентной связи характеризуется величиной энергии связи  , кДж/моль – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Чем в большей степени перекрываются электронные облака атомов, тем прочнее ковалентная связь. Степень перекрытия зависит от радиуса взаимодействующих атомов, чем больше радиус атома, тем меньше степень перекрытия электронных облаков.
, кДж/моль – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Чем в большей степени перекрываются электронные облака атомов, тем прочнее ковалентная связь. Степень перекрытия зависит от радиуса взаимодействующих атомов, чем больше радиус атома, тем меньше степень перекрытия электронных облаков.
Пример: при образовании молекулы метана СН4 из одиночных атомов выделяется 1647 кДж на моль образовавшегося вещества:
С + 4Н = СН4 + 1647 кДж. Так как в молекуле метана 4 ковалентные связи С –
Н,  = 1647: 4 = 412 кДж/моль.
= 1647: 4 = 412 кДж/моль.
Ковалентная химическая связь характеризуется также длиной, полярностью, для многоатомных молекул существует понятие – угол связи.
Под длиной химической связи d, Ǻ понимается расстояние между центрами ядер взаимодействующих атомов в молекуле, ионе или кристалле, когда энергия образовавшейся системы min.
Пример: в молекуле водорода Н2 dH-H = 0,74 Ǻ, в молекуле воды H2O dO-H = 0,96 Ǻ. В многоатомных молекулах между двумя соседними химическими связями может
образовываться угол 180° (CO2, HgCl2 др.), тогда молекулы будут иметь линейное строение. Такие же молекулы, как H2O, SO2 – угловые. В молекуле H2O угол между двумя связями (О – Н) ≈ 104,5°. Существуют молекулы и более сложной конфигурации. Форма молекул зависит от формы перекрывающихся электронных облаков, их ориентации в пространстве, типа гибридизации электронных облаков атомов при образовании химической связи, а также видом образующейся ковалентной связи (σ, π), более подробно эти вопросы освещены в п. 2.2.2.
Ковалентная связь может быть полярной и неполярной.
Неполярная ковалентная связь возникает при перекрытии электронных облаков однотипных атомов (H2, Cl2) с одинаковой электроотрицательностью, либо между атомами с близкой электроотрицательностью (PH3, AsH3 и др., см. табл. 5 приложения). Электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов:
Полярная ковалентная связь образуется при связывании атомов с различной электроотрицательностью (HCl, H2O, H2S). Более электроотрицательный атом перетягивает на себя электронное облако повышенной плотности, образованное в результате перекрытия электронных облаков атомов, что приводит к поляризации химической связи:

Мерой полярности такой связи является длина диполя L, Ǻ и дипольный момент μ, D. Длина диполя зарядов связи (молекулы, в случае 2 атомных молекул), дипольный момент – произведение длины д момент – векторная величина и имеет направление от (–) к (+).
Для многоатомных молекул дипольный момент является суммарной векторной величиной дипольных моментов отдельных связей: μР = ∑μi. Если μР = 0, то молекула – симметричная неполярная, если μР ≠ 0 – молекула полярная (диполь) (рис. 6). Следовательно, суммарный дипольный момент молекулы характеризует не только полярность молекулы, но и расположение атомов в пространстве при образовании молекулы.
Рис. 6. Результирующие дипольные моменты в молекулах различных типов
Ковалентная связь может образоваться за счет пары электронов, первоначально принадлежащей одному атому (донору электронной пары), и свободной орбитали другого атома (акцептора электронной пары). Такой способ образования ковалентной связи называется донорно-акцепторным.
Рассмотрим электронно-графическую структуру атома азота и валентную схему молекулы аммиака:
1
2

Точками обозначены электроны, первоначально принадлежащие атому азота, а крестиками – атомам водорода. Согласно валентной схеме молекулы аммиака из восьми электронов атома азота, находящихся на внешнем энергетическом уровне, шесть образуют три ковалентные связи и являются общими для атома азота и трех атомов водорода. Но два электрона 2s2 принадлежат только азоту и образуют неподеленную электронную пару, которая может участвовать в образовании ковалентной связи с другими атомами, если на внешнем энергетическом уровне этого атома есть свободная орбиталь. Такая свободная 1s-орбиталь имеется, например у иона водорода Н+, вообще лишенного электронов:
Поэтому при взаимодействии молекулы аммиака с ионом водорода между ними возникает ковалентная связь по донорно-акцепторному типу; неподеленная пара электронов атома азота встает на свободную орбиталь иона водорода и становится общей для двух атомов:
Экспериментально установлено, что четыре ковалентные связи N – H в ионе аммония равноценны.
Таким образом, атомы обладают разными возможностями для образования ковалентных связей. Тем не менее, общее число ковалентных связей, которые способен образовывать данный атом, ограничено и определяется общим числом валентных орбиталей атома, это получило название – насыщаемость ковалентной связи.

Суммарная валентность элемента равна числу неспаренных электронов плюс число связей, образованных по донорно-акцепторному типу.
2.2.2. Пространственная структура молекул
Ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями атомных электронных облаков (АО) в пространстве.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью. Она возникает при перекрывании s-орбиталей, s- и p-орбиталей, р-, d-орбиталей, d- и s-орбиталей и т. д. (рис. 7).
Рис. 7. Перекрывание атомных орбиталей при образовании σ-связей
Связь, образованная перекрывание АО по обе стороны линии, соединяющей ядра взаимодействующих атомов, называется π-связью. Она возникает при перекрывании р
– р-орбиталей, p – d-орбиталей, d – d-орбиталей, f – p-орбиталей и пр. (рис. 8).
Рис. 8. Перекрывание атомных орбиталей при образовании π-связи
Рассмотрим образование молекулы азота  . Каждый атом азота обладает тремя неспаренными 2р-электронами, электронные облака которых ориентированы в трех взаимно перпендикулярных направлениях (см. рис. 4).
. Каждый атом азота обладает тремя неспаренными 2р-электронами, электронные облака которых ориентированы в трех взаимно перпендикулярных направлениях (см. рис. 4).

На рис. 9 изображено перекрывание р-электронных облаков в молекуле азота (для удобства изображения перекрывание рх-, ру-, и рz-облаков показано раздельно). Как
видно, атомы азота связаны в молекуле  тремя ковалентными связями:
тремя ковалентными связями:  . Связи эти неравноценны: одна из них σ-связь, а две другие – π-связи. Таким образом, при наложении σ- и π-связей образуются двойные и тройные связи, количество которых между атомами называетсякратностью связи. Прочность этих связей различна.
. Связи эти неравноценны: одна из них σ-связь, а две другие – π-связи. Таким образом, при наложении σ- и π-связей образуются двойные и тройные связи, количество которых между атомами называетсякратностью связи. Прочность этих связей различна.
Рис. 9. Схема перекрывания 2р-электронных облаков молекуле азота: а – σ-связь, б и в – π-связи
Изменение размеров, формы, ориентации в пространстве атомных орбиталей при образовании химической связи, приводящее к достижению min потенциальной энергии образующейся молекулы (иона, кристалла) называетсягибридизацией атомных электронных орбиталей.
Форма гибридной атомной орбитали отличается от формы исходных атомных (рис. 10). В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит max перекрывание, которое приводит к повышению энергии связи. Гибридные облака обладают пространственной симметрией, наличие которой повышает устойчивость молекул.
Таким образом, вместо исходных s-, p-, d- АО образуются гибридные орбитали, количество которых соответствует исходным АО атома.
Если в химическую связь вступают атом, у которого на внешнем уровне имеются s- и р- валентные электроны (элементы IIA группы), то у данного атома в процессе образования связи происходит sp-гибридизация АО (рис. 11). Гибридные электронные облака располагаются под углом 180° друг относительно друга и вытянуты вдоль линии, соединяющей ядра взаимодействующих атомов. Форма образующейся молекулы – линейная.
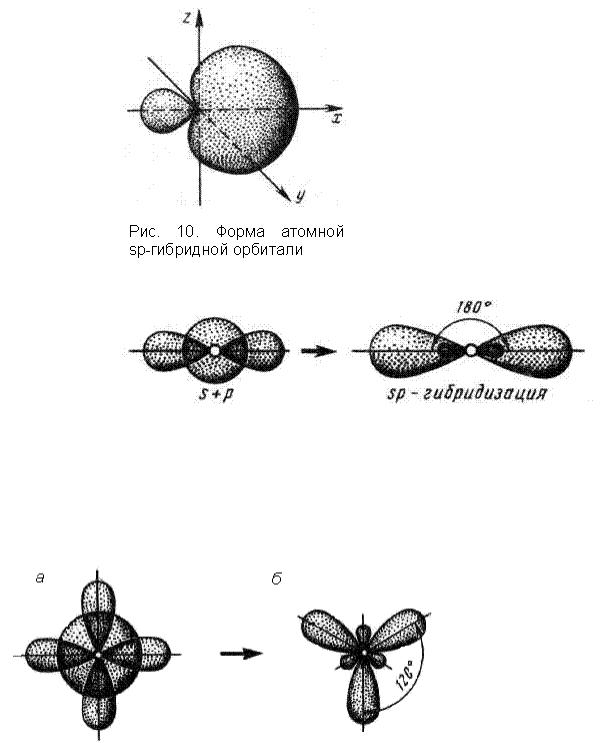
Рис. 11. Схема sp-гибридизации АО
Если у атома, вступающего в химическую связь, на внешнем уровне имеется один s- и два р-электрона (элементы IIIA группы), происходит sp2-гибридизация АО этого атома (рис. 12). Гибридные электронные облака располагаются в плоскости под углом 120° относительно друг друга. Форма образующейся молекулы – плоская, треугольная, симметричная.
Рис. 12. Схема sp2-гибридизации АО
У атома, имеющего на внешнем уровне один s- и три р-электрона (элементы IVA группы), при химическом взаимодействии происходит
sp3-гибридизация этих АО (рис. 13). Гибридные электронные облака вытянуты в направлениях к вершинам тетраэдра, т. е. ориентированны под углом 109°28י друг к другу. Образуется молекула пространственной тетраэдрической структуры.

Рис. 13. Схема sp3- гибридизации АО
Возможны более сложные виды гибридизации, в которых участвуют d- и f- электронные облака, и соответственно пространственные конфигурации молекул.
Таким образом, пространственная структура молекулы определяется числом атомов в молекуле, количеством и типом химической связи и типом гибридизации атомных орбиталей.
2.2.3. Метод молекулярных орбиталей (ММО)
Рассмотренный выше метод валентных связей МВС является приближенным и в ряде случаев не может объяснить природу образующихся химических связей или приводит к неверным заключениям о свойствах молекул. Если в МВС атомы молекул сохраняют определенную индивидуальность, то в ММО молекула (ион, кристалл) рассматривается как единая система.
Основные положения ММО.
1.При образовании химической связи между двумя атомами, каждый из которых имеет n АО на внешнем энергетическом уровне, образуется 2n МО.
2.Энергия образовавшихся МО (ЕМО) различна и отличается от энергии исходных АО
(ЕАО).
3. МО, обладающие меньшей энергией, чем исходные АО, называются связывающими (ЕМО связ < ЕАО), они энергетически более устойчивы.
4. МО, обладающие большей энергией, чем исходные АО, называются разрыхляющими (ЕМО разр > ЕАО), они энергетически неустойчивы.
5. Образование химической связи между атомами происходит в том случае, когда, согласно принципу Паули, электроны с противоположными спинами переходят с АО на
МОСВЯЗ, при этом выделяется энергия (∆Е = ЕАО – ЕМО связ). Max плотность
МОСВЯЗ приходится на область, лежащую между ядрами взаимодействующих атомов.
6.Если спины электронов взаимодействующих атомов параллельны, то один
электрон занимает МОСВЯЗ, а другой – МОРАЗР, атомы отталкиваются друг от друга, химической связи не возникает, электронная плотность МО равна нулю.
7.Образование молекулы возможно в том случае, когда число электронов на
МОСВЯЗ больше, чем на МОРАЗР.
8. Если число электронов на МОСВЯЗ и МОРАЗР одинаково, то молекула образоваться не может.
Несмотря на универсальность и общий подход ко всем типам химических соединений, ММО более сложен и менее нагляден, чем МВС, однако нашел широкое применение для проведения расчетов на ЭВМ.
На рис. 14 представлена энергетическая схема образования молекулы водорода по ММО.

Рис. 14. Энергетическая схема образования молекулы водорода по ММО 2.2.4. Ионная связь
Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает в случае большой разности ЭО атомов (см. табл. 5 приложения), например, между катионами s-металлов IA, IIA групп ПСЭ и анионами неметаллов VIA, VIIA групп
(LiF, CsCl, Na2O и др.).
Для ионной химической связи не характерна направленность, так как электрическое поле любого иона имеет сферический характер. Ионной связи также не свойственна насыщенность, так как ион способен взаимодействовать со многими соседними ионами противоположного знака, число которых зависит от зарядов ионов и их геометрических размеров.
Ионная химическая связь наиболее ярко проявляется в твердых веществах с ионной кристаллической решеткой (соли, оксиды, гидроксиды). Однако даже в типичных ионных соединениях (галогениды щелочных металлов) не происходит полного разделения отрицательного и положительного зарядов, т. е. полного перехода электрона от атома металла к атому неметалла. Это объясняется взаимной поляризацией ионов, т. е. влиянием их друг на друга, которое приводит к деформации электронных оболочек ионов. Поляризуемость анионов выше, чем катионов за счет ослабленной связи внешних электронов с ядром (рис. 15).
