
- •8) Зависимость скорости реакции от природы реагирующих веществ и температуры (правило Вант-Гоффа, энергия активации).
- •9) Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия.
- •10)Условие химического равновесия. Константа химического равновесия гомогенных и гетерогенных систем.
- •11)Смещение химического равновесия. Принцип Ле-Шателье.
- •12)Современное представление о строении атома и элементарных частицах. Протонно-нейтронная теория строения атомного ядра. Изотопы, изобары. Ядерная энергетика.
- •13)Квантово-механическая модель атома. Двойственная природа электрона. Квантовые числа. Атомные электронные орбитали. Принцип Паули. Правило Гунда.
- •14)Строение многоэлектронных атомов. Правила и порядок заполнения атомных орбиталей электронами. Правило Клечковского.
- •15) Периодическая система д. И. Менделеева. Физический смысл периодов и групп. Изменение свойств элементов по периодам и группам.
- •17)Химическая связь по методу валентных связей. Основные характеристики.
- •18)Образование химической связи по методу молекулярных орбиталей (ммо).
- •19)Типы химических связей и типы молекул.
- •20)Виды ковалентной связи. Ионная связь. Примеры и свойства веществ.
- •21)Направленность ковалентной связи (σ и π-связи), гибридизация атомных электронных орбиталей, формы молекул.
- •22)Агрегатное состояние вещества. Свойства аморфных и кристаллических веществ.
- •23)Определение кристаллической решетки, ее свойства.
- •24)Типы кристаллов, их свойства. Понятие о металлической связи.
- •25)Зонная теория строения твердого тела: проводники, полупроводники, изоляторы.
- •26)Дефекты реальных кристаллов. Собственная и примесная проводимость полупроводников.
1)Химия как предмет естествознания. Предмет и задачи химии. Химия и энергоснабжение. Атомно-молекулярные учения о строении вещества.
Естествознание – наука о явлениях и законах природы. Современное естествознание включает многие естественнонаучные отрасли: физику, химию, биологию. Одним из основных объектов химии являются вещества, из которых состоят все окружающие нас тела.
Главная задача химии - выявление и описание таких свойств веществ, благодаря которым возможно превращение одних веществ в другие в результате химических явлений, или химических реакций.
Химия очень важна в энергоснабжении. Например, при защите различных проводников, необходимо воспользоваться знаниями в области химии. Химическим способом можно получить источник энергии и т.д….
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
2) Основные понятия химии: моль, молярная масса, эквивалент, молярная масса эквивалента вещества. Закон эквивалентов.
Моль – это количество вещества, содержащее столько формульных единиц, сколько атомов содержится в 12г изотопа углерода 12С.
Молярная масса – масса одного моля вещества, численно она равна отношению массы вещества к количеству.
Эквивалент (Э) – это реальная ли условная частица вещества, которая может присоединять, замещать, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Молярный объем эквивалента вещества – это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
3) Энергетические эффекты химических реакций. Внутренняя энергия. Энтальпия. Первый закон термодинамики.
Раздел химии, изучающий тепловой эффект реакции называется химической термодинамикой. В химических уравнениях, в которых указана теплота реакции и агрегатные состояния веществ, называются термохимическими.
Важнейшими задачами химической термодинамики является выяснение возможности или невозможности самопроизвольного протекания процесса той или иной химической реакции при заданных условиях и в заданном направлении; установление значения термодинамических параметров, при которых достигается максимальный выход процесса; определение характеристик энергетического изменения, происходящего в системе. Находят это с помощью термодинамических функций(U,H,S,G) .
Функция
состояния U
характеризует внутреннюю энергию
системы – сумму потенциальной энергии
взаимодействия всех частиц тела между
собой и кинетической энергии их движения.
Она зависит от состояния вещества –
вида, массы, агрегатного состояния.
Абсолютную величину внутренней энергии
измерить невозможно, поэтому при изучении
химических процессов судят об изменении
внутренней энергии при переходе системы
из одного состояния в другое.
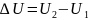
При
этом
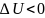 внутренняя энергия системы убывает,
при
внутренняя энергия системы убывает,
при
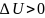 – возрастает.
– возрастает.
I закон термодинамики: если к системе подвести тепло, то подведенное тепло тратится на увеличение внутренней энергии системы и на совершение ею работы.
В
изохорном процессе вся теплота,
подведенная к системе, тратится на
изменение внутренней энергии:
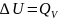
В
изобарном процессе единственным видом
работы, совершаемой системой, является
работа расширения: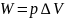
Тогда
математическое выражение I
закона термодинамики принимает вид:
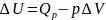
Обозначив
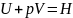 ,
где H-
это энтальпия - мера энергии, накапливаемой
веществом при его образовании, получаем:
,
где H-
это энтальпия - мера энергии, накапливаемой
веществом при его образовании, получаем:
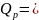 )
– (
)
– ( ;
;
Функция состояния системы Н – это общий запас энергии системы, т. е. это энергосодержание системы. Энтальпия системы больше внутренней энергии на величину работы. Абсолютное значение нельзя измерить, поэтому судят об энтальпии при переходе системы из одного состояния в другое.
Если
реакция эндотермическая (протекает с
поглощением тепла), то
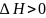 .
Если реакция экзотермическая (протекает
с выделением тепла), то
.
Если реакция экзотермическая (протекает
с выделением тепла), то
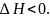
Для сравнения тепловых эффектов различных процессов стандартизуют условия их протекания. Стандартные условия – Т0 = 298 К, р0 = 101,313 кПа, n – 1 моль чистого веществ.
4)Энтальпия образования сложного вещества. Законы термохимии.
Из I закона термодинамики следуют количественные законы термохимии.
Закон
Лавуазье-Лапласа (1780–1784) – для каждого
химического соединения теплота разложения
равна теплоте его образования, но имеет
противоположный знак.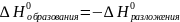
Закон Г.И. Гесса (1840) – тепловой эффект химической реакции зависит от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от характера и пути протекания реакции.
Данный закон – теоретическая основа термохимии. Из него вытекает ряд следствий:
● количество
энергии, которое выделяется или
поглощается при образовании 1 моля
сложного вещества из простых в стандартных
условиях, называется стандартной
энтальпией образования ( ,
кДж/моль);
,
кДж/моль);
● в
термохимических расчетах теплота
образования (энтальпия) простых веществ
в стандартных условиях принимается
равной нулю
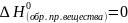
● количество
энергии, которое выделяется или
поглощается 1 молем органического
вещества разлагающегося до углекислого
газа и воды в стандартных условиях,
называется стандартной энтальпией
сгорания (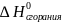 ,
кДж/моль);
,
кДж/моль);
● энтальпия химической реакции равна разности между суммой энтальпии образования продуктов реакции и суммой энтальпии образования исходных веществ с учетом стехиометрических коэффициентов энтальпий:
![]()
где
![]() – энтальпия химической реакции в
стандартных условиях;
– энтальпия химической реакции в
стандартных условиях;
![]() – сумма стандартных энтальпий образования
продуктов реакции;
– сумма стандартных энтальпий образования
продуктов реакции;
![]() – сумма стандартных энтальпий образования
исходных веществ;
– сумма стандартных энтальпий образования
исходных веществ;
![]() ,
,![]() – стехиометрические коэффициенты
соответственно продуктов реакции и
исходных веществ.
– стехиометрические коэффициенты
соответственно продуктов реакции и
исходных веществ.
Закон Гесса позволяет рассчитать тепловые эффекты (энтальпии) различных реакций. Но знак и величина теплового эффекта не позволяет судить о способности процессов к самопроизвольному протеканию и не содержит информации о направлении и полноте протекания процессов.
5) Энтропия, изменение при химических процессах, расчет энтропии химических реакций.
Энтропия (связанная энергия) S – это мера необратимости процесса, мера перехода энергии в такую форму, из которой она не может самостоятельно перейти в другую энергию. Энтропия характеризует беспорядок в системе, чем выше беспорядок, тем выше энтропия.
Энтропия вещества
в стандартном состоянии называется
стандартной энтропией![]() [Дж/моль
× К].
[Дж/моль
× К].
В изолированных
системах самопроизвольно протекают
процессы в направлении увеличения
энтропии(![]() ),
что является II законом термодинамики.
Процессы, для которых энтропия уменьшается
(
),
что является II законом термодинамики.
Процессы, для которых энтропия уменьшается
(![]() )неосуществимы
в изолированных системах.
)неосуществимы
в изолированных системах.
Энтропия простых веществ не равна нулю. В отличие от энтальпии можно измерить абсолютное значение энтропии. «При абсолютном нуле энтропия идеального кристалла равна нулю» – этот постулат М. Планка (1911) называют III законом термодинамики.
Изменение энтропии
химического процесса определяется
балансовым уравнением:
![]()
Любая система характеризуется энтальпией и энтропией. Их соотношение определяет направление протекания реакции.
6) Энергия Гиббса, ее применения при химических прочесах. Условие самопроизвольного протекания химических реакций. II закон термодинамики.
Суммарный эффект
двух тенденций при постоянных температуре
и давлении отражает энергия Гиббса![]() ,которая
рассчитывается по уравнению:
,которая
рассчитывается по уравнению:
![]() называемому уравнением Гиббса.
называемому уравнением Гиббса.
Функция состояния
характеризует общую движущую силу
процесса, максимально возможную полезную
работу («свободная энергия»), совершаемую
системой![]() ;
;
![]() – часть энергии, которая не может быть
превращена в полезную работу («связанная
энергия»).
– часть энергии, которая не может быть
превращена в полезную работу («связанная
энергия»).
Химические реакции
протекают в открытом сосуде с изменением
объема, поэтому возможность
(самопроизвольность) и направление
процесса характеризует функция![]() ,
определяемая по балансовому уравнению
при стандартных условиях:
,
определяемая по балансовому уравнению
при стандартных условиях:
![]() .
.
Самопроизвольно
протекают реакции, в которых изменение
свободной энергии
отрицательно. Реакции, в которых![]() ,
протекают лишь при условии, что над
системой будет совершена работа внешними
силами или системе будет передана
энергия извне.
,
протекают лишь при условии, что над
системой будет совершена работа внешними
силами или системе будет передана
энергия извне.
В изолированных системах самопроизвольно протекают процессы в направлении увеличения энтропии ( ), что является II законом термодинамики. Процессы, для которых энтропия уменьшается ( )неосуществимы в изолированных системах.
7)Скорость гомогенных и гетерогенных реакций. Зависимость скорости реакции от концентрации реагирующих веществ.
Различают гомогенные и гетерогенные химические реакции.
Гомогенные – это реакции, протекающие между веществами, находящимися в однородной среде, т. е. между ними нет границы раздела (газовая фаза, жидкая фаза). Реакции протекают равномерно по всему объему системы:
2NaOH(Ж) + H2SO(Ж) = Na2SO4(Ж) + 2Н2О(Ж).
Гетерогенные – это реакции в неоднородной среде, протекающие между веществами, находящимися в разных фазовых состояниях (твердое и жидкое вещество, газообразное и твердое вещество и пр.). Такие реакции протекают только на поверхности раздела фаз, образующих эту систему:
CaCO3(Т) + 2HCl(Ж) = CaCl2(Ж) + CO2(Г) + Н2О(Ж).
Под скоростью химической реакции понимается изменение количества вещества (моль) в единицу времени в единице реакционного пространства. Для гомогенных реакций реакционное пространство – объем,V, моль/л∙ед. времени, гетерогенных – площадь поверхности раздела фаз,V, моль/м2∙ед. времени.
Так как отношение
количества вещества к единице объема
называется концентрацией вещества (С,
моль/л), то скорость гомогенного процесса
равна изменению концентрации чаще
исходных веществ во времени:
![]()
где![]() – средняя скорость реакции, моль/л∙ед.
времени;
– средняя скорость реакции, моль/л∙ед.
времени;
![]() – изменение концентрации исходных
веществ, моль/л;
– изменение концентрации исходных
веществ, моль/л;
![]() – время протекания процесса, с, мин и
пр.
– время протекания процесса, с, мин и
пр.
Скорость реакций зависит от ряда факторов: природы реагирующих веществ, их концентрации, температуры и давления процесса, наличия в системе катализатора, а в случае гетерогенных реакций – от состояния поверхности раздела фаз.
Зависимость скорости реакции от концентрации реагентов
Чтобы произошла химическая реакция необходимо столкновение молекул реагирующих веществ. Число таких столкновений растет с увеличением числа молекул в единице объема, т. е. с возрастанием концентрации реагентов. Соответственно, с повышением концентрации реагирующих веществ увеличивается скорость реакции.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс, который был открыт опытным путем в 1867 г. К. Гульдбергом и П. Вааге (Норвегия).
Скорость химической реакции, протекающей при постоянной температуре в гомогенной среде, прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов, называемых порядками реакции по реагентам.
Рассмотрим гомогенный процесс окисления оксида азота (II):2NO(Г) + O2(Г) = 2NO2(Г).
Обозначим концентрации
реагирующих веществ:
![]() . Математическое выражение закона
действия масс для процесса примет вид:
. Математическое выражение закона
действия масс для процесса примет вид:
![]() (кинетическое
уравнение химической реакции) где
К – константа
скорости реакции.
(кинетическое
уравнение химической реакции) где
К – константа
скорости реакции.
Константа скорости реакции зависит от химической природы реагирующих веществ, температуры процесса, наличия в системе катализатора, но не зависит от концентрации реагирующих веществ.
В случае гетерогенных реакций в математическое выражение закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрации веществ, находящихся в твердой фазе, представляют собой постоянную величину и входят в константу скорости реакции.
8) Зависимость скорости реакции от природы реагирующих веществ и температуры (правило Вант-Гоффа, энергия активации).
Химическая реакцияпротекает при непосредственном столкновении молекул исходных веществ, причем последние должны обладать при этом достаточным запасом кинетической энергии, иначе их столкновение будет неэффективным.
Избыточная
кинетическая энергия, которой должны
обладать молекулы исходных веществ для
того, чтобы их столкновение могло
привести к образованию нового вещества,
называется энергией активации данного
процесса![]() , кДж/моль. Молекулы, обладающие такой
энергией, называются активными.
, кДж/моль. Молекулы, обладающие такой
энергией, называются активными.
Энергия активации – это фактор, посредством которого природа реагирующих веществ влияет на скорость реакции. Значения для химических реакций лежат в пределах 40….400 кДж/моль.Она зависит от природы реагирующих веществ, температуры, ее значения включают в специальные справочники и используют в химической технологии для расчета скоростей реакций в различных условиях. Установлено, если:
 <
40 кДж/моль, скорость очень велика, реакции
протекают практически мгновенно (ионные
реакции в растворах);
<
40 кДж/моль, скорость очень велика, реакции
протекают практически мгновенно (ионные
реакции в растворах);
> 120 кДж/моль, скорость очень мала, реакции при обычных условиях визуально не видны (синтез аммиака);
≈ 40….120 кДж/моль, скорость характерна для большинства химических реакций, её можно замерить.
прямой реакции ≠ обратной реакции.
Из уравнения
Аррениуса(![]() )
следует, что константа скорости реакции,
а, следовательно, и скорость реакции,
уменьшается с ростом энергии активации.
Повышение же температуры процесса
приводит к увеличению константы и
скорости реакции.
)
следует, что константа скорости реакции,
а, следовательно, и скорость реакции,
уменьшается с ростом энергии активации.
Повышение же температуры процесса
приводит к увеличению константы и
скорости реакции.
Зависимость скорости реакции (константы скорости) от температуры определяется правилом Я. Вант-Гоффа (Голландия, 1884 г.).
При повышении
температуры на 10 градусов скорость
большинства реакций увеличивается в
2–4 раза:
![]()
С увеличением температуры растет число молекул, кинетическая энергия которых равна или выше энергии активации , следовательно, растет доля молекул, способных к активным столкновениям с образованием активированного комплекса, т. е. происходит ускорение реакции.
9) Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия.
Химические реакции по признаку обратимости делятся на необратимые и обратимые. К необратимым реакциям относятся такие реакции, которые протекают до тех пор, пока один из реагентов полностью не израсходуются. Признаками необратимых реакций, протекающих в растворах, являются: а) выпадение осадка, б) образование газа, в) образование малодиссоциирующего вещества. Обратимыми реакциями называются такие реакции, которые протекают одновременно в двух взаимно противоположных направлениях. Для подобных реакций вместо знака равенства пользуются противоположно направленными стрелками (↔).
Количественной
характеристикой состояния равновесия
является константа химического
равновесияК,
которая определяется отношением констант
скоростей прямой и обратной реакцией![]() .В
подавляющем большинстве случаев
константы скоростей прямой и обратной
реакций не равны. Константа равновесия
– постоянная при данной температуре
величина и определяет соотношение между
равновесными концентрациями продуктов
реакции и исходных веществ, возведенных
в степени их стехиометрических
коэффициентов.
.В
подавляющем большинстве случаев
константы скоростей прямой и обратной
реакций не равны. Константа равновесия
– постоянная при данной температуре
величина и определяет соотношение между
равновесными концентрациями продуктов
реакции и исходных веществ, возведенных
в степени их стехиометрических
коэффициентов.
При некоторой
температуре энтальпийный и энтропийный
факторы уравниваются, две противоположные
тенденции уравновешивают друг друга
т.е.
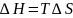 .
В этом случае соблюдается уравнение
.
В этом случае соблюдается уравнение
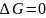 ,
которое является термодинамическим
условием химического равновесия.
,
которое является термодинамическим
условием химического равновесия.
