
Химия Соснина
.pdf
перемещаться по всему объему кристалла и служить переносчиками электрического тока. К диэлектрикам относятся многие вещества с ионными и молекулярными кристаллическими структурами, например кристалл хлорида натрия NaCl (∆Е ≈ 8 эВ, при t
=0 °C).
9.Ширина запрещенной зоны полупроводников не велика (∆Е = 0,1…4 эВ).При низких температурах полупроводники проявляют свойства изоляторов. С повышением температуры энер
валентных электронов возрастает и становится достаточной для преодоления запрещенной зоны. Электроны переходят из валентной зоны в зону проводимости, а в валентной зоне появляются вакансии – положительно заряженные дырки (рис. 28).
Наличие подвижных электронов n и дырок р обеспечивает электронно-дырочную или собствен проводимость полупроводника (n-p-типа). При наложении внешнего электрического поля наблюдае движение электронов в направлении к (+) полюсу, а дырок – к (–) полюсу. К типичным собственным полупроводникам относятся кристаллы кремния Si (∆Е = 0,75 эВ, при t = 0 °C) и германия Ge (∆Е = 1, эВ, при t = 0 °C). Для каждого полупроводника электронно-дырочная проводимость наступает при ра температуре, которая тем выше, чем больше величина запрещенной зоны ∆Е полупроводника.
Полупроводниковыми свойствами могут обладать практически все кристаллы с атомными кристаллическими решетками. Полупроводниковые материалы подразделяются на элементарные полупроводники (табл. 4) и сложные полупроводники – химические соединения.
Таблица 4
Элементарные полупроводники
Номер группы ПСЭ |
Химический элемент |
|
III A |
B |
|
IV A |
C, Si, Ge, Sn (серое) |
|
V A |
P, As, Sb, Bi |
|
VI A |
S, Se, Te |
|
VII A |
J |
|
|
|
Ширина запрещенной зоны полупроводника зависит от энергии связи и структурных особенностей его кристаллической решетки. К полупроводникам с узкой запрещенной зоной относятся Sn-серое, Р-черный, Te. У последнего заметный перенос электронов в зону проводимости происходит уже за счет лучистой энергии. Полупроводникам с широкой запрещенной зоной: B, Si – требуется мощный тепловой или энергетический импульс, Салмаз – γ облучение.
Широкое применение полупроводников привело к созданию новых сложных полупроводниковых систем на основе химических соединений, которые чаще всего имеют алмазоподобную кристаллическую решетку: AlP, ZnGe, InSb, AgJ и др. В последнее время широкое распространение получили полупроводниковые материалы на основе оксидов:
Cu2O, Mn2O3, Al2O3, ZnO; сульфидов: PbS, ZnS, Bi2S3, селенидов: CdSe, PbSe и др.
2.3.4. Реальные кристаллы, полупроводники с примесными дефектами
Все рассмотренные выше характеристики кристаллических структур относятся к «идеальным» кристаллам, в которых положение частиц в решетке соответствует минимальному значению энергии кристалла.
В реальных кристаллах наблюдаются нарушения ближнего и дальнего порядков, т. е. не все частицы находятся в положениях, отвечающих min энергии. Структурные нарушения в реальных кристаллах называют дефектами. Иногда они сообщают твердым телам весьма ценные свойства, в связи с чем их порой создают искусственным путем.

Основные причины возникновения дефектов:
1– тепловое движение частиц, формирующих кристалл;
2– наличие в структуре кристалла химических примесей;
3– внешние механические нагрузки.
Если в результате теплового колебания частица или группа частиц приобретают повышенную кинетическую энергию, они покидают узлы кристаллической решетки. В зависимости от геометрии возникающих при этом дефектов их можно разделить на три группы: точечные, линейные и поверхностные. Наибольшее влияние на химические и физические свойства кристаллов оказывают именно точечные дефекты.
Точечные дефекты возникают тогда, когда атомы, молекулы или ионы покидают свои места в узлах кристаллической решетки и переходят или на поверхность кристалла или в междоузлие, оставляя в решетке незаполненный узел, называемый вакансией (рис. 29).
Если подобные дефекты возникают в ионных кристаллах, то под действием электрического тока ближайший к вакансии ион переходит на ее место, а в точке его прежнего нахождения создается новая вакансия, занимаемая в свою очередь соседним ионом. Подобные перемещения ионов обеспечивают ионную проводимость кристалла. Кристаллические вещества, обладающие ионной проводимостью, называют твердыми электролитами. Однако, точечные дефекты, приводящие к образованию вакансий, ослабляют связи между частицами в кристаллах любого типа и существенно снижают механические характеристики кристаллов, особенно
,
Сильно влияют на свойства твердых тел точечные примесные дефекты. При образовании последних частицы примесей (молекулы, атомы или ионы) располагаются или в узлах кристаллической решетки, вытесняя из них частицы основного вещества, или занимают место в междоузлиях.
Рассмотрим влияние примесей на электропроводность полупроводниковых кристаллов.
Пример примесной проводимости полупроводника n-типа.
Предположим в кристалле германия Ge один из атомов германия замещен на атом cурьмы Sb. Ge – элемент IV группы, имеет на внешнем энергетическом уровне в возбужденном состоянии 4 неспаренных электрона …..4s14p3, электронные облака которых находятся в состоянии sp3 гибридизации. В кристалле каждый атом Ge связан с четырьмя соседними атомами sp3 гибридными электронными облаками (рис. 30).
Sb – это элемент V группы, на внешнем энергетическом уровне атома находится пять электронов……5s25p3. Четыре валентных электрона атома сурьмы образуют ковалентные связи с четырьмя соседними атомами германия, а один электрон переходит на возбужденную сферическую орбиталь. Так как этот электрон принадлежит отдельному атому (примесный атом Sb), он не может свободно перемещаться по всему объему кристалла и участвовать в электропроводности. При передаче кристаллу германия небольшой величины энергии (≈ 4,4 кДж/моль) возбужденный электрон примесного атома легко проникает из

валентной зоны в зону проводимости, а атом сурьмы превращается в (+) ион. Электрическая нейтральность кристалла при этом сохраняется.
Примеси, атомы которых способны отдавать электроны, усиливая в полупроводнике электронную проводимость n-типа, называются
донорами. Относительно кристаллов германия Ge и кремния Si, полупроводников с атомно-ковалентной кристаллической решёткой, донорами являются атомы элементов V группы (As, Sb, P), а также золото Au.
Пример примесной проводимости полупроводника р-типа.
Предположим в кристалле германия Ge один из атомов германия замещен на атом индия In. Индий – элемент III группы, на внешнем энергетическом уровне имеет 3 валентных электрона. У возбужденного атома In структура внешнего энергетического уровня имеет вид: ….5s15p2. При образовании ковалентной связи с атомами германия в кристалле образуется дефицит одного электрона в каждом узле решетки, где находится атом индия
(рис. 31).
При сообщении кристаллу небольшой энергии (≈ 5,5 кДж/моль) атом индия захватывает недостающий электрон с соседней ковалентной связи, превращаясь в (–) заряженный ион и образуя вблизи себя (+) дырку. Образовавшаяся дырка становится носителем зарядов при помещении кристалла полупроводника в электрическое поле. Электрическая нейтральность кристалла при этом сохраняется.
Примеси в кристалле полупроводника, атомы которых усиливают дырочную проводимость р-типа, называются акцепторами. Относительно кристаллов германия

Ge и кремния Si, полупроводников с атомно-ковалентной кристаллической решёткой, акцепторами являются элементы III группы: Al, Ga, In, B, а так же Zn, Fe, Mn.
Варьируя химическую природу и концентрацию вводимых в кристалл примесей, можно получить полупроводник с заданным типом и величиной электрической проводимости.
В зависимости от преобладания того или иного типа проводимости примесных полупроводников различают полупроводники n-типа и р-типа. Для кристалла Ge наиболее характерна проводимость n-типа, для Si – р-типа.
Системы, состоящие из 2 и 3 полупроводников с различным типом проводимости, широко применяются в технике. При производстве выпрямителей переменного тока (диодов) используют n-p переходы, р-n-p или n-p-n переходы применяются при изготовлении транзисторов (триодов).
2.4. Примеры выполнения индивидуальных заданий по разделу «Строение и свойства вещества»
Пример 1. Записать электронную формулу атома элемента с порядковым номером 42. Указать число протонов и нейтронов в ядре, количество электронов на энергетических уровнях. Составить графическую схему заполнения электронами энергетических уровней атома. Указать семейство элемента, принадлежность к типу элементов (металл, неметалл, инертный элемент, переходный элемент). Определить число валентных электронов в нормальном и возбужденном состоянии атома. Указать возможные валентности атома и записать формулы оксидов и гидроксидовэтого элемента, отметив их тип.
Согласно положению в ПСЭ под № 42 расположен элемент молибден  . Количество протонов в ядре атома ∑р= 42, ∑р равно количеству электронов на энергетических уровнях атома ∑℮ = 42. Количество нейтронов в ядре атома равно: ∑n = А
. Количество протонов в ядре атома ∑р= 42, ∑р равно количеству электронов на энергетических уровнях атома ∑℮ = 42. Количество нейтронов в ядре атома равно: ∑n = А
– ∑р = 96 – 42 = 54.
 находится в пятом периоде (n = 5), VIB группе ПСЭ, следовательно, 42 электрона атома располагаются на 5 энергетических уровнях, а max (характеристическая)
находится в пятом периоде (n = 5), VIB группе ПСЭ, следовательно, 42 электрона атома располагаются на 5 энергетических уровнях, а max (характеристическая)
валентность атома равна 6, т. е. номеру группы. Электронная формула атома (см. разд. учебного пособия 2.1.4.) имеет вид: 1s22s22p63s23p64s23d104p65s24d4.
Для составления графической схемы заполнения электронами энергетических уровней атома воспользуемся теоретическими сведениями разд. 2.1.2., 2.1.3. Изобразим сетку атомных электронных орбиталей атома молибдена:
Согласно принципу min энергии в многоэлектронных атомах энергия электронов на подуровнях 1s, 2s, 2p, 3s, 3p нарастает последовательно, так как еще не проявляется экранирование электронов от ядра. Поэтому эти подуровни заполняются электронами по принципу Паули и правилу Гунда последовательно.

Из 42 электронов 18 распределено на орбиталях, для того чтобы определить, на какой энергетический подуровень пойдут следующие электроны, воспользуемся правилом Клечковского, подсчитаем сумму главного и орбитального квантовых чисел для 4s- и 3d-подуровней:
4s (4 + 0 = 4); 3d (3 + 2 = 5).
Так как на 4s-подуровне сумма ниже, там ниже энергия электронов, и электроны, согласно принципу min энергии, сначала заполнят орбитали 4s-подуровня, а затем 3d. Для контроля определим сумму главного и орбитального квантовых чисел для 4рподуровня: 4 + 1 = 5, она также равна 5, поэтому электроны сначала заполняют подуровень с меньшим значением главного квантового числа, т. е. 3d.
После заполнения электронами 3d-подуровня на орбиталях распределено 30 электронов. Следующие 6 электронов, как определено ранее, пойдут на 4р-подуровень.
Оставшиеся 6 электронов заполняют орбитали на подуровнях, также по
правилу Клечковского: 4d (4 + 2 = 6); 5s (5 + 0 = 5). Энергия электронов на 5s-подуровне ниже, чем на 4d, поэтому сначала 2 электрона заполнят 5s-подуровень, а затем оставшиеся четыре пойдут на 4d-подуровень, при этом по правилу Гунда электроны располагаются по одному на каждой орбитали.

Остальные орбитали у атома молибдена остаются свободными.
Так как последний формирующий электрон в атоме молибдена располагается на d- подуровне, молибден относится к элементам d-семейства. На внешнем 5s-уровне у атома молибдена имеется 2 электрона, следовательно, молибден относится к металлам, однако, являясь d-элементом, в высших валентностях он может проявлять неметаллические свойства.
Валентность d-элементов определяется числом неспаренных электронов на внешнем s-подуровне и предвнешнемd-подуровне в нормальном и возбужденном состоянии. При возбуждении атома молибдена электроны на 5s-подуровне расспариваются, и один переходит на свободную орбиталь 5р-подуровня. Таким образом, молибден может проявлять валентности (положительные степени окисления): 2, 3, 4, 5, 6, но наиболее распространены соединения молибдена (II, III, IV, VI).
В основных указанных валентностях формулы оксидов молибдена: МоО, Мо2О3, МоО2, МоО3. В низшей валентности (II) оксиды молибдена – основные, в средних (III, IV)
– амфотерные, в высшей (VI) – кислотные.
Поэтому соответствующие им формулы гидроксидов имеют вид: Мо(ОН)2, Мо(ОН)3, Мо(ОН)4, Н2МоО4.
Пример 2. Какой тип химической связи существует между атомами в молекуле BCl3? Указать полярность отдельных связей и в целом молекулы, тип гибридизации электронных облаков и форму молекулы.
Определяем положение элементов B и Cl в ПСЭ, число и тип валентных электронов на внешнем энергетическом уровне атомов.

 Атом
Атом 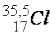 находится в 3-м периоде VIIА группе ПСЭ, относится к р-элементам, в нормальном (невозбужденном) состоянии имеет один неспаренный электрон на 3р-энергетическом подуровне, который и участвует в
находится в 3-м периоде VIIА группе ПСЭ, относится к р-элементам, в нормальном (невозбужденном) состоянии имеет один неспаренный электрон на 3р-энергетическом подуровне, который и участвует в
образовании химической связи с атомом бора, форма электронного облака:

Атом находится во 2-м периоде IIIА группе ПСЭ, относится к p-элементам, в нормальном (невозбужденном) состоянии имеет три электрона на внешнем (втором) энергетическом уровне: два – на 2s- и один – на 2р-подуровнях:
При передаче атому бора энергии происходит расспаривание 2s-электронов и переход одного из них на 2р-подуровень:
В образовании химической связи с атомами хлора в молекуле BCl3 участвуют три валентных электрона атома бора, которые находятся в состоянии sp2 гибридизации (см. п. 2.2.2). Пространственная структура молекул), форма каждой гибридной орбитали – неправильная восьмерка (см. рис. 10). Три гибридные орбитали атома бора располагаются в плоскости под углом 1200 друг к другу (см. рис. 12). Каждая гибридная орбиталь атома бора перекрывается с валентной р-орбиталью атома хлора, образуя σ-связь (см. рис. 7). Таким образом, в молекуле BCl3 образуются три ковалентные σ-связи, каждая из которых – полярна.
Полярность связей определяется величиной электроотрицательности атомов: ЭОВ – 2,0; ЭОCl – 3,0. Электронная плотность смещается к атому Cl, как более электроотрицательному. Схематично форму молекулы BCl3 можно представить:

Молекула BCl3 – плоская, треугольная, симметричная, неполярная, так как результирующий дипольный момент молекулы равен нулю.
Пример 3. Чем отличается структура кристалла CaF от структуры
кристаллов Са(К) и F2(К). Какие виды связи существуют в кристаллах этих веществ, и как это влияет на свойства веществ в конденсированном состоянии?
Определяем положения элементов Ca и F в ПСЭ, составляем электроннографические схемы атомов элементов, указываем их тип.
Са относится к s-элементам и является типичным металлом, на внешнем энергетическом уровне атома имеется 2 электрона. При возбуждении атома 4s-электроны распариваются, и один электрон переходит на свободную орбиталь4р-подуровня. В конденсированном состоянии Са образует металлическую кристаллическую структуру с явно выраженным металлическим типом связи. Кристалл Са(К) обладает металлическим блеском, электро- и теплопроводен, ковкий, но достаточно твердый металл, со средней температурой плавления (842 °С).
Фтор – типичный неметалл, на внешнем энергетическом уровне имеет 7 электронов, один из которых неспаренный, однако этого недостаточно для образования прочного ковалентного кристалла. Атомы F связываются неполярной ковалентной связью в 2- атомные молекулы F2, которые образуют молекулярный кристалл за счет межмолекулярного взаимодействия. Так как в узлах кристаллической структуры фтора находятся неполярные молекулы, в кристалле преобладают слабые силы дисперсионного взаимодействия. Кристалл фтора непрочен, хрупок, обладает очень низкой температурой плавления (-220 0С), вещество легко возгоняется, является изолятором.
При образовании кристалла CaF2 между атомами Са и F образуется ионная связь, так как разница вэлектроотрицательности атомов велика (ЭОСа = 1,0; ЭОF = 4,0), что приводит к образованию кристалла с ионной кристаллической структурой. Вещество растворимо в полярных растворителях (воде), твердость его намного выше, чем у кристаллического фтора, но по прочности и величине температуры плавления кристалл CaF2 уступает Са(К). При обычных условиях кристалл CaF2 относится к классу изоляторов, однако с повышением температуры усиливаются точечные дефекты кристалла: за счет

интенсивного теплового движения ионы покидают узлы кристаллической решетки и переходят в междоузлие или на поверхность кристалла. При помещении кристалла в электрическое поле наблюдается направленное перемещение ионов в вакансии, образованные ушедшими ионами. Таким образом, осуществляется ионная проводимость кристалла CaF2.
Пример 4. Охарактеризовать структуру и свойства кристалла кремния Si(К). Как изменяется собственная проводимость кристалла кремния при
наличии примесных дефектов: таллия Tl и висмута Bi?
 , электронная формула атома: 1s22s22p63s23p2, электронно-графическая схема в возбужденном состоянии атома имеет вид:
, электронная формула атома: 1s22s22p63s23p2, электронно-графическая схема в возбужденном состоянии атома имеет вид:
На внешнем энергетическом уровне атома кремния – 4 неспаренных электрона, т.е. он типичный неметалл. Образует кристалл атомно-ковалентной структуры. В образовании кристалла кремния участвуют n атомов Si, в непрерывной энергетической зоне образуется 4n МО, из которых только половина заполняется валентными электронами, по 2 – на каждой орбитали, так формируется валентная зона кристалла. Свободные МО образуют зону проводимости, эти МО обладают более высоким уровнем энергии.
При передаче кристаллу кремния энергии в виде теплового облучения, часть валентных электронов за счет приобретения избыточной энергии распаривается, покидает валентную зону и переходит в зону проводимости. На месте этих электронов в валентной зоне образуются вакансии – (+) дырки р. Когда кристалл Si помещают в электрическое поле, к (+) полюсу внешнего источника наблюдается дрейф электронов (n), к (–) – дырок р. Такимобразом кристалл Si – полупроводник и обладает собственной электронно-дырочной проводимостью (n-p) типа.
Атом  находится в IIIA группе ПСЭ. В возбужденном состоянии на внешнем 6-м энергетическом уровне имеет 3 неспаренных электрона:
находится в IIIA группе ПСЭ. В возбужденном состоянии на внешнем 6-м энергетическом уровне имеет 3 неспаренных электрона:
Если в узле кристалла Si находится атом Tl, там наблюдается дефицит одного электрона в ковалентной связи с атомом кремния. При передаче кристаллу небольшой величины энергии, примесный атом Tl захватывает недостающий электрон с соседней ковалентной связи между атомами Si и переходит в (–) заряженный ион, а на месте захваченного электрона образуется вакансия (+) дырка р. При помещении кристалла Si в электрическое поле (+) дырка становится носителем зарядов. Таким образом, Tl – акцептор электронов и усиливает в кристалле Si дырочную (р) проводимость.
Атом  находится в VA группе ПСЭ. В возбужденном состоянии на внешнем 6-м энергетическом уровне имеет 5 неспаренных электронов:
находится в VA группе ПСЭ. В возбужденном состоянии на внешнем 6-м энергетическом уровне имеет 5 неспаренных электронов:

Если в кристалле Si присутствуют примеси Bi, то в узле кристаллической решетки, где присутствует этот атом, появляется свободный электрон, не связанный ковалентной связью с четырьмя соседними атомами кремния. При передаче кристаллу Si небольшой величины энергии этот электрон легко покидает атом Bi и переходит в зону проводимости кристалла, усиливая электронную (n) проводимость полупроводника. Таким образом, Bi – донор электронов и усиливает в кристалле Si электронную (n) проводимость.
2.5. Индивидуальные задания
2.5.1. № 3 «Строение атома и химическая связь» 2.5.2. № 4 «Строение и свойства твердых веществ» 2.5.3. Тесты промежуточного контроля
2.5.1. № 3 «Строение атома и химическая связь»
Таблица 5
|
Условия заданий |
|
|
|
№ 1 |
№ 2 |
|
|
Записать электронную формулу атома |
Какой тип химической связи |
|
|
элемента с порядковым номером №…. |
существует между атомами |
|
|
Указать число протонов и нейтронов в ядре, |
в молекуле АхВу? Указать |
|
|
количество электронов на энергетических |
число, полярность |
|
Вариант |
уровнях. Составить графическую схему |
отдельных связей и в целом |
|
заполнения электронами энергетических |
молекулы, тип гибридизации |
||
задания |
|||
уровней атома. Указать семейство элемента, |
электронных облаков атомов |
||
|
|||
|
принадлежность к типу элементов (металл, |
и форму молекулы |
|
|
неметалл, инертный элемент, переходный |
|
|
|
элемент). Определить число валентных |
|
|
|
электронов в нормальном и возбужденном |
|
|
|
состоянии атома. Указать возможные |
|
|
|
валентности атома и записать формулы |
|
|
|
оксидов и гидроксидовэтого элемента, отметив |
|
|
|
их тип и свойства |
|
|
1 |
№ 16, № 50 |
SiH4 |
|
2 |
№ 17, № 57 |
NaBr |
|
3 |
№ 15, № 41 |
BeCl2 |
|
4 |
№ 21, № 62 |
O2 |
|
5 |
№ 13, № 74 |
AlH3 |
|
6 |
№ 22, № 83 |
Br2 |
|
7 |
№ 14, № 85 |
MgCl2 |
|
8 |
№ 12, № 81 |
KBr |
|
9 |
№ 18, № 39 |
NH3 |
|
10 |
№ 19, № 54 |
GaF3 |
|
11 |
№ 20, № 84 |
GeO2 |
|
12 |
№ 18, № 72 |
BaJ2 |
|
13 |
№ 29, № 73 |
Cl2 |
|
14 |
№ 24, № 60 |
AlF3 |
|
15 |
№ 23, № 79 |
SiCl4 |
|
16 |
№ 11, № 28 |
LiF |
|
|
|
|
