
Химия Соснина
.pdf
17 |
№ 31, № 51 |
CH4 |
18 |
№ 30, № 65 |
SiF4 |
19 |
№ 32, № 88 |
NaCl |
20 |
№ 33. № 82 |
InCl3 |
21 |
№ 25, № 86 |
CaF2 |
22 |
№ 26, № 66 |
SrBr2 |
23 |
№ 27, № 67 |
BaCl2 |
24 |
№ 29, № 94 |
Na2O |
25 |
№ 5, № 40 |
Li2O |
26 |
№ 6, № 41 |
BeCl2 |
27 |
№ 8, № 52 |
CsCl |
28 |
№ 9. № 49 |
J2 |
29 |
№ 10, № 53 |
F2 |
30 |
№ 12, № 61 |
MgBr2 |
|
|
|
2.5.2. № 4 «Строение и свойства твердых веществ»
Таблица 6
|
Условия заданий |
|
|
|
|
||
|
№ 1 |
№ 2 |
|
|
Чем отличается структура и свойства |
Охарактеризовать структуру и |
|
Вариант |
кристаллов А(К) и В(К) от структуры |
свойства кристалла А(К). Как изме- |
|
кристалла АхВу (К). Какие виды |
няется собственная |
||
задания |
|||
связисуществуют в кристаллах этих типов |
проводимость этого кристалла |
||
|
|||
|
и как это влияет на свойства веществ в |
при наличии в |
|
|
конденсированном состоянии? |
нем примесныхдефектов? |
|
1 |
А – Н2(К); В – Сал(К); АхВу (К) – СН4(К) |
A – B(K); примеси: Zn, Sb |
|
2 |
А – Si(K); В – F2(K); АхВу (К) – SiF4(K) |
A – Si(K); примеси: Al, As |
|
3 |
A – Zn(K); B – Br2(K); АхВу (К) – ZnBr2(K) |
A – Ge(K); примеси: Ga, As |
|
4 |
A– Mg(K);B – Cl2(K); АхВу(К) – MgCl2(K) |
A – Sn(серое)(K); примеси: Ga, Bi |
|
5 |
А – BaK); В – NO2(K); АхВу(К) – Ba(NO3)2(K) |
A – P(K); примеси: Ga, Bi |
|
6 |
А – Ni(K); В – Cl2(K); АхВу (К) – NiCl2(K) |
A – As(K); примеси: Ga, Se |
|
7 |
А – Na(K); В – O2(K); АхВу (К) – Na2O(K) |
A – Sb(K); примеси: Zn, Te |
|
8 |
А – Pb(K); В – CH3COOH(K); |
A – Bi(K); примеси: Mg, Te |
|
АхВу (К) – PB(CH3COO)2(K) |
|
||
|
|
||
9 |
А – H2(K); В – J2(K); АхВу (К) – HJ(K) |
A – Sb(K); примеси: In, Se |
|
10 |
А – Ca(K); В – CO2(K); АхВу(К) – CaCO3(K) |
A – Te(K); примеси: J, Al |
|
11 |
А – Al(K); В – SO3(K); АхВу(К) – Al2(SO4)3(K) |
A – J2(K); примеси: B, Te |
|
12 |
А – Cu(K); В – Cl2(K); АхВу (К) – CuCl2(K) |
A – Se(K); примеси: J, Sb |
|
13 |
А – Ge(K); В – Cl2(K); АхВу (К) – GeCl4(K) |
A – Si(K); примеси: Cd, Sb |
|
14 |
А – Fe(K); В – O2(K); АхВу (К) – Fe2O3(K) |
A – Ge(K); примеси: Cd, Ta |
|
15 |
А – Cu(K); В – J2(K); АхВу (К) – CuJ2(K) |
A – Ge(K); примеси: In, P |
|
16 |
А – B(K); В – J2(K); АхВу (К) – BJ3(K) |
A – Bi(K); примеси: In, Se |
|
17 |
А – K(K); В – Cl2(K); АхВу (К) – KCl(K) |
A – B(K); примеси: Be, Se |
|
18 |
А – Al(K); В – H2O(K); АхВу (К) – Al(OH)3(K) |
A – Cал(K); примеси: In, Sb |
|
19 |
А – S(K); В – O2(K); АхВу (К) – SO2(K) |
A – Te(K); примеси: Ga, Se |
|
20 |
А – Na(K); В – CO2(K); |
A – S(K); примеси: J, Sb |
|
АхВу (КР) – Na2CO3(K) |
|
||
|
|

21 |
А – Cr(K); В – Cl2(K); АхВу (К) – CrCl3(K) |
A – As(K); примеси: In, Se |
22 |
А – Si(K); В – H2(K); АхВу (К) – SiH4(K) |
A – Sb(K); примеси: Al, Te |
23 |
А – Ag(K); В – Cl2(K); АхВу (К) – AgCl(K) |
A – P(K); примеси: Al, Se |
24 |
А – Cu(K); В – NO2(K); |
A – Si(K); примеси: In, Se |
АхВу (КР) – Cu(NO3)2(K) |
|
|
|
|
|
25 |
А – Mn(K); В – H2O(K); АхВу(К) –Mn(OH)2(K) |
A – Si(K); примеси: B, As |
26 |
А – Ba(K); В – SO3(K); АхВу (К) – BaSO4(K) |
A – Sb(K); примеси: Sn, Zn |
27 |
А – Cгр(K); В – O2(K); АхВу (К) – CO2(K) |
A – S(K); примеси: B, J |
28 |
А – Ве(K); В – F2(K); АхВу (К) – BeF2(K) |
A – Si(K); примеси: P, Ga |
29 |
А – Ti(K); В – Cl2(K); АхВу (К) – TiCl4(K) |
A – Ge(K); примеси: P, B |
30 |
А – Li(K); В – Cl2(K); АхВу (К) – LiCl(K) |
A – Te(K); примеси: Sb, Ga |
2.5.3. Тесты промежуточного контроля
1. Ядро атома некоторого элемента содержит 28 нейтронов, а электронная оболочка этого атома – 23 электрона. Из перечисленных элементов указать элемент, изотопом которого является атом этого элемента:
1) ;
;
2) ;
;
3) ;
;
4) .
.
2.Атомная (ковалентная) кристаллическая решётка характерна для кристалла:
а) NiCl2(К); б) H2O(К);
в) Si(К); г) Na(К).
3.Полярность ковалентной связи между атомами тем выше, чем больше разница
в
величине………………..атомов.
4.Основными признаками, отличающими агрегатные состояния веществ (г, ж, т), являются:
а) размеры частиц и их строение; б) заряд частиц и их внутренняя энергия;
в) вид атомов, образующих молекулы или ионы; г) соотношение кинетической и потенциальной энергий частиц и расстояние ме-
жду ними.
5.Орбитальное квантовое число l электронов в атоме равно 3, тогда магнитное квантовое число mпринимает значения:……………
6.Число вакантных 3d-орбиталей атома ванадия 23V в невоздуждён-
ном состоянии равно……… (при ответе пользуйтесь ПСЭ).
а) 3; б) 5; в) 2; г) 1.
7. Молекулярная кристаллическая решётка характерна для кристалла:
а) NiCl2(К);
б) H2O(К);
в) Si(К);
г) H2SO4(К).
8.Двойственные свойства электронов в атоме проявляются в том, что:
1)электрон проявляет свойства вещественной и полевой материи;
2)электрон обладает массой покоя и является заряженной частицей;
3)энергетическое состояние электрона характеризуется его положением на энергетических уровнях и подуровнях атома;
4)электрон – неделимая частица, и координаты нахождения его в пространстве не определяются.
9.Свойства химических элементов с увеличением порядкового номера элемента по периодам ПСЭ изменяются:
1)увеличивается диаметр атома, и усиливаются восстановительные свойства элементов;
2)уменьшается диаметр атома, и ослабляются окислительные свойства;
3)уменьшается диаметр атома, и усиливаются металлические свойства элементов;
4)уменьшается диаметр атома, и усиливаются окислительные свойства элементов.
10.Какая электронно-графическая структура атома является неверной и почему: 1S22S22P63S23d2; 1S22S22P63S23P64S1?
11.Электронная структура атома описывается формулой: 1s22s22p63s23p64s23d4.
Какому из указанных ниже химических элементов соответствует эта электронная формула:
1)As;
2)Ca;
3)Pb;
4)Cr? (при ответе пользуйтесь ПСЭ).
12.Ядро атома состоит из: …………………
13.Заряд электрона равен:……………………
14.К какому электронному семейству относится элемент № 16: s-, p-, d-, f-?
15.Электроотрицательностью атома называется: ……………..
16.Область пространства в атоме, в котором находится электрон, называется………………
3.ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
3.1. Энергетика химических процессов
3.1.1. Тепловой эффект химических реакций, термохимические уравнения процессов 3.1.2. Понятия о внутренней энергии и энтальпии химической системы, энтальпия
фазовых переходов 3.1.3. Энтальпия образования сложного вещества, закон Гесса
3.1.4. Самопроизвольные процессы, энпротия химических систем 3.1.5. Энергия Гиббса, направленность процессов
3.1.6. Примеры выполнения индивидуальных заданий по разделу «Энергетика химических процессов»

3.1.7. Индивидуальные задания № 5 «Термодинамические расчеты в химических реакциях»
3.1.8. Тесты промежуточного контроля
Химической системой называют группу веществ, находящихся в ограниченном объёме, всё, что окружает эту систему, составляет внешнюю среду.
Химические системы бывают открытыми (обмен с внешней средой веществом и энергией), закрытыми (обмен с внешней средой только энергией)
и изолированными (никакого обмена с внешней средой).
При протекании многих химических реакций изменяется энергетическое состояние химической системы. Реакции горения, нейтрализации, взаимодействия металлов с кислотами сопровождаются выделением тепла; процесс растворения солей в воде чаще всего идёт с поглощением тепла; при работе аккумуляторов и гальванических элементов выделяется электрическая энергия; реакции фотосинтеза, люминесценции, фотоэффекта сопровождаются световыми эффектами; при взрывах химические процессы идут с выделением механической энергии.
Возможность самопроизвольного перехода химической системы из одного состояния в другое и энергетические эффекты этих процессов изучает химическая термодинамика.
Энергетику любого химического процесса схематично можно представить рис. 32.
Рис. 32. Принципиальная схема химического процесса
Соотношение между потребляемой и выделяющейся энергиями в ходе реакции
(Епотребляемая <,=,> Евыделяемая) определяет величину и знак энергетического эффекта процесса, вид же энергии зависит от химической природы и агрегатного состояния
исходных веществ и продуктов реакции.
3.1.1. Тепловой эффект химических реакций, термохимические уравнения процессов
Раздел химии – термохимия изучает тепловые эффекты химических реакций.

Тепловым эффектом  [кДж/моль, кДж] называется выделение или поглощение тепловой энергии системой при протекании в ней химической реакции, при условии, что система не совершает никакой другой работы кроме работы расширения.
[кДж/моль, кДж] называется выделение или поглощение тепловой энергии системой при протекании в ней химической реакции, при условии, что система не совершает никакой другой работы кроме работы расширения.
Химические процессы бывают:
–экзотермические (идут с выделением тепла) +  ;
;
–эндотермические (идут с поглощением тепла) –  .
.
При постоянстве параметров внешней среды процессы бывают:  = Const (изохорические) ±
= Const (изохорические) ±  ;
;
 = Const (изобарические) ±
= Const (изобарические) ±  ;
;
 = Const (изотермические)
= Const (изотермические)  = 0;
= 0;
 = Const,
= Const,  = Const (изобарно-изотермические)
= Const (изобарно-изотермические)  = 0. Уравнения процессов, в которых указаны тепловые эффекты,
= 0. Уравнения процессов, в которых указаны тепловые эффекты,
называются термохимическими, в них также отмечается агрегатное состояние веществ и допускаются дробные стехиометрические коэффициенты:
2H2 + O2 = 2H2O – обычная запись уравнения реакции;
Н2(Г) + 1/2О2(Г) = Н2О(Г) + 241,6 кДж/моль; Н2(Г) + 1/2О2(Г) = Н2О(Ж) + 285,8 кДж/моль.
Величина и знак теплового эффекта  процесса зависит от химической природы исходных веществ и продуктов реакции, их агрегатного состояния и начальной температуры процесса.
процесса зависит от химической природы исходных веществ и продуктов реакции, их агрегатного состояния и начальной температуры процесса.
3.1.2. Понятия о внутренней энергии и энтальпии химической системы, энтальпия фазовых переходов
Термодинамические свойства химической системы можно выразить с помощью нескольких функций состояния:
–внутренняя энергия  ;
;
–энтальпия  ;
;
–энтропия  ;
;
–энергия Гиббса или изобарно-изотермический потенциал  .
.
Значения функций зависят от состава и внутреннего строения вещества, а также внешних условий: давления, температуры, концентрации и пр.
Внутренняя энергия системы  – это её суммарная энергия, включающая энергию взаимодействия и движения молекул, атомов, ядер, электронов в атомах, внутриядерную
– это её суммарная энергия, включающая энергию взаимодействия и движения молекул, атомов, ядер, электронов в атомах, внутриядерную
и другие виды энергии, кроме кинетической  и потенциальной
и потенциальной  энергии системы, как целого:
энергии системы, как целого:
. (16)
Абсолютную величину внутренней энергии замерить невозможно, однако, можно
определить её изменение ( ) при переходе системы из начального в конечное состояние:
) при переходе системы из начального в конечное состояние:
. |
(17) |

Рассмотрим пример. 1 моль Zn реагирует с 1 молем H2SO4 в изохорных условиях (  = Const), процесс – экзотермический, о прохождении реакции судим по
= Const), процесс – экзотермический, о прохождении реакции судим по
выделяющемуся теплу. Обозначим внутреннюю энергию исходных веществ  ,
,
продуктов реакции –  .
.
Zn + H2SO4 =
ZnSO4 + H2↑
Zn(Т) + H2SO4(Ж) = ZnSO4(Ж) + H2(Г)↑ + 
>
Тепло передаётся системой в окружающую среду за счёт уменьшения внутренней
энергии исходных веществ |
, следовательно: |
, |
|
< 0; |
(18) |
|
. |
(19) |
В химических реакциях, протекающих при постоянном объёме ( = Const), изменение внутренней энергии системы
= Const), изменение внутренней энергии системы  равно изохорному тепловому эффекту
равно изохорному тепловому эффекту
реакции  , взятому с противоположным знаком.
, взятому с противоположным знаком.
Таким образом, изменение внутренней энергии системы  можно измерить с
можно измерить с
помощью теплоты  . Теплота – это количественная мера хаотичного движения частиц данной системы, при этом не происходит переноса вещества от одной системы к другой.
. Теплота – это количественная мера хаотичного движения частиц данной системы, при этом не происходит переноса вещества от одной системы к другой.
Рассмотрим тот же процесс, но протекающий в изобарных условиях  = Const (реакция идет в цилиндре с подвижным поршнем, рис. 33). Перед началом реакции поршень находится в положении hН. После полного растворения 1 моля Zn в 1 моле H2SO4 выделился 1моль H2.
= Const (реакция идет в цилиндре с подвижным поршнем, рис. 33). Перед началом реакции поршень находится в положении hН. После полного растворения 1 моля Zn в 1 моле H2SO4 выделился 1моль H2.
В результате выделения газа поршень переместился в положение hК, пройдя расстояние ∆h. Следовательно, объем продуктов реакции больше объема исходных веществ: (

 = S∆h,
= S∆h,
S – площадь поршня).

Рис. 33. Схема изобарного процесса
Тепловой эффект изобарного процесса  меньше аналогичного теплового
меньше аналогичного теплового
эффекта изохорного процесса  на величину работы расширения
на величину работы расширения  , которую совершила химическая система над внешней средой в результате выделения газа (Н2):
, которую совершила химическая система над внешней средой в результате выделения газа (Н2):
(20)
Работу расширения  можно представить:
можно представить:
, |
(21) |
где 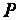 – постоянное давление;
– постоянное давление;  – изменение объема системы.
– изменение объема системы.
Работа  – количественная мера направленного движения частиц в системе, мера энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой.
– количественная мера направленного движения частиц в системе, мера энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой.
Следовательно,  можно выразить:
можно выразить:
|
. |
(22) |
|
Воспользовавшись формулой 19, получим: |
|
|
или |
(23) |
|
Обозначим: |
(24) |
где |
– энтальпия системы. |
|

Энтальпия  – это энергия расширенной системы (термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении).
– это энергия расширенной системы (термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении).
Так как |
(25) |
(26)
В химических реакциях, протекающих при постоянном давлении
( = Const), изменение энтальпии системы равно изобарному тепловому эффекту реакции
= Const), изменение энтальпии системы равно изобарному тепловому эффекту реакции  , взятому с противоположным знаком.
, взятому с противоположным знаком.
Для экзотермических процессов ( )
)  ; для эндотермических процессов
; для эндотермических процессов
(–  )
)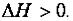
Количественные соотношения между внутренней энергией системы, теплотой и работой устанавливает первый закон термодинамики: энергия не может ни создаваться, ни исчезать, она может только переходить из одного вида в другой:
│ |
│; |
│ |
│. |
(27) |
Энтальпией фазовых переходов называется разница между тепловыми эффектами или  получения одного и того же вещества в различных агрегатных состояниях:
получения одного и того же вещества в различных агрегатных состояниях:
Н2О(Ж) |
Н2О(Г), |
.= + 44,2 кДж/моль; |
Н2О(К) |
Н2О(Ж), |
. = + 6,0 кДж/моль; |
Н2О(К) |
Н2О(Г), |
= + 50,25 кДж/моль. |
Все рассмотренные процессы являются эндотермическими.
3.1.3. Энтальпия образования сложного вещества, закон Гесса
Стандартной энтальпией (теплотой) образования сложного вещества (
 ) называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при
) называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при
стандартных условиях ( = 298 К и давлении 101 кПа).
= 298 К и давлении 101 кПа).
Пример: Ca(К) + 1/2О2(Г) = СаО(К) + 635 кДж, следовательно,
 = – 635 кДж/моль,
= – 635 кДж/моль,  = – 635 кДж/моль.
= – 635 кДж/моль.
Величины  сложных веществ занесены в таблицы термодинамических констант (см. приложение, табл. 6). Энтальпии образования простых веществ равны нулю
сложных веществ занесены в таблицы термодинамических констант (см. приложение, табл. 6). Энтальпии образования простых веществ равны нулю
( = 0).
= 0).
Как видно из этой таблицы, большинство сложных веществ образуется в экзотермических условиях.
В 1841 г. российский учёный Г.И. Гесс открыл закон, который лежит в основе термохимических расчётов:«Тепловой эффект (изменение энтальпии) реакции зависит

от химической природы и агрегатного состояния исходных веществ и продуктов реакции, но не зависит от пути её протекания, т. е. от числа и характера промежуточных стадий» (закон действует для изобарно-изотермических и изохорноизотермических процессов):
(28)
Пример: СН4(Г) + 2Н2О(Г) = СО2(Г) + 4Н2(Г)
.= |
СО2 + 4 |
Н2 – |
СН4 – 2 |
Н2О = |
=(–393,51) + 4 × 0 – (–74,85) –2(–241,8) = + 164,98 кДж.
3.2.Кинетика химических процессов и равновесие
3.2.1. Скорость химических реакций 3.2.2. Зависимость скорости реакции от концентрации реагентов
3.2.3. Зависимость скорости реакции от природы реагирующих веществ и температуры
3.2.4. Механизм химических реакций
3.2.5. Понятия о катализе 3.2.6. Необратимые и обратимые реакции, химическое равновесие
3.2.7. Смещение химического равновесия, принцип Ле Шателье 3.2.8. Примеры выполнения индивидуальных заданий по разделу «Кинетика и
равновесие химических процессов»
3.2.9.Индивидуальные задания № 6 «Кинетика и равновесие химических процессов»
3.2.10.Тесты промежуточного контроля
О принципиальной возможности протекания химических реакций судят по величине
изменения свободной энергии системы  . Однако этого недостаточно, чтобы предсказать реальную возможность химического процесса, определить скорость реакции, ее механизм, а также управлять процессом.
. Однако этого недостаточно, чтобы предсказать реальную возможность химического процесса, определить скорость реакции, ее механизм, а также управлять процессом.
Например, термодинамическая вероятность окисления водорода до газообразной воды
Н2(Г) + 1/2О2(Г) = Н2О(Г), 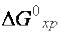 = –228,3 кДж/моль
= –228,3 кДж/моль
значительно выше, чем вероятность реакции окисления оксида азота (II)
NO(Г) + 1/2О2(Г) = NO2(Г),  = –35,1 кДж/моль.
= –35,1 кДж/моль.
В то же время первая реакция при комнатной температуре практически не протекает, и смесь водорода с воздухом может храниться в этих условиях длительное время, вторая же реакция при тех же условиях протекает мгновенно. Таким образом, для полного описания химического процесса необходимо знать закономерность протекания его во времени. Скорость и механизм химических реакций изучает химическая кинетика.
3.2.1. Скорость химических реакций
Различают гомогенные и гетерогенные химические реакции.
Гомогенные – это реакции, протекающие между веществами, находящимися в однородной среде, т. е. между ними нет границы раздела (газовая фаза, жидкая фаза). Реакции протекают равномерно по всему объему системы:
2NaOH(Ж) + H2SO(Ж) = Na2SO4(Ж) + 2Н2О(Ж).
Гетерогенные – это реакции в неоднородной среде, протекающие между веществами, находящимися в разных фазовых состояниях (твердое и жидкое вещество,

газообразное и твердое вещество и пр.). Такие реакции протекают только на поверхности раздела фаз, образующих эту систему:
CaCO3(Т) + 2HCl(Ж) = CaCl2(Ж) + CO2(Г) + Н2О(Ж).
Под скоростью химической реакции  понимается изменение количества вещества (моль) в единицу времени в единице реакционного пространства. Для
понимается изменение количества вещества (моль) в единицу времени в единице реакционного пространства. Для
гомогенных реакций реакционное пространство – объем,  ,моль/л∙ед. времени,
,моль/л∙ед. времени,
гетерогенных – площадь поверхности раздела фаз,  , моль/м2∙ед. времени.
, моль/м2∙ед. времени.
Так как отношение количества вещества к единице объема называется концентрацией вещества (С, моль/л), то скорость гомогенного процесса равна изменению концентрации чаще исходных веществ во времени:
|
(36) |
|
где |
– средняя скорость реакции, моль/л∙ед. времени; |
– изменение |
концентрации исходных веществ, моль/л;  – время протекания процесса, с, мин и пр. Скорость реакций зависит от ряда факторов: природы реагирующих веществ, их концентрации, температуры и давления процесса, наличия в системе катализатора, а в
– время протекания процесса, с, мин и пр. Скорость реакций зависит от ряда факторов: природы реагирующих веществ, их концентрации, температуры и давления процесса, наличия в системе катализатора, а в
случае гетерогенных реакций – от состояния поверхности раздела фаз.
3.2.2. Зависимость скорости реакции от концентрации реагентов
Чтобы произошла химическая реакция необходимо столкновение молекул реагирующих веществ. Число таких столкновений растет с увеличением числа молекул в единице объема, т. е. с возрастанием концентрации реагентов. Соответственно, с повышением концентрации реагирующих веществ увеличивается скорость реакции.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действия масс, который был открыт опытным путем в 1867 г. К. Гульдбергом и П. Вааге (Норвегия).
Скорость химической реакции, протекающей при постоянной температуре в гомогенной среде, прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов, называемых порядками реакции по реагентам.
Рассмотрим гомогенный процесс окисления оксида азота (II):
2NO(Г) + O2(Г) = 2NO2(Г).
Обозначим концентрации реагирующих веществ:  . Математическое выражение закона действия масс для процесса примет вид:
. Математическое выражение закона действия масс для процесса примет вид:
(37)
где  – константа скорости реакции.
– константа скорости реакции.
Константа скорости реакции  зависит от химической природы реагирующих веществ, температуры процесса, наличия в системе катализатора, но не зависит от концентрации реагирующих веществ.
зависит от химической природы реагирующих веществ, температуры процесса, наличия в системе катализатора, но не зависит от концентрации реагирующих веществ.
Уравнение (37) называется кинетическим уравнением химической реакции.
Сумма показателей степеней при концентрациях веществ в кинетическом уравнении
(n) определяет молекулярность или порядок реакции. Для уравнения (37) порядок равен: n = 2 + 1 = 3. Для одностадийных процессов n ≤ 3. При большем порядке реакции протекают в несколько стадий.
В случае гетерогенных реакций в математическое выражение закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в
