
Lekcii_po_TekhnichTermodinamike
.pdf
45
ЛЕКЦИЯ 9
Водяной пар и его свойства
В качестве реального газа рассмотрим водяной пар, который широко используется во всех отраслях техники, и прежде всего в теплоэнергетике, обладает хорошими свойствами (не токсичен, имеет большой коэффициент
объѐмного расширения) и легко поддаѐтся научным |
|
|
P |
|
|||||||
|
|
|
|||||||||
исследованиям. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
Пар - промежуточное агрегатное состояние |
|
|
|
|
|
||||||
|
|
|
|
|
|||||||
вещества между жидкостью и газом при высоких |
|
|
|
|
|
||||||
|
|
|
|
|
|||||||
температурах и низких давлениях. Паром называется |
|
|
|
|
|
||||||
реальный |
газ, близкий к |
состоянию |
насыщения и |
|
1 кг. |
|
|||||
|
H2O |
|
|||||||||
имеющий |
сравнительно |
высокую |
критическую |
|
|
||||||
|
|
|
|
|
|||||||
температуру. При сжатии пар переходит опять в |
|
|
|
|
|
||||||
жидкость, т.е. конденсируется. |
|
|
|
|
|
|
|
|
|||
|
|
|
Рис. 1.22. К определению |
||||||||
Изменения |
состояния |
водяного |
пара |
||||||||
рассмотрим в р, v - координатах. |
|
|
|
изменения состояния водяного |
|||||||
|
|
|
|
|
|
|
|
||||
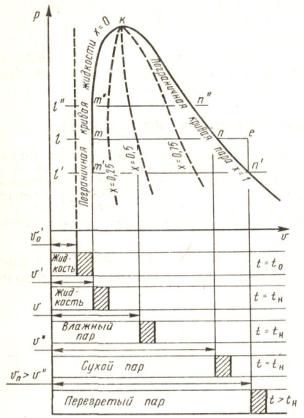
Предположим, что 1 кг воды при t = 0 С заключѐн в цилиндре, закрытом свободно движущимся невесомым поршнем, на который действует постоянное внешнее давление р.
Начальное состояние воды, находящейся под давлением р1 и имеющей
температуру 0 С, изобразим точкой О. |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При |
|
подводе |
|
теплоты |
еѐ |
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
температура постоянно повышается до тех |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
● |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пор, пока не достигнет температуры |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кипения |
ts, |
соответствующей |
данному |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
давлению. При этом удельный объѐм |
|||||||||
P2 |
|
|
|
● |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
● |
|
|
● |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
● |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
возрастает (исключая аномалию при t = |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x=1 |
|
|
|
III |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 С). |
Точка |
1 соответствует |
|
началу |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
● |
|
|
|
|
|
● |
|
|
|
|
|
|
|
|
|
|
|
|
|
● |
|
|
|
● |
|
|
|
|
|
|
|
|
|
|
|||||
|
P1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кипения. |
|
|
|
|
|
|
||||||||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
При |
дальнейшем |
подводе |
теплоты |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
начинается |
кипение |
с |
существенным |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
● |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
увеличением объѐма. В цилиндре теперь |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
A |
V` |
|
|
|
|
|
|
|
|
|
V`` |
|
|
|
V |
||||||||||||||||||||
Рис. 1.23. p, v –диаграмма |
|
|
|
|
|
|
|
|
|
|
|
|
находится двухфазная среда - смесь воды |
||||||||||||||||||||||||||||||||||
водяного пара |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
пара |
называется |
влажным |
|||||||||||||||||||||||
насыщенным паром. В точке 2 вся жидкость превращается в пар, который называется сухим насыщенным.
Насыщенным называется пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется.
Процесс парообразования идет при постоянных давлении р1 и температуре ts, соответствующей этому давлению. Удельные объемы в точках 1 и 2 соответственно v и v
и v .
.
Если продолжать подводить тепло, пар будет перегреваться. Точка 3 изображает состояние перегретого пара, в зависимости от степени перегрева
46
она может лежать на разных расстояниях от точки 2. Таким образом, перегретым называется пар, температура которого превышает температуру насыщенного пара того же давления.
Повторим опыт по парообразованию при другом давлении р2 > р1. Точка О, соответствующая состоянию 1кг воды при 0 С и новом давлении р2, остаѐтся почти на той же вертикали, т.к. вода практически не сжимаема. Точка 1 смещается вправо, т.к. с ростом давления растѐт температура кипения, а точка 2 сместится левее, поскольку удельный объѐм пара падает из-за более сильного влияния растущего давления.
Поскольку удельный объѐм жидкости растѐт, а пара падает, то при последующих увеличениях давления мы достигнем такой точки, в которой удельные объѐмы жидкости и пара сравняются. Эта точка называется критической. В критической точке различия между жидкостью и паром исчезают. Для воды параметры критической точки К составляют: ркр =
221,229 105 Па; tкр = 374,15 С; vкр = 0,00326 м3/кг.
При температурах, больших критической, возможно существование только одной фазы. Чем выше температура перегрева, тем ближе пар по своим свойствам к идеальному газу.
Если соединить одноименные точки плавной кривой, то получим нулевую изотерму I, каждая точка которой соответствует 1кг воды при 0 С и давлении р; нижнюю пограничную кривую АК, представляющую зависимость от давления удельного объѐма жидкости при температуре кипения ts и верхнюю пограничную кривую КВ, дающую зависимость удельного объѐма сухого насыщенного пара от давления.
Область II - область влажного насыщения пара (ограничена кривой АКВ), область III - область перегретого пара (справа от прямой КВ). Между нулевой изотермой I и нижней пограничной кривой АК - область не кипящей однофазной жидкости.
Уже было сказано, что область II - область влажного насыщенного пара. Состояние воды на отрезке 1-2 различается по степени сухости. Степень сухости пара x представляет собой массовую долю сухого насыщенного пара во влажном:
x mсух.пар .
mв л.пар
Для кипящей жидкости х = 0, а для сухого насыщенного пара х = 1, т.е. на нижней пограничной кривой АК: х = 0, а на верхней КВ: х = 1. На отрезке 1-2 x меняется от 0 до 1.
При подводе теплоты между точками 1 и 2 происходит процесс парообразования. Количество теплоты, необходимое для превращения 1кг воды при р = const и температуре кипения в сухой насыщенный пар той же температуры, называется теплотой парообразования и обозначается r.
Термодинамические параметры кипящей воды и сухого насыщенного пара берутся из таблиц теплофизических свойств воды и водяного пара, в которых величины с одним штрихом: v , T , S относятся к воде, нагретой до температуры кипения, а величины с двумя штрихами: v
относятся к воде, нагретой до температуры кипения, а величины с двумя штрихами: v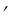 , T
, T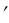 , S
, S к сухому насыщенному пару.
к сухому насыщенному пару.
47
Рассмотрим изменение состояния пара (реального газа), имеющего сравнительно высокую критическую температуру.
Изменение параметров состояния пара удобно проследить на pv-диаграмме
(рис. 8.5).
Рис. 8.5
Положим, что 1 кг жидкости при температуре t0 заключен в цилиндре, закрытом свободно движущимся невесомым поршнем, на который действует постоянное внешнее давление. Объем жидкости при указанных условиях обозначим v0'. Если считать жидкость несжимаемой при любых давлениях, то прямая, соединяющая точки l', l, l'' и параллельная оси ординат, будет определять все возможные состояния жидкости при t0. Следует отметить, что для несжимаемой жидкости эта изохора совпадает с изотермой.
Если (при постоянном давлении) подводить к жидкости теплоту, то при достижении температуры кипения tн начнется превращение жидкости в пар — точка т. Удельный объем жидкости вследствие нагрева увеличивается от v0' до v'. При более высоком давлении процесс парообразования начнется при более высокой температуре tн, следовательно, объем жидкости при достижении точки кипения будет больше, чем раньше (точка т").
На pv-диаграмме геометрическое место точек, определяющих состояние жидкости, нагретой до температуры кипения, изображается кривой m'-m-m". Эту кривую называют пограничной кривой жидкости. При дальнейшем подведении теплоты начинается процесс парообразования. При условии постоянства давления, как показывает опыт, для всех жидкостей имеет место характерное явление: температура смеси жидкости и пара остается неизменной и равной температуре кипения tн.

48
Процесс парообразования прекратится в точке n, когда вся жидкость превратится в пар. Между точками m и n система двухфазная, пар в этой области — влажный насыщенный. Влажный насыщенный пар представляет собой смесь пара с жидкостью, причем жидкость может быть сосредоточена в нижней части цилиндра или равномерно распределена в виде мельчайших капель по всему объему.
Пар, полученный при испарении всей жидкости (точка n), — сухой насыщенный. Удельный объем пара в этой точке обозначим через v". При проведении процесса парообразования при другом давлении соответственно получим точки n', n". Кривая n'-n-n" представляет собой пограничную кривую пара. Пересечение пограничных кривых жидкости и пара определяет положение критической точки K. На рис. 8.5 в области влажного насыщенного пара пунктирными линиями показаны линии постоянной сухости.
Степень сухости пара x представляет собой массовую долю сухого насыщенного пара во влажном:
x mс.п mв.п |
(8.14) |
Для точек, лежащих на пограничной кривой жидкости, x=0, для точек, лежащих на пограничной кривой пара, x=1. Если к сухому насыщенному пару продолжать подводить теплоту при постоянном давлении, то удельный объем и температура увеличиваются (vп>v", t>tн). Пар в этом состоянии называют перегретым. Начиная с точки n вправо — система однофазная.
ИЗМЕНЕНИЕ АГРЕГАТНОГО СОСТОЯНИЯ ВЕЩЕСТВА
В § 8.2 рассматривался процесс парообразования, т. е. переход из жидкого состояния в парообразное, осуществляемый при постоянном давлении. Аналогичный переход из твердого состояния в газообразное называют возгонкой или сублимацией, а из твердого состояния к жидкому — плавлением. Состояния вещества при этих превращениях считают устойчивыми, стабильными. При этом всякие изменения состояния считаются квазистатическими, как это обычно принято в термодинамике.
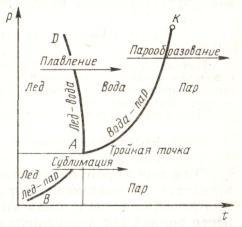
Переход из одного агрегатного состояния в другое удобно рассматривать на фазовой pt-диаграмме (рис. 8.6). На диаграмме кривая AK представляет собой зависимость между давлением сухого насыщенного пара и температурой кипения, т. е. p=f(tн) (кривая парообразования). Кривая равновесия жидкой и газообразной фаз заканчивается в критической точке K.
49
Рис. 8.6
Если от жидкости отбирать теплоту при постоянном давлении, то при определенной температуре жидкость переходит в твердое состояние. Температура, при которой осуществляется этот переход, называется
температурой затвердевания или плавления tпл, а количество теплоты,
отбираемое в этом процессе, называется теплотой плавления. При плавлении, так же как и при парообразовании, вещество находится в двух фазах. Аналогично кривой AK можно построить кривую плавления AD, которая однозначно определяется зависимостью p=f(tпл).
Кривая сублимации AB представляет собой зависимость p=f(tс) для перехода твердого тела в газообразное. Этот переход при температуре сублимации tc происходит вследствие подведения некоторого количества теплоты, носящего название теплоты сублимации. Точки этой кривой соответствуют двухфазной системе твердое тело — газ (например, водяной пар над поверхностью льда).
Все три кривые равновесия (парообразования, плавления и сублимации) пересекаются в некоторой характерной для каждого вещества точке. Эта точка
(A) называется т р о й н о й т о ч к о й , а изображаемое ею состояние — фундаментальным. В этой точке находятся в термодинамическом равновесии три фазы вещества: твердая, жидкая и газообразная.
Рассмотрение описанных процессов показывает, что в состояниях, находящихся между кривыми AB, AK и AD, тело будет находиться целиком в одной фазе: правее AB и AK — область газообразного состояния; левее линий AD и AB располагается область вещества в твердом состоянии; между линиями AD и AK находится область жидкости.
В состояниях на линии AK, AD и AB вещество может существовать в двух фазах, причем на линии AK в жидкой и газообразной, на AD — твердой и жидкой; а на линии AB вещество может быть в твердом и газообразном состояниях. Расположение и вид этих трех кривых
AK ─ p=f(tн); AD ─ p=f(tпл); AB ─ p=f(tс)
зависят от природы вещества и устанавливаются опытным путем.
50
ЛЕКЦИЯ 10
ПАРАМЕТРЫ СОСТОЯНИЯ ЖИДКОСТИ И ПАРА
Начало отсчета параметров жидкости берется в произвольной точке существования жидкости, например, в тройной. Температуре этой точки T0 соответствует определенное давление насыщения pн 0 и плотность ρ'0. При этих пара-
метрах внутренняя энергия, энтальпия, энтропия жидкости берутся условно равными нулю (u'0 = 0, h'0 = 0, s'0 = 0).
В процессе подогрева жидкости происходит нагревание ее до температуры кипения Tн. Удельный объем жидкости при температуре кипения v' будет больше объема v0'. Соответствующие значения v' для жидкости в функции температуры и давления для состояний, лежащих или на пограничной кривой жидкости, или левее ее, даются в справочной литературе.
Количество теплоты, которое нужно сообщить жидкости, чтобы нагреть ее от температуры T0 до температуры кипения в процессе p=const, определяется по формуле
q'=cрж(Tн─T0), |
(8.15) |
или, если T0 = 0º C, как иногда бывает принято, например для воды,
q'= cржTн, |
(8.16) |
где cрж — средняя теплоемкость жидкости в интервале температур от T0 до Tн. При низких по сравнению с Tкр температурах можно считать cрж= const.
Для определения количества теплоты в изобарном процессе подогрева жидкости воспользуемся первым законом термодинамики, по которому
q'= u' ─ u'0 + l' |
(8.17) |
где и' — внутренняя энергия жидкости при температуре кипения Tн. Так как при температуре T0 внутренняя энергия жидкости равна нулю (u'0 = 0), а работа расширения жидкости
l'=p(v'─ v'0) |
(8.18) |
практически заметна только при больших значениях давления, то
q' ≈ u' |
(8.19) |
Энтальпия жидкости при температуре кипения определяется по общей формуле
h' = h'0 + q' |
(8.20) |

51
Полагая, что h0' = u0'+ pv0' = 0, получим
h'= u'=q'. |
(8.21) |
В процессе нагревания жидкости от температуры T0 до температуры кипения происходит увеличение ее энтропии, которое может быть найдено по формуле
Tн dq |
Tн |
dT |
|
|
||
s s s0 |
|
c pж |
|
; |
(8.22) |
|
T |
T |
|||||
T |
T |
|
|
|||
0 |
|
0 |
|
|
|
|
при s0' = 0, cрж = const
s' = cрж ln(Tн / T0). |
(8.23) |
Как уже было сказано, опытами установлено, что в процессе парообразования жидкость, нагретая до температуры кипения, при этой температуре и определенном постоянном давлении обращается в пар. Количество теплоты, затрачиваемое в процессе при р=const на превращение 1 кг жидкости при температуре кипения в сухой насыщенный пар той же температуры, называется теплотой парообразования и обозначается r. По первому закону термодинамики
r = и" ─ u'+ l", |
(8.24) |
где и" — внутренняя энергия сухого насыщенного пара; l" — работа расширения в процессе парообразования.
Разность внутренних энергий и"— и', затрачиваемая на работу против внутренних сил, называется внутренней теплотой парообразования и
обозначается буквой ψ1. Теплота, затрачиваемая на работу против внешних сил,
l p v
p v v
v (8.25)
(8.25)
и называется внешней теплотой парообразования; обозначим ее через ψ2.
Таким образом,
r ψ1 ψ2 . |
(8.26) |
Вследствие того что процесс парообразования идет при постоянном
давлении, |
|
r h h . |
(8.27) |
Значения величин r и h" даются в таблицах насыщенного пара, а значения ψ1, ψ2, и" легко определяются по приведенным выше формулам.
С возрастанием давления, как видно из рис. 8.7, энтальпия жидкости увеличивается и достигает максимального значения при критическом давлении. Теплота парообразования уменьшается с ростом давления и равна нулю при критическом давлении (и температуре), потому что в этих условиях различия между жидкостью и ее паром исчезают и процесс парообразования как таковой отсутствует.

52
Рис. 8.7
Изменение энтропии в процессе парообразования при подведении к кипящей жидкости теплоты (кДж/кг)
s s |
s |
h |
h |
Tн r Tн , |
(8.28) |
откуда |
|
|
|
|
|
|
s |
s |
r Tн |
(8.29) |
|
или, используя значение s' из выражения (8.23), |
|
||||
s |
cpж ln Tн |
T0 |
r Tн . |
(8.30) |
|
При полном испарении жидкости состояние сухого насыщенного пара определяется одним параметром: давлением или температурой. Поэтому объем, внутренняя энергия и энтальпия определяются по таблицам насыщенного пара по давлению или температуре.
Связь между удельными объемами жидкости и пара на линии насыщения v' и v", давлением насыщенного пара pн, температурой Тн и теплотой парообразования может быть получена следующим образом. При превращении жидкости в пар давление насыщенного пара от объема системы не зависит, следовательно, в выражении (7.8) s T v d pн
T v d pн 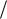 dTн , но так как равновесное
dTн , но так как равновесное
превращение жидкости в пар происходит при постоянной температуре (T н =
const), то s V T ds dV , где величина dV |
представляет собой изменение |
||||
объема системы при переходе жидкости в пар. Таким образом, |
|||||
|
d pн |
|
ds |
|
|
|
|
|
|
. |
(8.31) |
|
dTн |
dV |
|||
Изменение объема системы, если испарилась жидкость массой dm, dV  v
v v
v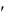 dm ,
dm ,
а приращение энтропии в квазистатическом процессе испарения жидкости массой dm по (8.28)
ds rdm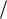 Tн .
Tн .
Подставив эти значения в уравнение (8.31), получим

|
53 |
|
|
|
d pн |
|
r |
, |
(8.32) |
dTн |
Tн v v |
|||
где d pн  dTн — производная от давления по температуре на кривой фазового
dTн — производная от давления по температуре на кривой фазового
равновесия pн=f(Tн ).
Уравнение (8.32) называют уравнением Клапейрона — Клаузиуса и
применяют при исследованиях изменения агрегатного состояния вещества в процессе перехода его из жидкого состояния в парообразное. Аналогичные уравнения можно применять и к процессам перехода вещества из твердого состояния в жидкое или газообразное.
Параметры влажного насыщенного пара при заданной сухости могут быть определены из следующих соотношений.
Удельный объем влажного насыщенного пара
v 1 x v xv . |
(8.33) |
Так как объем жидкости (1—x)v" мал по сравнению с объемом пара, то при невысоких давлениях
v xv . |
(8.34) |
Энтальпия влажного насыщенного пара с учетом того, что на превращение в
пар х кг жидкости необходимо затратить хr кДж/кг теплоты, равна |
|
||
h |
h |
r x . |
(8.35) |
Энтропия влажного насыщенного пара |
|
|
|
s |
s |
r x Tн |
(8.36) |
Свойства перегретого пара резко отличаются от свойств насыщенного пара и приближаются к свойствам газов. Перегретый пар характеризуется тем, что его температура выше температуры парообразования Tн при том же давлении и удельный объем его больше, чем объем сухого насыщенного пара при том же давлении.
Количество теплоты, необходимое для перевода 1 кг сухого насыщенного пара при р = const в перегретый с температурой Т, называют теплотой перегрева qп и определяют по формуле
|
T |
|
qп |
с pm dT . |
(8.37) |
|
Tн |
|
Если срт — средняя удельная теплоемкость перегретого пара при постоянном давлении, то
qп сpm T Tн . |
(8.38) |
Значение срт берется для перегретого пара по формуле cpm=f ( T, p). Энтальпия перегретого пара
hп h qп h r cpm T Tн |
(8.39) |
называется полной теплотой перегретого пара.
По первому закону термодинамики
qп uп u l , |
(8.40) |
где l = p (vп —v") — работа расширения в изобарном процессе перегрева пара; (ип—и" ) — изменение внутренней энергии в процессе перегрева.
Изменение энтропии в равновесном изобарном процессе перегрева

54
|
|
sп |
s |
T dqп |
|
T с pmdT |
|
c pmln |
T |
, |
|
(8.41) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
Tн T |
|
Tн T |
Tн |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s |
|
s |
c |
|
ln |
T |
|
с |
|
ln |
Tн |
|
|
r |
c |
|
|
ln |
T |
. |
(8.42) |
|||
п |
pm |
|
pж |
|
|
|
pm |
|
||||||||||||||||
|
|
|
Tн |
|
|
|
T0 |
Tн |
|
|
Tн |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Свойства перегретых паров будут тем ближе к свойствам идеального газа, чем больше температура перегрева.
Ts-ДИАГРАММА ПАРА
Для графического изображения процессов, происходящих в паре, удобно пользоваться Ts-диаграммой, ибо в ней площадь под кривой обратимого процесса дает количество теплоты, сообщаемое телу или отнимаемое от него.
Так как в координатах pv и Ts любая точка изображает определенное состояние тела, то точкам pv-диаграммы должны соответствовать определенные точки Ts-диаграммы (рис. 8.8).
Если было принято условно, что энтропия начального состояния жидкости So=0, то эта точка на Ts-диаграмме лежит на оси ординат на значение То выше абсолютного нуля.
Перенося по точкам пограничную кривую жидкости (х = 0) из pv- в Ts диаграмму, получим соответствующую ей кривую, абсциссами которой являются значения s'. Аналогично наносится пограничная кривая пара (х = 1), абсциссами которой будут значения энтропии сухого насыщенного пара s".
В точке b диаграммы начинается кипение при Tн = const и энтропия в процессе парообразования повышается:
s 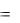 r
r Tн x .
Tн x .
Процесс парообразования заканчивается в точке с, где s r Tн .
Tн .
Рис.
Так как процесс парообразования идет при Tн = const и р = const, изотерма b- c является одновременно и изобарой. Дальнейший подвод теплоты снова сопровождается увеличением температуры и энтропии. В процессе перегрева пара (кривая c-e).
