
Lekcii_po_TekhnichTermodinamike
.pdf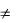
25
отрицательная. Адиабатный процесс.
dq =0, тогда dq=TdS=0, но т.к. T 0, то dS=0, или: S=const — уравнение адиабатного процесса в T-S - координатах.
Опять вспомним I закон.
dq=du+dl, но т.к. dq=0, то 0=du+dl, или:
-du=dl — адиабатное расширение (процесс 1-2); du=-dl — адиабатное сжатие (процесс 2-1).
Общая формулировка второго закона термодинамики
Первый закон устанавливает количественное соотношение между теплом и работой. С точки зрения первого закона любой мыслимый процесс, который не противоречит закону сохранения энергии, принципиально возможен в природе.
Ответ о направлении протекания процессов даѐт второй закон термодинамики. Одна из его формулировок гласит: ―Теплота сама собой (без компенсации) не может переходить от тел с низкой температурой к телам с высокой температурой‖ (Клаузиус, 1850 г.).
Переход тепла от тела холодного к телу горячему возможен (в холодильной машине), но осуществляется переход не самопроизвольно, а за счет затраты энергии (холодильник включен в электросеть).
26
ЛЕКЦИЯ 6
Круговой цикл
Чтобы выяснить особенности превращения тепла в работу в тепловых двигателях и понять сущность второго закона, рассмотрим, как должно изменяться состояние рабочего тела в такой непрерывно действующей машине, как поршневой тепловой двигатель.
Тепловой двигатель должен непрерывно превращать теплоту в работу, иначе бы он нас не удовлетворял. При каких же условиях этот процесс может быть осуществим?
|
|
|
|
|
|
|
В поршневом тепловом двигателе за счет |
||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
подвода тепла температура рабочего тела |
||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
увеличивается, газ расширяется и совершает |
||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
полезную работу. Можно ли по |
этой |
схеме |
||||
|
|
Раб. тело |
|
|
получать работу |
непрерывно? Очевидно |
нельзя, |
||||||
|
|
|
|
|
|
|
т.к. рабочее тело, получая тепло от горячего |
||||||
|
|
|
|
|
|
|
источника тепла, постепенно повысит свою |
||||||
|
|
|
|
|
|
|
температуру и наступит такой момент, когда |
||||||
|
|
|
|
|
|
|
температура |
рабочего |
тела |
будет |
равна |
||
|
|
|
q |
температуре |
источника |
тепла, |
|
дальнейшая |
|||||
|
|
|
передача |
тепла |
прекратится |
и |
поршень |
||||||
|
|
|
|
|
|
|
|||||||
Рис. 1.10. Термодинамическая |
остановится. |
|
|
|
|
|
|||||||
схема теплового двигателя |
Невозможность непрерывного |
расширения |
|||||||||||
|
|
|
|
|
|
|
|||||||
рабочего тела требует того, чтобы оно из определенного состояния было возвращено в исходное, а поршень - в первоначальное положение. Для этого
расширившееся рабочее тело надо сжать, затратить на это работу. |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Рассмотрим процесс в p,v координатах. |
||||
P |
|
|
|
|
|
|
|
Расширяясь по линии 1-а-2, рабочее тело |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
совершает работу, равную площади v1-а-2-v2. Если |
||||
1 |
|
|
|
|
|
|
|
|
|
|
вернуть тело в исходное состояние по тому же пути, |
||||||
|
|
|
|
|
|
a |
|
|
|
то при этом потребуется совершить над рабочим |
|||||||
|
|
|
|
|
|
2 |
|
|
телом ту же самую работу. Это не имеет смысла, т.к. |
||||||||
|
|
|
|
|
|
|
|
суммарная работа — работа цикла — окажется |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
b |
|
|
|
|
|
|
|
|
равной 0. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Для того, |
чтобы |
двигатель |
непрерывно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
V |
|
|||||
|
V1 |
|
|
|
|
|
V2 |
|
|
||||||||
|
|
|
|
|
|
|
|
производил работу, работа расширения должна быть |
|||||||||
|
|
||||||||||||||||
Рис. 1.11. Круговой процесс |
|||||||||||||||||
больше работы сжатия, поэтому кривая сжатия 2-b-1 |
|||||||||||||||||
(цикл) в p,v- координатах |
|
|
должна лежать ниже кривой расширения, в итоге |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
будет получена полезная работа, равная площади 1-a-2- |
||||||
|
|
|
|
|
|
|
|
|
|
|
b-1. |
|
|
|
|||
Таким образом, для непрерывной работы двигателя необходим |
|||||||||||||||||
циклический |
процесс, |
в |
котором рабочему |
телу от |
горячего |
источника с |
|||||||||||
температурой Т1 подводится теплота q1 и отводится от него к холодному источнику с температурой Т2<Т1 теплота q2.
Так как часть тепла рабочего тела возвращается к холодному источнику в виде тепла q2, только разность q1- q2 превращается в полезную работу. Отсюда

27
вытекает еще одна формулировка второго закона: вечный двигатель второго рода невозможен (т.е. такой, который мог бы работать при наличии только одного источника тепла).
Под коэффициентом полезного действия (КПД) теплового двигателя понимают отношение тепла, превращенного в полезную работу, ко всему теплу затраченному:
q1 q2 |
1 |
q2 |
|
q1 |
|
t |
|
|
q1 |
||
где q1 - затраченное тепло; q1-q2 - полезное тепло;
q2 - тепло, возвращенное холодному источнику; t - термический КПД теплового двигателя.
В тепловых двигателях q2>0, поэтому t<1 (строго меньше единицы).
t 1.
Прямой цикл Карно
Итак, для превращения теплоты в работу в непрерывно действующей машине нужно по крайней мере иметь источник тепла (горячий источник), рабочее тело, совершающее термодинамический процесс и тело способное охлаждать рабочее тело (холодный источник).
Такой цикл, дающий максимальное КПД и состоящий из двух изотерм и двух адиабат, был предложен французским инженером Сади Карно в 1824 году в своей единственной работе ―Размышление о движущей силе огня и о машинах, способных развивать эту силу‖.
Интересны некоторые факты биографии самого Сади Карно. Его отец, Лазар Карно, был знаменитым французским генералом, он руководил свержением монархии. Сади Карно в 16 лет поступил в Политехническую школу в Париже. В числе преподавателей и студентов этого заведения были очень многие известные ученые. Лагранж, Лаплас, Фурье, Бертоле, Ампер, Дюлонг были преподавателями. Коши, Кориолис, Пуассон, Гей-Люссак, Пти, Френель, Био, Клапейрон, Пуазель, как и Карно, были студентами. Проучившись два года, Сади поступает на службу в инженерный корпус. Вскоре после этого была восстановлена монархия, Лазар Карно был выслан, а Сади вынужден был нести гарнизонную службу, потом ушѐл в отставку и занялся серьѐзным изучением физики и экономики. Он стал специалистом по торговле и промышленности, признанным во всей Европе. В 1832 году он заболел холерой и умер в возрасте 36 лет. Его единственная работа, написанная им в 28 лет, вначале почти не была замечена, но впоследствии еѐ содержание обеспечило Карно признание и известность в истории науки и техники. Главная
T |
|
|
|
|
|
q |
|
|
|
идея работы |
Карно: в |
процессе |
превращения |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
0 |
|
|
1 |
|
теплоты |
от |
горячего |
нагревателя в работу |
|||||
|
|
|
|
|
|
||||||||||
T1 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
должна происходить отдача теплоты холодному |
|||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
резервуару. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Осуществление цикла Карно в тепловой |
||||
|
|
|
|
|
|
|
|
2 |
машине |
можно представить |
следующим |
||||
T2 |
|
|
|
|
|
|
|
|
|||||||
3 |
|
|
|
|
|
||||||||||
|
|
|
|
q |
|
|
|
|
образом. |
Газ |
(рабочее |
тело) с |
начальными |
||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
S0 |
|
|
|
S1 |
|
S |
|
|
|
|
||
|
|
|
|
|
|
|
|
S2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
S3 |
|
|
|
|
|
|
|
|
||||
Рис. 1.12. Прямой цикл Карно
28
параметрами, характеризующимися точкой О, помещѐн в цилиндр под поршень, причем стенки цилиндра нетеплопроводные, так что тепло может передаваться через основание цилиндра. Вводим цилиндр в соприкосновение с горячим источником теплоты с температурой Т1. Газ расширяется изотермически при температуре Т1: 0-1- изотермическое расширение.
В точке 1 подвод тепла прекращается и дальнейшие расширение идет по адиабате 1-2 только за счѐт внутренней энергии, в результате чего температура падает до Т2.
Теперь возвратим рабочее тело в начальное состояние. Для этого поместим рабочее тело на холодный источник с температурой Т2 и будем сжимать по изотерме 2-3, совершая работу и отводя тепло q2 к холодному источнику. Завершаем сжатие по адиабате 3-0, без подвода тепла, температура увеличивается до Т1. Выведем формулу термического КПД цикла Карно,
используя |
t для любого цикла: |
|
|
|||||||
|
1 |
|
q2 |
1 |
T2 S2 |
S3 |
1 |
T2 |
. |
|
t |
|
|
|
|
|
|
||||
|
|
q1 |
|
T1 |
S1 |
S0 |
T1 |
|||
|
|
|
|
|||||||
Из неѐ видно, |
что термический КПД цикла Карно зависит только от |
|||||||||
абсолютных температур горячего и холодного источников – это теорема Карно.
Увеличение КПД возможно либо за счет увеличения температуры Т1 горячего источника, либо за счет уменьшения Т2 холодного, причем влияние Т1
и Т2 на значение |
t различно: |
|
|
|
|
|
|
|
|
||||||||
|
t |
|
T |
|
|
t |
1 |
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
2 |
; |
|
|
|
|
|
, а т.к. Т1 > Т2 , то |
t |
|
|
t |
|
. |
||
|
|
T2 |
|
T1 |
2 |
||||||||||||
|
T |
|
|
2 |
|
T |
T |
||||||||||
|
T |
|
|
Т1 |
|
|
|
|
|||||||||
1 |
|
|
|
|
|
|
|
|
2 |
|
1 |
|
|
||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Таким образом, увеличение температуры горячего источника в меньшей степени повышает КПД цикла Карно, чем такое же (в Кельвинах) уменьшение температуры холодного.
Для ориентировки приводим значение термического КПД цикла Карно при различных температурах горячего источника и при температуре холодного
10 С:
t1 C |
200 |
400 |
800 |
120 |
160 |
t |
0,4 |
0,5 |
0,7 |
0,8 |
0,8 |
Приведѐнные цифры дают КПД идеального цикла. КПД реальных тепловых двигателей будет значительно ниже по следующим причинам:
1.Не всегда целесообразно добиваться в тепловых двигателях осуществления цикла Карно;
2.Цикл Карно состоит только из обратимых процессов (что нереально на практике);
3.В реальных тепловых двигателях кроме потери тепла, имеющего место в цикле Карно, есть другие потери, например, связанные с охлаждением
двигателя.
КПД паровых машин не превышает 0,2; КПД паровых турбин до 0,38; КПД ДВС (дизельных) до 0,40.
29
Обратный цикл Карно
Особенностью такого цикла является то, что рабочее тело получает тепло q2 при температуре Т2 (от холодного источника), а отдаѐт тепло q1 при температуре Т1 (горячего источника), причѐм отдает его в большем количестве, чем получает, и если в прямом цикле Карно результатом является получение полезной работы, то для осуществления обратного цикла Карно необходимо затратить работу: l0 = q1 - q2.
T |
|
|
|
|
|
|
|
||
0 |
|
|
q1 |
3 |
|
|
|||
|
|
|
|
|
|
|
|||
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
l0=q1-q2 |
|
|
|
|
||
T2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
1 |
|
|
|
|
|
|
|
|
|
|
|
q2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S0 |
|
|
|
|
S1 |
|
S |
|
|
|
|
|
|
|
|
|
|
|
S3 |
S2 |
|
Рис. 1.13. Обратный цикл Карно
Обратный цикл Карно является идеальным циклом холодильных установок и так называемых тепловых насосов. Эффективность холодильной установки оценивается холодильным коэффициентом , определяемым как отношение количества теплоты, отнятой за цикл от холодильной камеры (холодопроизводительности), к затраченной в цикле работе:
q2 |
|
|
q2 |
|
|
T2 |
|
|
|
|
1 |
|
. |
||
l |
|
|
q |
q |
|
|
T |
T |
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|||||||
|
0 |
1 |
|
2 |
1 |
2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
Заметим, что чем меньше разность температур между холодильной камерой и окружающей средой, тем меньше нужно затратить энергии для передачи теплоты от холодного тела к горячему и тем выше холодильный коэффициент.

30
ЛЕКЦИЯ 7
Статистическое толкование второго закона термодинамики.
Второе начало термодинамики основано на том факте, что неупорядоченных состояний, имеется намного больше, чем упорядоченных. Рассмотрим, например, коробку с ―картинкой загадкой‖, которую нужно составить из кусков. Пусть имеется только одно размещение кусочков, при котором они создают картинку. Но, с другой стороны, существует очень большое число размещений, где кусочки находятся в беспорядке и никакой картинки не образуют.
Наиболее вероятной для замкнутой системы будет состояние теплового равновесия. В то же время маловероятным был бы самопроизвольный выход системы из состояния равновесия.
Необратимые процессы во всем окружающем мире протекают так, что система переходит из состояния менее вероятного в более вероятное, причѐм беспорядок в системе увеличивается. Следовательно, энтропия является мерой беспорядка в системе.
Больцман доказал (1872 г.), что между термодинамической вероятностью данного состояния системы W и энтропией S существует функциональная зависимость:
S = k ln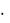 W,
W,
где k - постоянная Больцмана.
С принципом возрастания энтропии в замкнутых системах связаны представления о ―тепловой смерти Вселенной‖, выдвинутые Клаузисом, который утверждал: ―Энергия мира постоянна, энтропия мира стремится к максимуму‖. Достижение конечного состояния теплового равновесия и прекращение всех процессов – это тепловая смерть Вселенной.
Однако Вселенную нельзя рассматривать как конечную изолированную систему. В космосе есть и такие процессы, которые не подчиняются законам термодинамики конечных систем.
Третий закон термодинамики.
Доказано, что для замкнутых систем энтропия всегда возрастает: dS 0 .
Это положение представляет собой наиболее общую формулировку второго начала термодинамики, известную под названием критерия возрастания энтропии.
Следует подчеркнуть что неравенство dS 0 применимо только к изолированным системам.
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
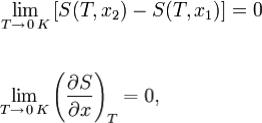
31
Третье начало термодинамики может быть сформулировано так: «Приращение энтропии при абсолютном нуле температуры стремится
к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
или
где x — любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только еѐ изменение):
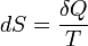 ,
,
третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики). В классической термодинамике энтропия может быть определена лишь с точностью до произвольной аддитивной постоянной S0, что не мешает термодинамическим исследованиям, так как реально измеряется разность энтропий (S0) в различных состояниях. Согласно третьему началу термодинамики, при  значение
значение  .
.
В 1911 году Макс Планк сформулировал третье начало термодинамики, как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю:  . Отсюда S0 = 0, что даѐт возможность определять абсолютное значения энтропии и других термодинамических потенциалов.
. Отсюда S0 = 0, что даѐт возможность определять абсолютное значения энтропии и других термодинамических потенциалов.
Следствия
Недостижимость абсолютного нуля температур: Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достичь ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
Поведение термодинамических коэффициентов: Из третьего начала термодинамики вытекает ряд термодинамических следствий: при T→0 должны стремиться к нулю теплоѐмкости при постоянном давлении и при постоянном объѐме, коэффициенты теплового расширения и некоторые аналогичные величины. Справедливость третьего начала термодинамики одно время подвергалась сомнению, но позже было выяснено, что все кажущиеся противоречия (ненулевое значение энтропии у ряда веществ при T = 0) связаны
32
с метастабильными состояниями вещества, которые нельзя считать термодинамически равновесными.
Нарушения третьего начала термодинамики в моделях: Третье начало термодинамики часто нарушается в модельных системах. Так, при T→0 энтропия классического идеального газа стремится к минус бесконечности. Это говорит о том, что при низких температурах уравнение Менделеева — Клапейрона неадекватно описывает поведение реальных газов. Состояние газа при T→0 называется вырожденным состоянием и для его описания требуется применение законов, следующих из уравнений квантовой статистики.
Таким образом, Третье начало термодинамики просто констатирует, что абсолютный ноль недостижим — и в этом он похож на скорость света: материальное тело может сколь угодно близко подойти к нему, но достичь — никогда. Дело в том, что чем ближе система подходит к абсолютному нулю температуры, тем больше работы нужно затратить на ее дальнейшее охлаждение. На самом деле, в лабораторных условиях ученым удавалось получать температуры предельно близкие к нулевой. Сегодня температуры, отстоящие от абсолютного нуля на миллиардные доли градуса, можно получить практически в любой криогенной лаборатории.
Способов понижения температуры материального тела имеется достаточно много. Можно испарять жидкость с его поверхности, и она будет отнимать теплоту у тела — именно поэтому люди потеют в жару. Можно резко расширять газ, находившийся под высоким давлением, — вот почему охлаждается аэрозольный баллончик, когда вы долго выпускаете из него содержимое. Подобными методами ученые доводят температуру до уровня нескольких градусов выше абсолютного нуля. Однако чтобы получить понастоящему сверхнизкие температуры, приходится надолго подвешивать незначительное количество атомов вещества в сильных электростатических и магнитных полях. После этого подвешенные атомы обрабатываются лазерным лучом определенной длины волны, который сначала заставляет атомы испустить остатки энергии возбужденных электронов в виде световых квантов, а затем — разогнать атомы врозь, как бы распрыскать их из аэрозольного баллончика. Именно так сегодня получаются температуры порядка нескольких нанокельвинов (1нК = 10–9 К). Однако, как далеко ни пошло бы развитие нашей техники, третье начало термодинамики говорит нам, что мы не только не перейдем барьера абсолютного нуля, но даже не достигнем его.
Один физик с хорошим чувством юмора дал собственные формулировки трех начал термодинамики:
1.Первое начало термодинамики: Вам не выиграть.
2.Второе начало термодинамики: Вам не сыграть вничью.
3.Третье начало термодинамики: Вам даже сыграть не дадут.
Основные термодинамические процессы и их изображение в р,v и T,S координатах

33
Основными процессами являются: изобарный (p = const), изохорный (V = const), изотермический (Т = const), адиабатный (pvk = const, dq = 0),
политропный (pvn = const).
Метод исследований, который приведѐн далее, состоит в следующем: выводится уравнение процесса, устанавливается связь между начальными
и конечными параметрами; вычисляется работа изменения объѐма газа;
определяется количество теплоты, подведѐнной (или отведѐнной) к газу в процессе;
определяется изменение внутренней энергии системы в процессе; определяется изменение энтропии в процессе;
изображается процесс в р,v и Т,S координатах.
Изохорный процесс. При изохорном процессе dv = 0, т.к. V = const. Из
уравнения состояния р1v = RT1, p2v = RT2 следует |
p2 |
|
Т 2 |
. |
|
|
|
||||
|
p |
|
Т |
1 |
|
|
1 |
|
|
|
|
Работа расширения: dl = pdv = 0.
Количество теплоты, подведенной к рабочему телу при Сv =const: dq = du + dl = du = cv dT;
dT;
|
T2 |
|
|
|
|
|
|
|
|
|
|
q |
c dT |
c |
T2 |
t |
2 |
t - если теплоѐмкость зависит от температуры. |
|||||
|
v |
|
v |
T |
|
1 |
|
|
|
||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
Т.к. dq = du = cv |
dT, отсюда: |
|
|
|
|||||||
u |
cv |
T2 |
T1 |
при cv = const, и |
|
|
|
||||
u |
c |
T2 |
T |
T |
|
при c , зависящей от T. |
|
||||
|
v |
T |
2 |
1 |
|
|
v |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
Второй закон термодинамики: dS |
dq |
|
; |
||||||||
T |
|||||||||||
|
|
|
|
|
|
|
|
|
|||
заменим: dq = cvdT в этом уравнении:
dS |
cv |
dT |
, интегрируем: S2 |
- S1 = cv lnT2/T1, |
|
T |
|||
|
|
|
|
т.е. зависимость энтропии от температуры при cv = const имеет логарифмический характер.
Изобразим изохорный процесс в р,v и Т,S координатах:
P |
T |
|
|
|
|
||||||
|
|
|
|
|
|
||||||
2 |
|
|
|
|
|
|
2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V=const |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||||
|
|
|
q |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
V |
|
|
S1 |
|
|
|
S2 |
S |
||
Рис. 1.14. Изохорный процесс в p, v и T,S - координатах
|
|
|
|
|
|
|
|
|
|
|
|
|
34 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Изобарный процесс. Из уравнения состояния идеального газа при р = |
||||||||||||||||||||||||||||
const: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|||||
|
v2 |
|
|
T2 . |
|
|
|
|
|
|
|
|
|
|
|
|
p=const |
|
|
|||||||||
|
v1 |
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
v2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа расширения l |
pdV |
p v2 |
|
v1 |
, |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
l |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
v1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
а т.к. рv1 = RT1, pv2 = RT2, то l = R(T2-T1). |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Количество тепла, сообщаемого при нагреве: |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
dq = di - vdp = di = cpdT; |
|
|
|
|
|
|
V1 |
|
|
|
|
V2 |
|
V |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
Рис. 1.15. Изобарный процесс |
|||||||||||||||||||||||
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
q |
|
cpdT |
cp.cp |
TT2 (T2 |
T1), |
|
|
|
|
|
в p, v – координатах |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где |
c |
p.cp |
T2 |
- средняя массовая теплоѐмкость в интервале температур от T |
||||||||||||||||||||||||
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
до T2; при cp = const: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
q = cp(T1 - T2). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Изменение энтропии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
dq |
|
c p dT |
|
|
|
T |
2 |
, |
т.е. изобара в Т, S |
координатах - |
||||||||||||||
dS |
|
|
|
|
|
|
; |
S 2 |
S1 |
Cp ln |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
T |
|
T |
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
тоже логарифмическая кривая, однако более пологая, чем изохора, т.к. cp>cv.
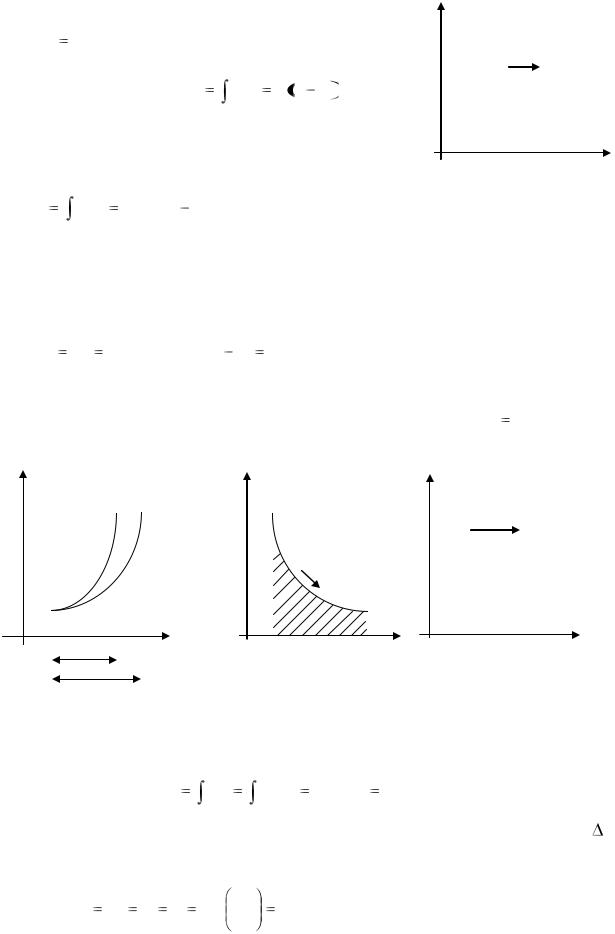
Изотермический процесс pv = RT = const, или |
р 2 |
|
v1 |
; графиком |
р1 |
|
v2 |
||
|
|
|
процесса в р, v координатах является равнобокая гипербола.
T |
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
||||||||
2` |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T=const |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆Sυ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S1 |
|
|
|
S2 |
|
|
|||
|
|
|
|
|
|
|
|
S |
|
|
V1 |
|
|
|
|
V2 |
|
|
|
|
|
|
|
S |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆Sp |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a) |
|
|
|
|
|
|
|
|
|
|
|
б) |
|
|
|
|
|
|
|
|
|
|
в) |
||||||||
|
|
|
|
Рис. 1.17. Изотермический процесс в p, v - (а) и T, S (б)- координатах |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
v2 |
v2 |
|
|
|
dv |
|
|
|
|
v2 |
|
|
|
p1 |
|
|
|
|
|
|
|
|
|
|
||
|
Работа процесса l |
pdv |
|
RT |
|
|
RT ln |
|
|
RT ln |
. |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
v |
v |
|
|
|
v |
|
|
|
|
v1 |
|
p2 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т.к. Т = const, то внутренняя энергия остаѐтся тоже постоянной, т.е. u = 0, и вся подводимая к газу теплота превращается в работу расширения:
q = l.
Т.к. dS |
dq q l |
R ln |
p1 |
R ln |
v2 |
. |
||||
|
|
|
|
|
|
|
||||
|
T T T |
|
p2 |
|
v1 |
|||||
