
Lekcii_po_TekhnichTermodinamike
.pdf
35
Адиабатный процесс. Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным, т.е. dq = 0. Уравнение адиабатного процесса рvk = const, где k - показатель адиабаты. k не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k = 1,66, для двухатомного k = 1,4, для трѐх и многоатомных
газов k = 1,33. Величина k |
c p |
. |
|
|
|
|||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cv |
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
1 |
|||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S=const |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
pvk=const |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(dq=0) |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
l |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
V1 |
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
S |
||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Рис. 1.18. Адиабатный процесс в p,v – |
и T, S - координатах |
|||||||||||
Поскольку k >1, то в р, v координатах линия адиабаты идѐт круче линии изотермы.
Из уравнения адиабаты следует:
|
|
|
|
|
|
|
|
|
|
|
k 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
||
|
Т2 |
|
|
|
v1 |
|
|
|
|
|
|
Т2 |
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
, |
|
|
|
|
|
|
p1 |
|
; |
|
|
|
|
|
|
|||||||||||||||||
|
Т1 |
|
|
v2 |
|
|
|
|
Т1 |
|
|
p2 |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Из первого закона: dq = du + dl, т.к. dq = 0, то |
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
dl = -du = -cvdT, l |
|
|
|
|
|
cvdT cv T1 T2 ; |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
т.к. cp = cv+R, a k |
|
cp |
, то |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
k = 1+R/cv; тогда |
l |
|
|
R |
|
|
T1 |
|
T2 ; |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
k |
|
|
1 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
т.к. р1v1 = RT1 и р2v2 = RT2, то |
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
l |
|
1 |
|
|
|
|
|
p1v1 |
p2 v2 |
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
k |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Поскольку в адиабатном процессе dq = 0, то |
dS |
dq |
0, |
и S |
const - |
||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
T |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
вертикальная линия в T, S координатах: |
|
|
|
|
|
|
|||||||||||||||||||||||||||||
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Политропный процесс и его обобщающее |
||||||||||
|
|
2` |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
значение. Любой произвольный процесс можно |
|||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
описать в р,v- координатах уравнением |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
pvk=const |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рvn = const, |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
подбирая соответствующие значения n. Процесс, |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
описываемый |
этим |
уравнением, |
называется |
|||||||||
|
T=const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
политропным. |
Показатель политропы |
n может |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
V
Рис. 1.19. Сравнение изобарного адиабатного и изотермического процессов в p, v - координатах
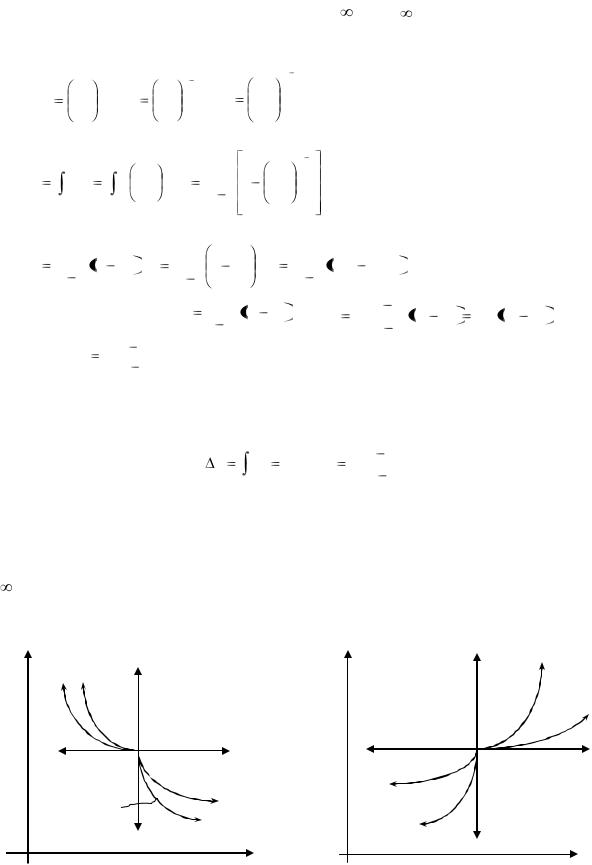
36
принимать любое значение в пределах от  до
до  , но для данного процесса он является величиной постоянной.
, но для данного процесса он является величиной постоянной.
Связь между параметрами:
|
|
|
|
n |
|
|
|
|
n 1 |
|
|
|
|
|
n |
1 |
|
р |
|
|
v |
Т |
|
|
v |
|
Т 2 |
|
|
|
n |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2 |
|
; |
2 |
|
|
; |
|
р1 |
; |
||||||||
|
1 |
|
|
1 |
|
|
|
|
|
|
|||||||
р1 |
|
v2 |
Т1 |
|
v2 |
|
Т1 |
|
р2 |
||||||||
Работа расширения в политропном процессе:
|
v2 |
v2 |
|
n |
|
|
|
|
n |
1 |
||
|
|
|
|
|
|
|
|
|
||||
|
dv |
p1v1 1 |
p2 |
. |
||||||||
l |
dT |
|||||||||||
pdv |
р |
|||||||||||
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
v |
V |
|
n 1 |
p |
|
|
|||||
|
v |
|
|
|
|
1 |
|
|
|
|
||
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
Последнюю запись можно преобразовать к виду:
l |
|
R |
T T |
; l |
p1v1 |
1 |
|
T2 |
|
; l |
1 |
|
p v p |
v |
|
. |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
n 1 |
1 |
2 |
|
|
n 1 |
|
|
|
T |
|
|
n 1 |
1 1 |
2 |
|
2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Так как dq=du+dl, l |
|
R |
|
|
T2 |
T1 |
, то: q |
c |
n |
|
k |
T |
T |
c |
|
T |
T , |
||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||
1 |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
n |
|
1 |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
v |
|
2 |
1 |
|
П |
2 |
1 |
|||||||
где |
cП |
cv |
n |
k |
- |
представляет |
|
собой |
теплоѐмкость |
идеального газа в |
|||||||||||||||||||
|
|
n |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
политропном процессе. При постоянных сv, n и k теплоѐмкость сП = const, поэтому политропный процесс иногда определяют как процесс с постоянной теплоѐмкостью.
|
2 |
dq |
|
T |
|
n |
k |
|
T |
|
Изменение энтропии |
S |
|
cП ln |
2 |
cv |
|
|
ln |
2 |
. |
|
|
|
|
|
||||||
|
1 |
T |
|
T |
|
n |
1 |
|
T |
|
|
|
|
1 |
|
|
|
|
1 |
|
|
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
При n = 1, получим pv = RT = const - изотермический процесс;
при n = 0, p = const - изобарный; при n = k, pvk = const - адиабатный; при n
=, v = const - изохорный.
Изобразим основные процессы в р,v и T,S координатах.
|
|
|
|
|
|
|
|
|
S=const |
||||||
P |
|
n=-∞ |
|
T |
|
|
|
|
|
|
|
||||
n=1 |
|
|
|
|
|
|
|
|
|
n=∞ |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
n=k |
|
|
|
|
|
|
|
|
|
|
|
n=0 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
T=const |
|
p=const |
|
|
T=const |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=k |
|
|
|
|
|
|
p=const |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
n=1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dq=0 |
|
|
|
S=const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=∞ |
|
|
|
|
|
|
|
n=k |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
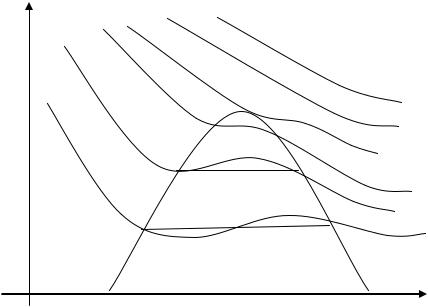
Рис. 1.20. Изображение основных термодинамических процессов идеального газа в p, v – и T, S – координатах.

37
ЛЕКЦИЯ 8
Реальные газы
Весь предыдущий материал был посвящѐн поведению идеальных газов, т.е. таких, на которые были наложены некоторые условия ограничения (отсутствует собственный объѐм молекул и нет сил взаимодействия). В обычных условиях при небольших р и Т это вполне допустимо, и для практических расчѐтов используют уравнение состояния идеального газа.
Однако при некоторых условиях отклонение свойств газов от идеального достаточно велико. Рассмотрим эту тему.
Все реальные газы являются парами тех или иных жидкостей, причем чем ближе газ к переходу в жидкое состояние, тем больше его свойства отклоняются от свойств идеального газа, состояние которого описывается уравнением Клапейрона. Для качественной оценки особенностей реальных газов рассмотрим область, где будут значительные отступления от уравнения Клапейрона.
Уравнения состояния реальных газов выводятся или чисто теоретически на основе гипотетических представлений о структуре газа, или на основании обработки экспериментальных зависимостей между параметрами р, v, Т.
Существует достаточно большое количество различных уравнений состояния для реальных газов. Наиболее широкое распространение получило уравнение Ван-дер-Ваальса (1873 г.), выведенное путѐм пересмотра некоторых допущений, лежащих в основе уравнения состояния идеального газа.
Уравнение Ван-дер-Ваальса имеет вид:
(p+a/v2)(v - b)=RT.
Это уравнение отличается от уравнения Клапейрона двумя поправками: поправкой на объѐм самих молекул b и поправкой на так называемое внутреннее давление a/v2, определяемое взаимным притяжением молекул газа. Поправки а и b могут быть вычислены по параметрам в критической точке:
a |
27 R2Tк2р |
; |
b |
vк р |
. |
|||
|
|
|
|
|||||
64 pк р |
3 |
|||||||
|
|
|
|
|||||
Главная ценность уравнения Ван-дер-Ваальса в том, что оно качественно правильно описывает непрерывность перехода из жидкого состояния в газообразное, а при больших v и сравнительно невысоких р оно практически вырождается в уравнение Клапейрона.
На рисунке предоставлены изотермы, построенные по уравнению Ван- дер-Ваальса.
38
P
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
● |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
T5 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T4 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T3 |
||
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
● |
● |
T2 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
A |
|
● |
|
|
|
|
|
|
T1 |
|||||||||
|
● |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
D |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
T1<T2<T3<... и т.д. |
|
|
|
|
|
|
V |
||||||||||
Рис. 1.21. p, v –диаграмма водяного пара (изотермы Ван-дер-Ваальса)
Точка К соответствует критической точке или критическому состоянию, при котором исчезают различия между жидкостью и паром. В этой точке параметры состояния называется критическими: ркр, Ткр, vкр, для каждого вещества они свои. При температуре выше, чем Ткр, газ ни при каких давлениях не может превратиться в жидкость.
Однако участки АВ и СД на изотермах можно воспроизвести экспериментально только при использовании чистых жидкостей и газов, на этих участках вещество находится в метастабильном состоянии.
С ростом температуры изотермы Ван-дер-Ваальса приближаются к изотермам идеального газа (равнобокие гиперболы).
Рассмотрим процесс парообразования на примере водяного пара. Рассмотрим, какие изменения, обусловленные поправками a и b, претерпевают изотермы. При температуре выше критической изотермы, построенные по уравнению Ван-дер-Ваальса, представляют собой плавные кривые (рис. 8.2), отличные от равнобоких гипербол, построенных по уравнению состояния идеального газа (последние показаны пунктиром). При температуре ниже критической имеется область объемов, где поправка a/v2 (уменьшающая давление) играет определяющую роль и давление проходит через максимум в точке C. Для меньших объемов давление падает, проходит через минимум — точку B, а затем резко увеличивается, когда значение v стремится к значению b.
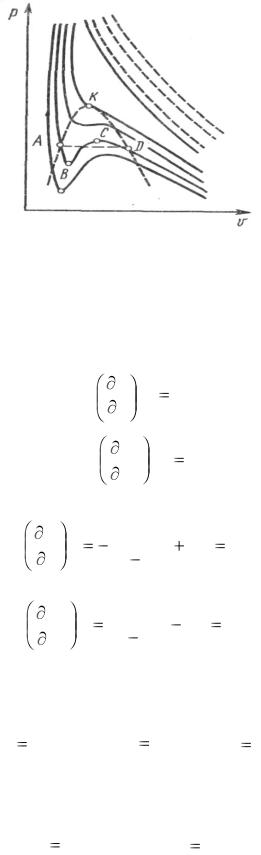
39
Рис 8.2
При критической температуре максимум и минимум, на изотермах сливаются в точке перегиба K, а так как касательная к изотерме в критической точке идет горизонтально, то для критической точки должны выполняться условия
|
|
|
|
|
|
|
|
p |
|
|
|
0; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
T кр |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
2 p |
|
0. |
|
|
|
(8.2) |
||||
|
|
|
|
|
|
|
|
v2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Tкр |
|
|
|
|
|
|
|
|
Отсюда получаем уравнения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
p |
|
|
|
|
RT |
|
|
2a |
0 |
; |
(8.3) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
v T |
|
|
|
(v |
|
b)2 |
|
|
v3 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
2 p |
|
|
|
2RT |
|
ba |
0 . |
(8.4) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
v2 |
T |
|
(v |
|
b)3 |
|
v4 |
|||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Температуру Tкр и объем vкр можно определить из уравнений (8.3) и (8.4), а давление pкр находится затем из уравнения (8.1). В результате получаем
Tкр |
8a |
|
; |
|
vкр |
3b ; |
pкр |
a |
. |
(8.5) |
|||||
|
|
|
|
|
|||||||||||
27Rb |
27b2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
Из последних соотношений |
|
можно определить |
|
индивидуальные константы |
|||||||||||
a и b, зависящие от физических свойств данного газа: |
|
|
|
||||||||||||
|
a |
|
27 |
|
R2Tкр2 |
b |
vкр |
|
|
|
|
|
|||
|
|
|
|
|
|
; |
|
|
. |
|
|
(8.6) |
|||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
64 |
|
pкр |
|
3 |
|
|
|
|
|
|||
Так как процесс перехода от жидкого состояния к газообразному идет при постоянных T и p, то на рис. 8.2 этому процессу соответствует линия AD.
Однако участки AB и CD на изотермах можно воспроизвести экспериментально только при использовании чистых жидкостей и газов. Вещество на этих участках находится в виде перегретой жидкости и перенасыщенного (переохлажденного) пара. Такие состояния, когда вещество
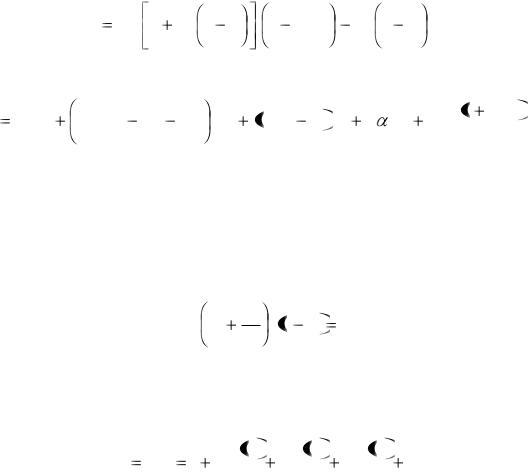
40
остается в однофазном состоянии и не распадается на фазы, называются метастабильными. Главная ценность уравнения Ван-дер-Ваальса состоит в том, что оно качественно правильно описывает непрерывность перехода из жидкого состояния в газообразное; дальнейшее развитие уравнения состояния пошло по пути уточнения расчетов и усовершенствования его теории.
Предпринимались попытки усовершенствования его за счет того, что коэффициенты a и b принимались не постоянными, а зависящими от температуры и объема. Но эти попытки не привели к созданию уравнения состояния, описывающего свойства газа в широком диапазоне изменения параметров.
Неудача создания общего уравнения состояния привела к появлению целого ряда эмпирических уравнений, которые могли бы с достаточной точностью предсказывать поведение реальных газов в широком диапазоне условий. Наиболее известны из них: уравнение Битти-Бриджмена с пятью эмпирически определяемыми постоянными и уравнение Бенедикта-Вебб-Рубина, содержащее восемь эмпирических постоянных.
Уравнение Битти-Бриджмена, применяемое до давлений порядка 250 бар и плотностей газа, не превышающих 0,5 плотности в критической точке, имеет вид
pv2 RT v |
B |
1 |
|
b |
1 |
c |
T 3 |
|
A |
1 |
|
a |
, |
|
|
(8.7) |
||
|
|
|
|
|
|
|
|
|
||||||||||
|
0 |
|
|
|
v |
|
v |
|
0 |
|
|
v |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
а уравнение состояния Бенедикта-Вебб-Рубина |
|
|
|
|
|
|
|
|
|
|||||||||
p RT d RT B0 A0 |
|
c |
|
d |
2 |
RTb |
|
a d |
3 |
a |
d |
6 |
|
cd |
3 1 vd 2 |
(8.8) |
||
|
|
|
|
|
|
|
|
|
|
|
||||||||
T 2 |
|
|
|
|
|
|
|
|
T 2evd2 |
|||||||||
Эти уравнения могут предсказать p, v, T-свойства газа с ошибкой в пределах нескольких десятых процента, и, несмотря на их сложность, развитие вычислительной техники стимулирует использование таких уравнений состояния в обычных технических расчетах.
Хорошо согласуется с опытными данными одно из современных уравнений состояния газа — уравнение Вукаловича—Новикова, учитывающее ассоциацию молекул. При учете столкновений двойных молекул это уравнение имеет вид
p |
a |
v b R1T , |
(8.9) |
v2 |
где R1=R(1-cp/T(5+2m)/ 2); c и m – опытные константы.
В настоящее время теоретически обосновано уравнение состояния,
представляющее собой разложение фактора сжимаемости z в бесконечный
ряд по степеням 1/v: |
|
|
|
|
|
|
|
|
|
|
z |
pv |
1 |
B2 T |
|
B3 T |
|
B4 |
T |
... , |
(8.10) |
RT |
v |
|
v2 |
|
v3 |
|||||
|
|
|
|
|
|
|||||
где B2, В3 и B4 и т. д. — вириальные коэффициенты, учитывающие взаимодействие соответственно двух, трех, четырех и т. д. молекул. Вириальные коэффициенты зависят лишь от температуры и определяются, если известна зависимость потенциальной энергии взаимодействия молекул Uп от
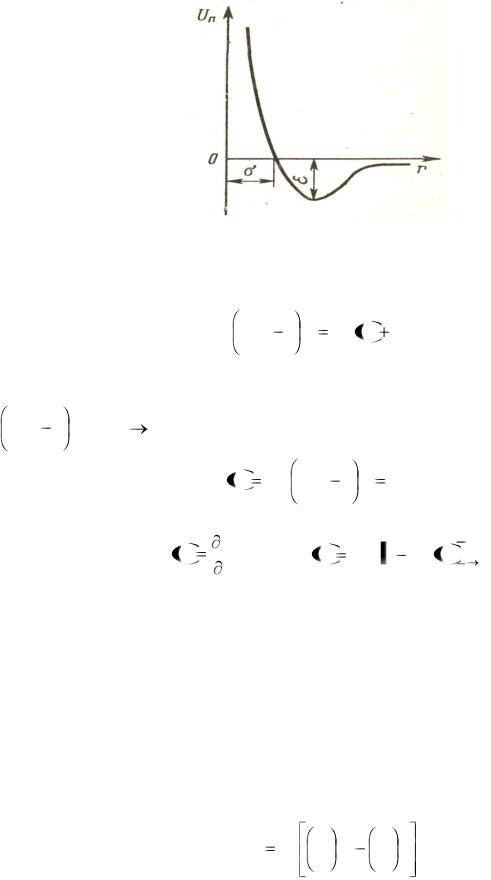
41
расстояния между ними. Характер парного взаимодействия молекул приведен на рис. 8.3.
Рис. 8.3
Вириальные коэффициенты определяются следующим образом. Перепишем уравнение (8.10) в виде
pv |
|
B T |
|
|
|
1 v B2 T |
3 |
. |
|
RT |
v |
|||
|
|
Из этого соотношения видно, что при данной температуре второй вириальный
коэффициент |
|
можно найти, |
если знать |
предельное значение величины |
||||||||||
|
pv |
1 при |
p |
0 . Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
RT |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B2 |
T |
lim |
|
pv |
1 v |
lim A . |
|
|
||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
RT |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Третий вириальный коэффициент находится из условия |
|
|
||||||||||||
|
|
|
|
B T |
|
A |
, или |
B T |
lim |
A B T |
|
. |
||
|
|
|
|
|
|
p 0 |
||||||||
|
|
|
|
3 |
|
v |
|
3 |
|
2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Описанный метод позволяет находить коэффициенты B2(T) и B3(T) даже тогда, когда уравнение представлено бесконечным рядом, но трудность состоит в выделении истинных вириальных коэффициентов.
Используя уравнение состояния в вириальной форме, можно вычислить вириальные коэффициенты на основе положений статистической физики, решая вопрос о групповом взаимодействии молекул. Причем вместо точных аналитических зависимостей Uп=f ( r) применяют приближенные выражения, которые называются потенциалами. Широко используется потенциал Леннарда—Джонса для неполярных молекул, по которому энергия отталкивания пропорциональна расстоянию между молекулами в 12-й степени, а энергия притяжения — в 6-й:
|
|
σ 12 |
σ |
6 |
|
||
Uп |
4ε |
|
|
|
, |
(8.11) |
|
r |
r |
||||||
|
|
|
|
||||
где r — расстояние между молекулами; σ — значение r, при котором Uп=0; ε
— максимальная энергия притяжения (глубина потенциальной ямы). Значения σ и ε для каждого газа могут быть определены по экспериментальным данным.

42
Кроме потенциала Леннарда — Джонса применяются другие потенциалы, которые могут быть использованы для определенных групп сходственных веществ.
При решении целого ряда технических задач рабочими телами могут быть не широко используемые в технике вещества (водяной пар, углекислый газ, азот и др.), а вещества, термические свойства которых неизвестны. В этом случае можно воспользоваться для предсказания свойств малоизученных веществ положением о термодинамическом подобии веществ. Если значения индивидуальных констант a и b подставить в уравнение (8.1), то получим уравнение Ван-дер-Ваальса в функции приведенных параметров π, τ, υ:
π |
3 |
3υ 1 |
8τ , |
(8.12) |
|
|
|||||
υ2 |
|||||
|
|
|
|
||
где π = p/ pкр; τ = T/Tкр; υ = v/vкр |
|
|
|
|
|
Эти отношения называются приведенными давлением, |
температурой и |
||||
объемом. Уравнение (8.12) можно записать |
в форме |
|
|||
|
f |
π, τ, υ |
0 . |
(8.13) |
|
В этой форме приведенное уравнение состояния будет одинаково для всех веществ. Состояния двух или нескольких веществ, в которых они имеют одинаковые приведенные параметры π, τ, υ, называются соответственными состояниями, т. е. эти вещества находятся в состояниях, пропорционально удаленных от своего критического состояния. Если вещества подчиняются одному и тому же приведенному уравнению состояния и имеют два одинаковых приведенных параметра, то у них одинаков и третий приведенный параметр, т. е. вещества будут находиться в соответственных состояниях. Это положение носит название закона соответственных состояний. Вещества, подчиняющиеся закону соответственных состояний, называют
термодинамически подобными.
Практически закон соответственных состояний наиболее удобно применять в виде зависимости z =f (π, τ), причем для расчетов — в виде zπ-диаграммы (рис. 8.4). Эта диаграмма строится по экспериментальным данным для различных веществ и может быть использована для расчета термодинамических свойств малоизученных веществ методом
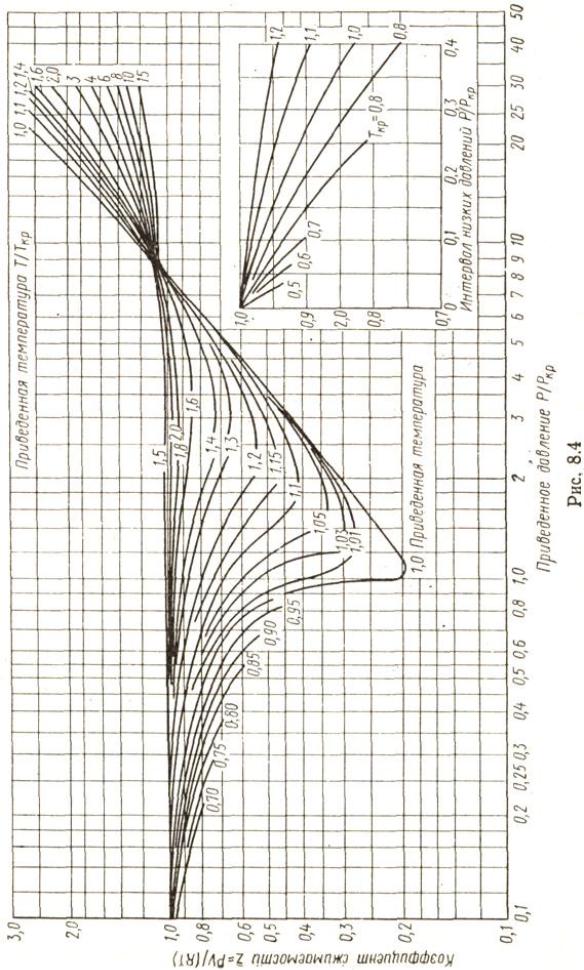
43
44
термодинамического подобия. Для этого, зная критические параметры вещества, находят π = p/ pкр и τ = T/Tкр, и по zπ-диаграмме определяют фактор сжимаемости. Удельный объем можно вычислить по формуле v=zRT/p.
Точность расчета по этому методу не превышает 15%, так как закон соответственных состояний выполняется лишь приближенно. Так, пои одинаковых π и τ факторы сжимаемости должны быть равны, причем должны быть равны и факторы сжимаемости в критической точке zкр= pкрvкр/(RTкр). Но для реальных веществ zкр = 0,23 ...0,33, следовательно, строго говорить о выполнении закона соответственных состояний можно лишь для узких групп сходственных между собой веществ.
