
Lekcii_po_TekhnichTermodinamike
.pdf
125
Таким образом, в соответствии с принятым выше
−∆U = −(U2 – U1) = Q +A,
или
−dU = dQ + dA.
Работа реакции складывается из работы расширения или сжатия L, отнесенной к 1 моль, и работы электрических, магнитных, световых и других сил,
обозначенной через Ах. Следовательно, работа реакции |
|
|
|
A = L + Ax |
(17.2) |
|
2 |
|
Так как L |
pdV , то |
|
|
1 |
|
|
2 |
|
|
A pdV Ax . |
(17.3). |
|
1 |
|
Изменение внутренней энергии может распределяться |
между теплотой и |
|
работой различно и возможны крайние случаи, когда: |
|
|
а) максимум внутренней энергии превращается в работу |
|
|
|
∆U = Qmin + Amax |
(17.4) |
где Amax — максимальная работа реакции; при этом в реакции выделяется минимум теплоты, не превращенной в работу;
б) в реакциях, кроме работы расширения и сжатия, другой работы не производится Amin=L; в этом случае имеем наибольшее количество теплоты и минимум работы:
∆U = Qmax + Amin |
(17.5) |
В первом случае реакция протекает в условиях полной обратимости, а во втором — она необратима.
Теплоты реакций
Раздел химической термодинамики, занимающийся изучением теплотой реакций и базирующийся на основных положениях первого закона, называется термохимией.
В химических процессах изменение состояния системы может характеризоваться не двумя, как в технической термодинамике, а тремя или более параметрами (например, давление, удельный объем, концентрация). При этом в процессе изменения состояния могут оставаться постоянными два параметра. Так как химические реакции рассматриваются идущими при постоянной температуре, то реакция, идущая при постоянном объеме, называется изохорноизотермической (V, Т= const), а реакция, идущая при постоянном давлении, называется изобарно-изотермической (p, T = const).
Для реакции между твердыми и жидкими телами или для газовых реакций, идущих в постоянном объеме dV = 0, Ах = 0,
V2
A L |
pdV 0; |
(17.6) |
V1
∆U = −(U2−U1) = QV,

126
где QV — теплота изохорно-изотермической реакции, соответствующая изменению внутренней энергии системы.
Для химической реакции, протекающей при постоянном давлении, dp = 0, Aх = 0, тогда
V2
A L pdV p(V2 V1), |
(17.7) |
V1
U Qp p(V2 V1)
где Qp — теплота реакции при постоянном давлении1. Тепловой эффект реакции при р = const
Qp |
U1 U2 |
pV2 |
pV1 (U1 p1V1) (U2 p2V2 ) (H2 H1), (17.8) |
где H1 U1 |
p1V1 и |
H2 |
U2 p2V2 — начальная и конечная энтальпии сис- |
темы. |
|
|
|
В зависимости от вида реакции (p, Т=const или V, T=const) получаются различные теплоты реакций.
Связь между ними может быть получена из соотношений (17.7) и (17.8).
Подставив значение ∆U=QV в формулу (17.8), имеем |
|
QV Qp p(V2 V1). |
(17.9) |
Если в реакции участвуют газообразные вещества, то из уравнения состояния идеального газа
pV nRT
где n — количество вещества газа в объеме V, моль; R = 8,314 кДж/(моль-К) — универсальная газовая постоянная, следует, что для изобарно-изотермической реакции (р, T=const)
p(V2 V1) (n2 n1)RT |
nRT . |
(17.10) |
Подставляя выражение (17.10) в (17.9), получим
QV Qp 8,314 nT |
(17.11) |
Таким образом, связь между тешютами реакций р, Т= const и V, T=const зависит как от температуры, при которой идет реакция, так и от изменения в ней количеств веществ газообразных реагентов.
Если ∆n > 0, то, например, в реакции*2
CO(r) |
1 |
O(r) |
CO(r) |
283,30кДж / моль |
|
||||
2 |
2 |
2 |
|
|
|
|
|
||
получим QV > QP. В этом случае система совершает работу расширения.
1 Теплота химической реакции при р = const и отсутствии всех видов работы, кроме работы расширения, сжатия, называется тепловым эффектом реакции, как это принято в физической химии.
* Верхние индексы означают: т — твердое, ж — жидкое и г — газообразное состояние,

127
Если ∆n < 0, примером может служить реакция
C H (ж) |
7 |
1 |
O(r) |
6CO(r) |
3H O(r) |
3259000 кДж / моль, |
|
|
|||||||
6 |
6 |
|
2 |
2 |
2 |
2 |
|
|
|
|
|
|
|
|
|
то QV < QP. При этом система воспринимает работу, совершаемую внешней средой (работу сжатия).
Если количества веществ в реакции остаются постоянными (∆n = 0), например в реакции
С(Т ) O2(r ) CO2(r ) 393,7 кДж/моль,
то QV=QP.
При составлении термохимических уравнений важно знать, в каком состоянии находятся реагирующие вещества, так как значение теплоты реакции зависит от их агрегатного состояния. Обычно в термохимических уравнениях, если это специально не оговорено, фигурируют теплоты реакций при постоянном давлении QP = −∆H.
При вычислении изменения энтальпии ∆H не имеет значения, какое состояние берется за начало отсчета. В термохимии за стандартное принято состояние элементов при T = 298 К и р = 1,01325 105 Па. Причем для элементов в
стандартном состоянии значение H 2980 равно нулю. (Нижний индекс в этой
величине указывает на стандартную абсолютную температуру, верхний — на стандартное давление.) Теплота образования вещества из элементов, определенная при стандартных условиях, называется стандартной теплотой
образования и обозначается H 2980 .
Большинство соединений образуется из элементов с выделением теплоты и соответственно табличные значения стандартных теплот образования отри-
цательны и лишь немногих эндотермических соединений, например NO( H 2980
), положительны. Стандартная теплота сгорания представляет собой изменение энтальпии при реакции данного вещества с элементарным кислородом, причем исходные вещества и продукты реакции должны быть взяты при стандартных условиях. Стандартная теплота какой-либо реакции может быть определена с помощью ряда таких реакций образования и сгорания, которые бы в сумме составили изучаемую реакцию. Стандартные эффекты реакций представляют собой изменение энтальпии реагентов в результате химической реакции до продуктов реакции в стандартных условиях. Обычно теплоты образования известны для неорганических соединений, а теплоты сгорания — для органических. При расчете двигателей внутреннего сгорания и воздушнореактивных двигателей используют теплотворность топлива.
Теплотворностью топлива называют удельное количество теплоты, выделенное при полном сгорании топлива. Теплотворность определяется опытным путем в бомбе при постоянном объеме НV или в калориметре при постоянном давлении НP:
HV H P p(V2 V1).
Разница между НV и НP не превышает 0,5... 1,5%, поэтому принимают НP = НV = Н.
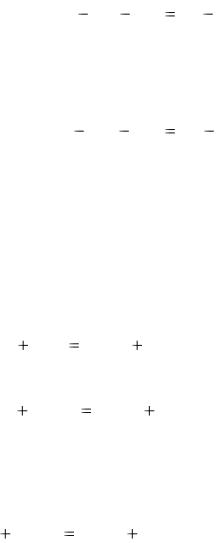
128
Закон Гесса
Первое начало термодинамики позволяет получить закон Гесса (или закон постоянства тепловых сумм), который указывает, что теплота реакции не зависит от пути реакции, а определяется лишь начальным и конечным состояниями реагирующих веществ.
Действительно, при V, Т= const
QV 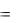 (U2 U1) U1 U2 ,
(U2 U1) U1 U2 ,
т. е. количество теплоты реакции не зависит от пути перехода системы из первого состояния во второе.
Если же реакция происходит при р, Т = const, то
QP  (H2 H1) H1 H2 ,
(H2 H1) H1 H2 ,
Закон Гесса позволяет вычислить теплоты таких реакций, для которых они непосредственно не могут быть измерены. В таких случаях составляют термохимические уравнения, решая которые определяют теплоту искомой реакции. Например, при сгорании твердого углерода, который никогда не сгорает целиком до образования оксида углерода, а всегда образует некоторое количество диоксида углерода СО2, имеем уравнения:
C(T ) O(r ) |
CO(r ) |
393,700кДж / моль; |
2 |
2 |
|
CO(r) |
1 |
O(r) |
CO(r) |
283,300кДж / моль. |
|
||||
2 |
2 |
2 |
|
|
|
|
|
||
Вычислим из первого уравнения второе, получим
С(T ) |
1 |
O2(r) |
CO(r) 110,400кДж / моль, |
|
|||
2 |
|
|
|
т. е. при неполном сгорании углерода выделяется 110,400 кДж на 1 моль СО, в то время как при полном сгорании углерода выделяется 393,720 кДж, а при сгорании оксида углерода 283,300 кДж на 1 моль СО2.
Закон Кирхгофа
Характер температурной зависимости теплоты реакции определяется уравнением Кирхгофа, которое легко получить на основании первого закона термодинамики,
Продифференцируем по температуре выражение для Q, определяемое первым законом термодинамики.
Для реакции V,T = const
129
Q |
|
U1 |
|
U2 |
CV |
CV , |
(17.12) |
|
T V |
T V |
T |
||||||
V |
2 |
|
||||||
|
|
|
|
|
1 |
|
||
где CV1 и CV2 — суммарные теплоемкости при постоянном давлении исходных и полученных веществ.
При изобарно-изотермических процессах p, T = const
Q |
|
H1 |
|
H2 |
CP |
CP , |
(17.13) |
|
T P |
T P |
T |
||||||
P |
2 |
|
||||||
|
|
|
|
|
1 |
|
||
где CP1 и CP2 − суммарные теплоѐмкости при постоянном давлении исходных и полученных веществ.
Суммарные теплоемкости системы перед реакцией и после реакции могут быть подсчитаны по формулам (см. § 3.4):
i |
m1 |
i |
m2 |
С1 |
n1c1; С2 |
|
n2c2 , |
i |
1 |
i |
1 |
где n1 и с1 — количества веществ и теплоемкости исходных веществ; n2 и с2 — количества веществ и теплоемкости полученных веществ; m1 и m2 — число компонентов исходных и полученных в реакции веществ соответственно.
Обобщение формул (17.12) и (17.13) приводит к зависимости
Q |
|
i |
m1 |
i |
m2 |
|
C1 |
C2 |
n1c1 |
|
n2c2 |
(17.14) |
|
|
|
|||||
T |
|
|||||
|
|
i 1 |
i |
1 |
|
Полученное выражение представляет собой математическое выражение закона Кирхгофа, по которому температурный коэффициент теплоты реакции dQ/dT равен разности сумм теплоемкостей исходных и полученных в реакции веществ.
Для определения теплоты реакции при любой температуре нужно знать зависимость Q=f(T). Если допустить, что истинные теплоемкости определяются эмпирическим степенным рядом
с c0 aT bT 2 ...,
то, подставляя их значение в формулу (17.14), получим, пропустив пределы у сумм
|
|
dQ |
|
n1c0 |
|
|
n2c0 |
|
|
(n1a1) |
|
(n2a2 ) T |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
dT |
|
|
|
|
|
|
|||||||||
|
|
|
|
1 |
|
|
|
2 |
|
|
|
|
|
(17.15) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
(n b ) |
|
|
(n b ) T 2 .... |
|
|
|
|
|||||
|
|
|
|
|
|
1 1 |
|
|
2 |
2 |
|
|
|
|
|
|
|
Интегрируя это уравнение, найдем |
|
|
|
|
|
|
|
|
|
||||||||
Q |
(n c ) |
(n c ) T |
|
|
(n a ) |
(n a ) T 2 |
/ 2 |
||||||||||
|
1 |
0 |
1 |
|
2 |
0 |
2 |
|
|
1 |
1 |
|
2 |
2 |
|
||
|
|
|
|
|
|
(n b ) |
(n b ) T 3 |
/ 3 |
... |
C, |
(17.16) |
||||||
|
|
|
|
|
|
1 1 |
|
|
2 |
2 |
|
|
|
|
|
||
где С — константа интегрирования. Введем для сокращения записи следующие обозначения:

130
(n1c01 )  (n2c02 )
(n2c02 ) 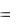 ;
;
(n1a1)  (n2a2 ) / 2
(n2a2 ) / 2 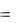 ;
;
(n1b1) |
(n2b2 ) / 3 . |
Подставляя эти обозначения в (17.16), находим
Q T T 2 T 3 ... C. |
(17.17) |
При Т = 0 К и C = Q0 уравнение теплоты реакции примет вид
Q Q T T 2 |
T 3.... |
(17.18) |
0 |
|
|
Постоянный член Q0 не представляет собой теплоту реакции при абсолютном нуле, так как использованные для составления уравнения (17.18) эмпирические уравнения теплоемкости не применимы при низких температурах. Таким образом, Q0 — просто свободный член эмпирического уравнения, применяемого лишь в области, далекой от абсолютного нуля. Значение Q0 может быть определено по известной теплоте реакции для какой-либо температуры.
Уравнение (17.18) одинаково справедливо как для условий V, Т = const, Q = QV = −∆U, так и для условий р, T = const, Q = QР= −∆H.
Если речь идет о стандартных условиях, то всем символам (∆U или ∆Н, CV и СP) следует приписывать верхний индекс — нуль, например:
HT0 |
0T |
0T 2 |
0T 3 |
... H2980 , |
(17.19) |
где постоянная H 2980 определяется при стандартных условиях, а числовые |
|||||
значения коэффициентов |
0 , 0 , |
0 должны |
характеризовать |
константу С |
|
(17.17) в стандартных условиях. |
|
|
|
|
|
Как известно, большинство химических реакций сопровождаются выделением (экзотермические реакции) либо поглощением (эндотермические реакции) теплоты. Первое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях еѐ проведения.
Тепловой эффект химической реакции – количество теплоты,
выделившейся либо поглотившейся в ходе реакции. Тепловой эффект относят, как правило, к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент перед которым максимален.
Например, реакцию окисления водорода в химической термодинамике
записывают в виде:
Н2 + 1/2 О2 = Н2О
и тепловой эффект рассчитывают на 1 моль водорода.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
131
1.Реакция протекает при постоянном объеме или давлении.
2.В системе не совершается никакой работы, кроме работы расширения.
3.Температура продуктов реакции равна температуре исходных веществ. Тепловые эффекты, сопровождающие протекание химических реакций,
являются предметом одного из разделов химической термодинамики – термохимии. Определим некоторые понятия термохимии.
Теплота образования вещества – тепловой эффект реакции образования 1 моля сложного вещества из простых. Теплоты образования простых веществ принимаются равными нулю.
Теплота сгорания вещества – тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших устойчивых оксидов.
Теплота растворения – тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Теплота растворения складывается из двух составляющих: теплоты разрушения кристаллической
решетки (для твердого вещества) и теплоты сольватации: |
|
|
||
|
|
(27) |
|
|
Поскольку |
Нкр.реш всегда |
положительно |
(на |
разрушение |
кристаллической решетки необходимо затратить энергию), а |
Нсольв всегда |
|||
отрицательно, знак |
Нраств определяется соотношением абсолютных величин |
|||
Нкр.реш и Нсольв: |
|
|
|
|
|
|
(28) |
|
|
Поскольку полнота сольватации частиц растворѐнного вещества зависит от концентрации раствора, выделяют несколько видов теплот растворения.
Интегральная теплота растворения ΔHm – количество теплоты,
выделяющееся или поглощающееся при растворении 1 моля вещества в таком количестве растворителя, чтобы получился раствор концентрации m. Интегральные теплоты растворения при бесконечном разбавлении (m –> 0) и насыщении (m = S) получили особые названия: первая теплота растворения
ΔHo и полная |
теплота растворения |
ΔHS соответственно. При добавлении |
|||
вещества |
к |
собственному |
раствору |
выделяется |
или |
поглощается промежуточная теплота растворения 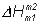
конечная концентрация раствора).
Добавление растворителя к соответствующим растворам конечной концентрации также сопровождается тепловым эффектом. Интегральная теплота разведения ΔH°m – тепловой эффект разбавления раствора, содержащего 1 моль растворѐнного вещества при концентрации m, до
бесконечного разведения (m = 0). Промежуточная теплота разведения 
– тепловой эффект разбавления раствора, содержащего 1 моль вещества, от концентрации m1 до концентрации m2 (m2 < m1).
Основным законом термохимии является закон Гесса, являющийся частным случаем первого начала термодинамики:
Тепловой эффект химической реакции, проводимой в изобарноизотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути еѐ протекания.
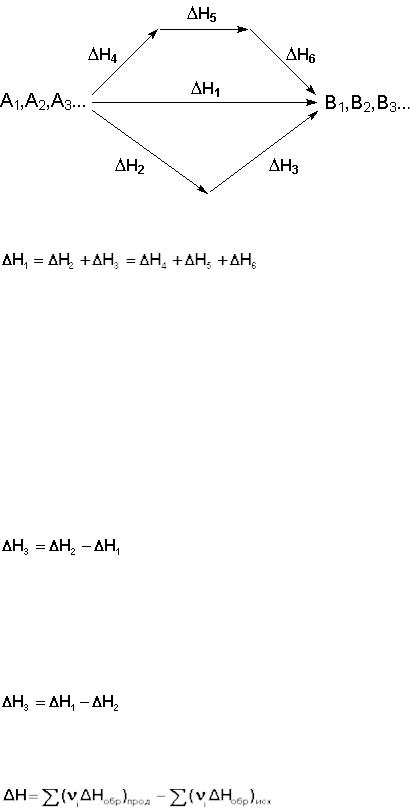
132
Выше было показано, что изменение энтальпии Н (тепловой эффект изобарного процесса Qp) и изменение внутренней энергии ΔU (тепловой эффект изохорного процесса Qv) не зависят от пути, по которому система переходит из начального состояния в конечное.
Рассмотрим некоторый обобщенный химический процесс превращения исходных веществ А1, А2, А3... в продукты реакции В1, В2, В3..., который может быть осуществлен различными путями в одну или несколько стадий:
Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
(29)
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1.Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (т.н. закон Лавуазье – Лапласа).
2.Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой
эффект перехода из одного конечного состояния в другое.
С + О2 |
––> СО + 1/2 О2 |
Н1 |
С + О2 |
––> СО2 |
Н2 |
СО + 1/2 О2 ––> СО2 |
Н3 |
|
|
|
(30) |
3. Для |
двух реакций, |
имеющих одинаковые конечные, но разные |
исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое.
С(алмаз) + О2 |
––> СО2 |
Н1 |
С(графит) + О2 |
––> СО2 |
Н2 |
С(алмаз) ––> С(графит) |
Н3 |
|
(31)
4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
(32)
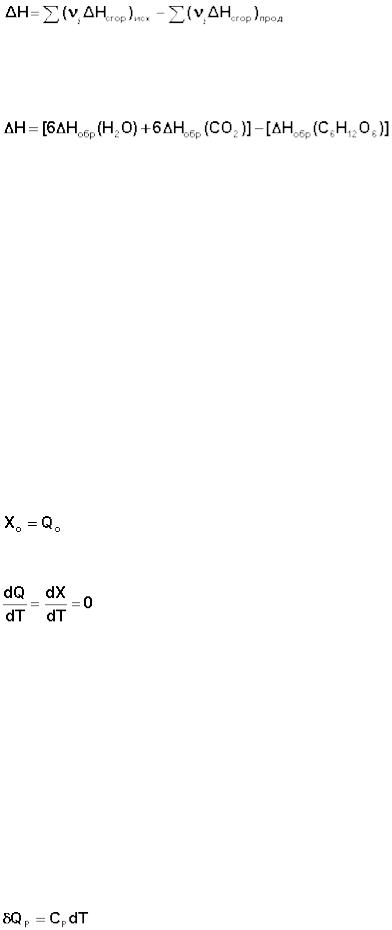
133
5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
(33)
В качестве примера рассмотрим расчет теплового эффекта реакции окисления одного моля глюкозы (теплоты образования кислорода по определению равны нулю):
С6Н12О6 + 6 О2 = 6 СО2 + 6 Н2О
Величины тепловых эффектов химических реакций зависят от условий, в которых проводятся реакции. Поэтому табличные значения теплот различных процессов принято относить к стандартному состоянию – температуре 298 К и давлению 101325 Па (760 мм рт. ст.; 1 атм.); величины тепловых эффектов при данных условиях называют стандартными тепловыми эффектами – Н°298,
ΔU°298.
Закон Нернста.
Ранее мы показали, что внутреннюю энергию системы можно условно представить в виде суммы двух величин "свободной" и "связанной" энергии. Возможность рассчитать величину "свободной" энергии, т.е. той части внутренней энергии системы, которую можно превратить в работу, дает тепловая теорема Нернста, называемая также третьим началом термодинамики.
Основные положения тепловой теоремы заключаются в следующем:
1. При абсолютном нуле температуры свободная энергия X равна теплоте процесса.
(I.59)
2. При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.
(I.60)
Одной из формулировок третьего начала термодинамики является также постулат Планка:
Энтропия идеального кристалла при абсолютном нуле температуры равна нулю.
Строго говоря, тепловая теорема Нернста и постулат Планка являются следствиями из второго начала термодинамики; но независимо от этого они имеют очень большое значение, позволяя рассчитывать абсолютную энтропию системы и, следовательно, величину свободной энергии системы.
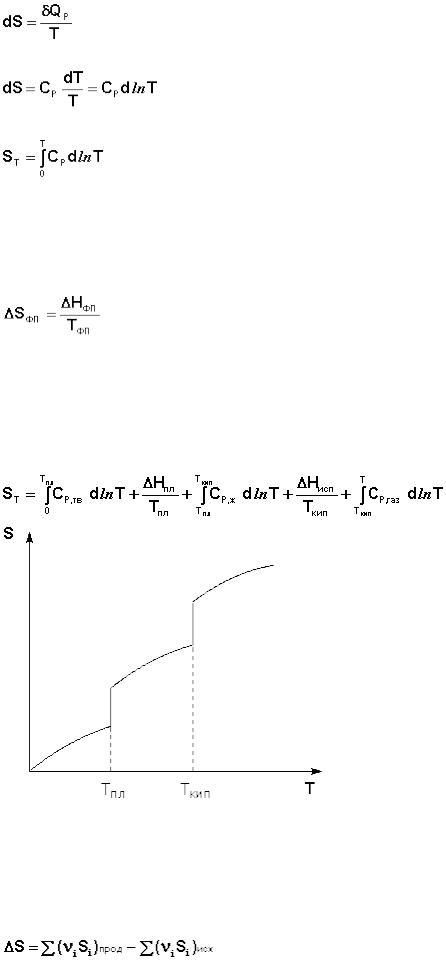
Расчет абсолютной энтропии
Рассчитаем изменение энтропии некоторой системы при нагревании еѐ от абсолютного нуля до температуры T при постоянном давлении. Из первого и второго начал термодинамики имеем:
(I.61)
134
(I.62)
Отсюда:
(I.63)
Учитывая, что ST=0 = 0, получим:
(I.64)
При T = 0 любое вещество может находиться только в твердом состоянии. При нагревании вещества возможен его переход в жидкое и затем в газообразное состояние; для фазовых переходов, происходящих в изобарноизотермических условиях, изменение энтропии равно приведенной теплоте фазового перехода:
(I.65)
Таким образом, нагревание вещества без фазовых переходов сопровождается непрерывным ростом энтропии; при фазовом переходе происходит скачкообразное изменение энтропии. Графическая зависимость энтропии вещества от температуры приведена на рисунке 1.3.
Учитывая это, рассчитать абсолютную энтропию любого вещества при любой температуре можно следующим образом:
(I.66)
Рис. 1.3 Зависимость энтропии вещества от температуры.
Поскольку энтропия есть функция состояния, изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции; оно может быть рассчитано по уравнению (I.67):
(I.67)
Для многих веществ величины абсолютной энтропии в стандартных условиях приведены в справочной литературе.
