
6 курс / Эндокринология / Эндокринология_и_метаболизм_Фелиг_Ф_,_Бакстер_Дж_Д_,_Бродус_А_Е
.pdfприсутствуют в печени, почках, плазме крови и цитоплазме нейронов. Главными метаболитами норадреналина и адреналина являются ванилилминдальная кислота и ме- токси-оксифенилгликоль, оба экскретируемые с мочой.
Продуктами биологического метаболизма дофамина, обнаруживаемыми в моче, являются гомованилиновая кислота и метокситирамин. Хотя дополнительные минорные О-метилированные метаболиты адреналина и норадреналина — метанефрин и норметанефрин, образующиеся под действием катехол-О-метилтрансферазы, составляют лишь небольшую фракцию мочевых метаболитов, они лучше и непосредственнее отражают количество выделяемых в кровь биологически активных аминов, чем дезаминированные продукты. Катехоламины, поглощаемые эффекторными клетками, такими, как нейроны и гепатоциты, метаболизируются почти полностью. В моче присутствует лишь очень небольшое количество неизмененных аминов.
СТЕРОИДНЫЕ ГОРМОНЫ НАДПОЧЕЧНИКОВ
Кора надпочечников служит главным источником глюкокортикоидных и минералокортикоидных стероидных гормонов и в меньшей степени половых стероидных гормонов. Корковое вещество разделяется на три зоны, которые можно различить по морфологическому виду клеток и продуцируемым ими стероидным соединениям. Самый наружный слой коры — клубочковая зона — является местом синтеза минералокортикоидов, из которых наибольшее функциональное значение у человека и крысы имеют соответственно альдостерон и кортикостерон. Клетки средней зоны — пучковой — продуцируют глюкокортикоиды кортизол и кортизон. Самый внутренний слой — сетчатая зона — также принимает участие в синтезе глюкокортикоидов и, кроме того, как считают, производит небольшое количество стероидных половых гормонов андрогенов и эстрогенов. Главными источниками стероидных половых гормонов, однако, служат половые железы, и продукции половых гормонов корой надпочечников придают функциональное значение только в необычных условиях, когда на путях биосинтеза в надпочечных железах появляются дефекты ферментов. Функциональное подразделение биосинтетической активности коры надпочечников по анатомическим областям основано на результатах гистологических и гистохимических исследований этой ткани после «удаления» ее специфических стимуляторов. Гипофизэктомия и вызываемое ею отсутствие АКТГ приводят к атрофии пучковой и сетчатой зон, тогда как в клубочковой зоне появляются очень небольшие изменения. В то же время хроническая нагрузка натрием вызывает избирательную атрофию клубочковой зоны. Наоборот, при длительной стимуляции АКТГ или ограничении потребления натрия возникает соответственно гипертрофия пучковой и сетчатой или клубочковой зоны. Как будет показано далее, некоторые специфические ферменты, необходимые для образования минерале- и глюкокортикоидов, обнаруживаются только в специфических зонах коркового слоя надпочечников.
СТАДИИ БИОСИНТЕЗА
Биосинтез стероидных гормонов проходит сложную последовательность контролируемых ферментами этапов (рис. 3—17 [37, 38]. Ближайшим химическим предшественником надпочечниковых стероидов является холестерин, который не только поглощается клетками коры надпочечников из крови, но и образуется внутри этих клеток. Синтез холестерина начинается с ацетил-СоА и проходит через ряд промежуточных продуктов. Точное соотношение поглощенного из крови и образованного в самих клетках холестерина неизвестно, но, по-видимому, оба процесса играют существенную роль в обеспечении биосинтеза стероидных гормонов необходимым субстратом. Холестерин, будь то поглощенный из крови или синтезированный в коре надпочечников, накапливается в цитоплазматических липидных каплях (см. раздел, посвященный клеточному пути биосинтеза). Затем в митохондриях холестерин превращается в прегненолон путем образования вначале 20а-оксихолестерола, потом 20а, 22диоксихолестерола и, наконец, расщепления цепи между 20-м и 22-м углеродным атомом с образованием прегненолона. Считается, что превращение холестерина в прегненолон является ограничивающим скорость этапом биосинтеза стероидных гормонов
и |
что именно этот этап контролируется стимуляторами надпочечников: АКТГ, калием |
и |
ангиотензином II. В отсутствие стимуляторов надпочечники образуют очень мало |

прегненолона и стероидных гормонов. Прегненолон трансформируется в глюко-, минералокортикоиды и половые гормоны тремя разными ферментативными реакциями. Основной путь, наблюдаемый в пучковой зоне, включает дегидрирование 3|3- гидроксильной группы прегненолона с образованием прегн-5-ен-3,20-диона, который затем подвергается изомеризации в прогестерон. В результате серии гидроксилирований прогестерон превращается в 17а-оксипрогестерон под влиянием системы 17а-
гидроксилазы, а затем в 17а, 21-диоксипрогестерон (17 -оксидезоксикортикостерон,
11-дезоксикортизол, соединение S) и, наконец, в кортизол в ходе 11 - гидроксилирования (соединение F). У крыс главным глюкокортикоидом, синтезируемым в коре надпочечников, является кортикостерон; небольшое количество кортикостерона продуцируется и в коре надпочечников человека. Путь синтеза кортикостерона идентичен таковому кортизола, за исключением лишь отсутствия этапа 17агидроксилирования. Альдостерон образуется из прегненолона в клетках клубочковой зоны путем, отличающимся от пути синтеза кортизола несколькими моментами. Клу-
бочковая зона не содержит 17 -гидроксилазы и поэтому лишена способности синтезировать кортизол. Вместо него образуется кортикостерон, часть которого под действием 18-гидроксилазы превращается в 18-оксикортикостерон и затем под действием 18-оксистероиддегидрогеназы — в альдостерон. Поскольку 18оксистероиддегидрогеназа обнаружена только в клубочковой зоне, считается, что и синтез альдостерона ограничен этой зоной.
Рис. 3—17. Схематическое изображение внутриклеточного процесса биосинтеза кортикостероидов в надпочечниках. Следует обратить внимание на точку разветвления путей после образования прогестерона, в которой начальное 21гидроксилирование приводит к образованию минералокортикоидов (кортикостерон, альдостерон), а 17-гидроксилирование — к образованию глюкокортикоидов (кортизол)
[Malamed, 39].
Хотя главными физиологически значимыми стероидными гормонами, продуцируемыми корой надпочечников, являются кортизол и альдостерон, эта железа образует и небольшие количества андрогенов и эстрогенов, синтезируемых 3-м путем, в ходе которого 17,20-десмолаза превращает 17-оксипрогненолон и 17а-окси-ирогестерон в
слабые андрогены дегидроэпиандростерон и -андростендион соответственно. Небольшие количества этих андрогенов превращаются в андрост-4-ен-3,17-дион и тестостерон. По всей вероятности, из тестостерона образуются также небольшие количества эстрогена 17бета-эстрадиола.
В норме превращение прегненолона в конечные продукты — кортизол, альдостерон, кортикостерон и дегидроэпиандростерон — происходит столь быстро, что эти продукты (но ни один из интермедиатов) являются единственными, которые накапливаются в количествах, достаточных для обеспечения физиологически значимой секреции.
Различные ферменты, принимающие участие в биосинтезе стероидов, можно разделить на три класса: гидроксилазы и лиазы (отщепляющие боковые цепи), требующие кислорода и НАДФ-Н; дегидрогеназы, которые используют НАД+ в качестве акцептора водорода и катализируют обратимые реакции; изомеразы, коферменты которых не идентифицированы. Гидроксилазы включают в себя несколько белков; они идентифицированы как ФАД-со держащий флавопротеин, негемовый железопротеин — адренодоксин и протопорфирин, гемопротеин — цитохром Р-450.
Источником восстановительной энергии для гидроксилирования является НАДФ- Н. В митохондриях и гладком эндоплазматическом ретикулуме, по-видимому, происходят близкие мультикомионентные реакции гидроксилирования. Однако компоненты систем в органеллах обоих типов различаются. В митохондриях для переноса электронов на цитохром С или цитохром Р-450 необходим как специфический флавопротеин, так и адренодоксин. В эндоплазматическом ретикулуме главным участником переноса электронов является другой флавопротеин, непосредственно восстанавливающий цитохром С; перенос же электронов на цитохром Р-450 облегчается, по-видимому, фосфолипидом.
Следует отметить существование врожденных клинических состояний, обусловленных дефицитом одного или нескольких ферментов, участвующих в реакциях биосинтеза. В этих условиях скорость ограничивающим становится тот этап биосинтетического процесса, который катализируется дефицитным ферментом, причем накапливаются и секретируются в избыточных количествах предшественники (субстраты) замедленной реакции. В настоящее время выяснены следующие клинические формы этих состояний дефицит 2-гидроксилазы (встречается чаще всего), сочетание дефицита 21гидроксилазы с дефицитом 18-гидроксилазы, дефицит 11-гидроксилазы и 17-
гидроксилазы. Еще две формы являются следствием дефицита либо 3 -оксистероид- дегидрогеназы, либо 18-оксидегидрогеназы. Все эти ферментные блоки приводят к недостаточной продукции и секреции кортизола — наиболее важного регулятора выделения АКТГ по принципу обратной связи. В результате уровень АКТГ в крови резко повышается и кора надпочечников становится объектом интенсивной стимуляции. Развивается выраженная гиперплазия ее. Продукция стероидов, образующихся проксимальнее заблокированного этапа процесса биосинтеза, увеличивается во много раз и достигает патологического уровня. Например, при недостаточности активности 21гидроксилазы вследствие дефицита кортизола и альдостерона возникают гипогликемия и потеря соли, а вследствие избыточной продукции слабых андрогенов — дегидроэпи-
андростерона и -андростендиона — развивается выраженная вирилизация. Лечение кортизоном или кортизолом приводит к подавлению секреции АКТГ и снижению количества секретируемых надпочечниковых андрогенов.
Некоторые вещества оказывают избирательное ингибиторное действие на ферменты стероидогенеза. Метиранон, 2-метил-1,2-ди-3-пиридил-1-пропанон (SU 4885),
снижает или полностью ингибирует 11 -гидроксилазу, что приводит к снижению секреции кортизола и одновременному увеличению секреции дезоксикортикостерона и 11дезоксикортизола вследствие увеличения секреции АКТГ. Доказана большая клиническая польза метирапонового теста на функциональную целостность надпочечниковогипофизарной оси; адекватное повышение уровня 11-дезоксикортизола в крови или 17-оксистероидных метаболитов в моче после введения этого вещества является веским доказательством сохранения функции как коры надпочечников, так и гипофиза. Аминоглютетимид (2-этил-2-аминофенил глютарамид) тормозит превращение холе-
стерина в 20 -оксихолестерол; это приводит к накоплению холестерина в коре над-

почечников и ингибированию синтеза кортикоидов. Соединение 1,1-дихлор-2-(о- хлорфенил)–2-(р-хлорфенил)-этан (о, р-ДДД) вызывает дегенеративные изменения именно в митохондриях надпочечников, вследствие чего тормозится секреция адренокортикостероидов. Механизм действия этого вещества сводится, по-видимому, к широкому угнетению активности многих ферментов коры надпочечников. Как аминоглютетимид, так и о, р-ДДД с определенным успехом применяются в лечении карциномы коры надпочечников.
Рис. 3—18. Часть адренокортикальной клетки крысы. а — ЛК — липидная капля: М —
митохондрия; ГЭР — гладкий эндоплазматический ретикулум; ПМ — плазматическая мембрана. Следует обратить внимание на скудность шероховатого эндоплазматического ретикулума. х21 000; б — круглые структуры в матриксе митохондрий — это срезы через пузырьки и в некоторых случаях— через трубочки. Стрелками показаны взаимосвязи между трубочками и/или пузырьками (см. рис. 3—19) (Malamed). Электронная микрофотография.
х42 700.
СУБКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ ЭТАПОВ БИОСИНТЕЗА
Исследование ультраструктуры клеток паренхимы коры надпочечников млекопитающих выявило три четкие особенности, свойственные этому органу и некоторым другим стероидпродуцирующим клеткам, таким, как интерстициальные клетки яичников и семенников (рис. 3—18) [39]. Этими особенностями являются: 1—присутствие широкой сети гладкого эндоплазматического ретикулума без прикрепленных к нему рибосом и практически отсутствие ШЭР; 2 — присутствие большого количества липидных капель; 3 — присутствие высокоспециализированных и характерных митохондрий, структурно отличающихся от митохондрий других клеток тем, что они содержат трубчатые, пальцевидные инвагинации в складках внутренней мембраны (кристах) (рис. 3—19) Эти ультраструктурные особенности соответствуют особенностям биосинтеза стероидных гормонов в клетках коры надпочечников. Ферментативные этапы биосинтеза стероидов в клетке локализуются внутри мембран гладкого эндоплазматического ретикулума и митохондрий. Липидные капли содержат холестерин — сырой материал для синтеза стероидов; внутри капель заключено 75% общего количества холестерина в клетке, 8% находится в гладком эндоплазматическом ретикулуме, а остальное—в митохондриях.

Рис. 3—19. Предполагаемое строение митохондрий клеток коры надпочечников. Рисунки выполнены на основе электронно-микроскопической картины поперечных срезов адренокортикальных клеток (см. рис. 3—186) (Malamed [39]).
Относительная скудность рибосом отражает тот факт, что ферменты, участвующие в отдельных реакциях биосинтеза гормонов, стабильны, не покидают клетку и обладают длительным периодом полужизни в клетке. Эта особенность клеток коры надпочечников резко отличает их от клеток, секретирующих белковые гормоны, и, например, от клеток мозгового слоя надпочечников, в котором ключевой фермент
синтеза катехоламинов — -гидроксилаза — секретируется из клетки. В клетках, богатых рибосомами и ШЭР, кругооборот белков происходит с высокой скоростью и соответственно требуется большая скорость синтеза белка, чтобы возместить потери его в результате секреции во внеклеточное пространство.
Исследования с фракционированием клеток и применением цитохимической идентификации отдельных процессов способствовали выяснению локализации ферментов биосинтеза в тех или иных субклеточных пространствах (см. рис. 3—17). Необходимо учитывать, однако, возможность получения артефактов в связи с неспецифической адсорбцией ферментов на субклеточных фракциях. Ионы ацетата полимеризуются в холестерин из ацетил-СоА в гладком эндоплазматическом ретикулуме. У животных некоторых видов определенные количества холестерина поступают в клетку и пз плазмы крови. Последующие реакции протекают в митохондриях, где холестерин превращается в прегненолон. Прегненолон покидает митохондрию и вновь проникает в гладкий эндоплазматический ретикулум, в котором образуется прогестерон и, следуя по глюкокортикоидному пути, далее гидроксилируется в 17-м и 21-м положениях, образуя 17- окси-дезоксикортикостерон (11-дезоксикортизол). Последний этап—11- гидроксилирование — происходит в митохондриях. Образование минералокортикоидов несколько отличается от образования глюкокортикоидов. Оба эти пути расходятся на стадиях после образования прогестерона. Альдостерон синтезируется за счет 21гидроксилирования прогестерона в гладком эндоплазматическом ретикулуме, вслед за чем происходят 11-, 18-гидроксилирование и, наконец, превращение под действием 18-дегидрогеназы; все эти процессы протекают в митохондриях (см. рис. 3—17).
Тесное сопряжение ферментативных реакций, протекающих в митохондриях и гладком эндоплазматическом ретикулуме, подтверждается ультраструктурными наблюдениями, свидетельствующими о близком соседстве митохондрий, эндоплазматического ретикулума и липидных капель. Высокая складчатость и трубчатая структура митохондриальных и ретикулярных мембран создает большую поверхность, на которой могут разворачиваться ферментативные процессы.
Если схема, приведенная на рис. 3—17, верна, то внутриклеточная локализация стероидогенеза трижды перемещается из гладкого эндоплазматического ретикулу-
ма в митохондрии. Это предполагает перемещение субстратов или мембран органелл или тех и других вместе. Клеточные и молекулярные механизмы, направляющие эту серию внутриклеточных транслокаций, точно не известны.
Транспорт прегненолона из митохондрий в эндоплазматический ретикулум зависит не от связывания с белками цитозоля, а скорее от сильной ассоциации с каки- ми-то молекулами в эндоплазматическом ретикулуме. Это обеспечивает в равновесных условиях высокую концентрацию прегненолона в эндоплазматическом ретикулуме по сравнению с его концентрацией в цитозоле. Такой перенос в эндоплазматический ретикулум поддерживает разницу концентраций между митохондриями и цитозолем, что, по-видимому, и обеспечивает постоянную диффузию из митохондрий.
Очертить морфологию пути секреции стероидных гормонов в клетках коры надпочечников не представляется возможным. Не удается точно идентифицировать дискретные секреторные гранулы или пузырьки. Одной из причин отсутствия сведений по этому вопросу является накопление лишь очень малого количества стероидных гормонов перед их выделением из железы. Морфологическое следствие такого отсутствия отложения гормонов заключается в том, что в клетках коры надпочечников присутствует, вероятно, очень мало органелл (гранул, пузырьков), в которых обычно хранятся внутриклеточные запасы веществ. Возможно, однако, что какая-то часть липидных капель, в избытке присутствующих в клетке, содержит стероидные гормоны, высвобождающиеся из клетки путем экзоцитоза.
РЕГУЛЯЦИЯ СЕКРЕЦИИ
Регуляция функции коры надпочечников будет рассмотрена на примере некоторых сторон контроля за секрецией и синтезом кортизола.
Наиболее важным, если не единственным, физиологическим регулятором продукции кортизола является. АКТГ [40, 41]. Длительное повышение уровня АКТГ в крови, наблюдаемое при некоторых опухолях гипофиза или других, не гипофизарных, опухолях с эктопической продукцией АКТГ, сопровождается гиперплазией надпочечников и гиперкортицизмом. Напротив, гппофизэктомия приводит к атрофии надпочечников, особенно пучковой и сетчатой зон. Синтез и секреция АКТГ в свою очередь регулируются уровнем кортизола в крови путем замыкания ингибиторной петли обратной связи непосредственно на аденогипофизе. Полагают, что кортизол может действовать также на гипоталамические и другие мозговые центры, регулируя продукцию кортико- тропин-рилизинг фактора, но убедительных доказательств существования такого регуляторного пути пока не получено. Несомненно, однако, что влияние ЦНС является важной детерминантой высвобождения АКТГ. Разнообразные стрессы, такие, как гипогликемия, тяжелая травма и болезни, а также эмоциональные стрессы, стимулируют секрецию АКТГ, несмотря на присутствие в крови таких уровней кортизола, которые в норме оказывают ингибиторное действие. Основной регулятор секреции АКТГ и, следовательно, продукции кортизола, по всей вероятности, действительно образуется в головном мозге. Уже много лет известно, что секреция АКТГ и кортизола обнаруживает суточные ритмы, определяемые «биологическими часами», расположенными в головном мозге и подчиняющимися конкретным циклам свет — темнота и/или бодрствование — сон [42, 43]. У здоровых людей, бодрствующих днем и спящих ночью, максимальная скорость секреции приходится на период между полуночью и рассветом, а минимальная регистрируется после полудня и ранним вечером. Примерно 80—90% общей суточной секреции кортизола приходится на период между 4 и 6 ч утра. В интервале между этими периодами железа остается в спокойном состоянии. Подробные исследования характера секреции у здоровых людей, проводимые путем анализа проб крови, отбираемых в течение 24 ч с частыми интервалами, обнаружили существование нерегулярных выбросов
АКТГ и кортизола, разделенных промежутками полного отсутствия секреции [44]. Такая эпизодическая секреция, по-видимому, вообще характерна для гормонов передней доли гипофиза, поскольку СТГ, пролактин, ЛГ и ФСГ также секретируются «вспышками». Причины и физиологическая значимость такого нерегулярного характера секреции не известны. Эта нерегулярность не определяется соответствующими колебаниями уровня содержания в крови тех или иных гормонов, продукция которых контролируется гипофизарными гормонами, но накладывается на гораздо более широкие во времени колебания, реципрокно связанные с уровнем в крови продуктов, выделяемых органами-мишенями.
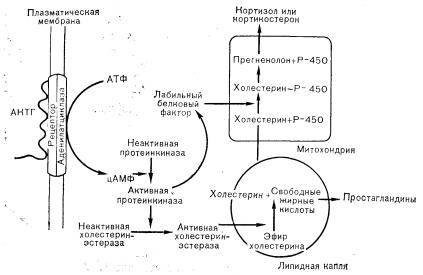
Влияние АКТГ на секрецию кортизола надпочечниками проявляется быстро [41]. Повышение уровня кортизола в крови отмечается уже в пределах 2—3 мин после введения АКТГ человеку или экспериментальному животному. Поскольку клетки коры надпочечников содержат мало депонированного кортизола, эти быстрые эффекты АКТГ предполагают повышение скорости биосинтеза стероидов, а не ускорение секреции уже готового гормона. Такое быстрое действие должно сказываться на реакциях, происходящих до гидроксилирования и отщепления боковой цепи холестерина или во время этих процессов и обусловливающих образование прегненолона, поскольку именно этот этап идентифицирован в качестве скорость ограничивающего в процессе биосинтеза стероидов.
МЕХАНИЗМ ДЕЙСТВИЯ АКТГ
Считают, что в клеточных механизмах, с помощью которых АКТГ влияет на высвобождение и синтез кортизола и других стероидных гормонов коры надпочечников, участвует активация связанной с клеточной мембраной аденилатциклазы, подобно тому, что наблюдается при активации секреторных и клеточных процессов во многих других тканях [41]. АКТГ специфически и с высоким сродством связывается с рецепторами, расположенными на плазматической мембране клеток коры надпочечников, что приводит к активации аденилатциклазы и образованию цАМФ. Последующие молекулярные реакции менее выяснены, но, по всей вероятности, цАМФ обусловливает фосфорилирование одной или более протеинкиназ, тем самым переводя их из неактивных комплексов в форму активных каталитических субъединиц, которые в свою очередь фосфорилируют и, следовательно, активируют ферменты, принимающие участие в процессах биосинтеза стероидов. Точная природа последних стадий в серии происходящих реакций не известна, и модели, изображающие эти реакции, в настоящее время следует считать лишь предположительными. Одна такая модель представлена на рис. 3— 20. Эта схема предусматривает возможность двух, не противоречащих имеющимся сведениям, реакций, с помощью которых фосфорилированные протеинкиназы контролируют (активируют) ранние стадии синтеза стероидов. Одна из них предполагает повышение внутримитохондриального связывания холестерина и цитохрома Р-450, что является важным этапом ферментативного гидроксилирования и отщепления боковой цепи холестерина с образованием прегненолона вследствие активации гипотетического лабильного интермедиата (холестерин-Р-450).
Другой реакцией, которая могла бы контролироваться активированной протеинкиназой, является фосфорилирование и последующая активация цитоплазматического фермента холестеринэстеразы, которая расщепляет эфир холестерина с образованием свободного холестерина. Эти предполагаемые объекты действия протеинкиназ соответствуют данным, полученным при кинетическом анализе скорости реакций на различных стадиях биосинтеза стероидов и показавшим, что скорость ограничивающим этапом является превращение холестерина в прегненолон.
Рис. 3—20. Предполагаемый механизм действия АКТГ на клетку коры надпочечника. Согласно этой модели, АКТГ не проникает в клетку, а стимулирует продукцию второго медиатора—цАМФ—путем активации связанной с рецептором аденилатциклазы в плазматической мембране. Холестерин может образовываться в гладких микросомах до проникновения в липидные капли (см. рис. 3—19) (Simpson E.R. и соавт., J. Biol. Chem., 1978, 235, 3135),
ВИТАМИН D: БИОГЕНЕЗ И МЕТАБОЛИЗМ
В начале века впервые был обнаружен и назван витамином D жирорастворимый фактор, содержащийся в печеночной ткани животных и рыб и обладающий способностью излечивать рахит. Позднее было показано, что аналогичный антирахитический фактор может образовываться в коже млекопитающих и в некоторых растениях (зерновые, бобовые) под влиянием ультрафиолетовых лучей [45, 46]. Это открытие означало, что данный фактор не является витамином в строгом смысле, поскольку он вырабатывается в коже и переносится кровью к объектам своего действия в отдаленных тканяхмишенях, что является характерной особенностью гормонов. Таким образом, витамин D представляет собой и витамин, если он поступает в организм извне, и гормон, если он образуется в коже под действием ультрафиолетовых лучей.
ХИМИЯ
Исследования, проведенные до 30-х годов, привели к выяснению структуры витаминов D3 (холекальциферол) и D2 (эргокальциферол), которые представляют собой
9,10-секо-производные 7-дегидрохолестерина (холеста- 5,7-диена) и эргостерола
(эргоста- 5,7-диена), соответственно [47, 48]. Витамин D3—это именно та форма витамина, которая образуется в коже под влиянием ультрафиолетовых лучей и депонируется в печени, а витамин D2 образуется при облучении растительных стеролов.
Интенсивные исследования, проведенные в течение последних 20 лет, позволили расшифровать процесс биосинтеза, включающий последовательное гидроксилирование, которое превращает неактивные стероловые предшественники в активную форму витамина D — 1,25-диоксивитамин D [1,25 (OH)2D] [49—51].
ЭТАПЫ БИОСИНТЕЗА: ФОТОБИОГЕНЕЗ И МЕТАБОЛИЗМ
Схема стадий биосинтеза витамина D3 (холекальциферол) приведена на рис. 3— 21. Субстратом синтеза 7-дегидрохолестерина — «провитамина» служит ацетил-СоА. Ультрафиолетовый фотолиз провитамина приводит к образованию 6,7-цис изомера, называемого «провитамин D3» (преD3). Этот изомер под действием температуры превращается в коже в витамин D3. Аналогичная группа реакций наблюдается и при образовании витамина D2 (эргокальциферол) из провитамина эргостерола. Витамины В3 и Da затем транспортируются на специфических, связывающих витамин D, белках плазмы в печень, где карбоксилируются по 25-му углеродному атому (С-25) с образованием одного из главных циркулирующих в крови метаболитов — 25-оксивитамина D (25OHD). Хотя именно печень является главным местом 25гидроксилирования витамина D, однако в некоторой степени оно происходит и в других органах. Витамин D3 25гидроксилаза локализуется в микросомах печени (и других органов), причем ферментативная реакция в качестве кофакторов требует восстановленного НАДФ и молекулярного кислорода. В физиологических концентрациях ни витамин D, ни 25-OHD не способны стимулировать транспорт кальция в кишечнике или мобилизацию кальция из костей.
Конечной активной формой витамина является 1,25(ОН)2D. Этот дважды гидроксилированный метаболит образуется в почках путем гидроксилирования 25-OHD, синтезируемого в печени и транспортируемого белковыми переносчиками плазмы в почки. Считается, что почки являются главным, если не единственным местом локализации la-гидроксилазы 25-OHD. В отличие от 25-гидроксилазы витамина D, которая присут-
ствует в печеночных микросомах, 1 -гидроксилаза 25-OHD локализуется в митохондриях почечных клеток, и реакция гидроксилирования требует присутствия НАДФ-Н, молекулярного кислорода и ионов магния. Кроме того, этот фермент представляет собой оксидазу со смешанными функциями, зависимую от цитохрома Р-450. 1,25(OH)2D

транспортируется белками-переносчиками плазмы в специфические клетки-мишени кишечника и скелета, где и оказывает свое биологическое действие. О точной природе белков плазмы, участвующих в транспорте витамина D и его метаболитов, известно
мало. По-видимому, они являются -глобулинами, но не ясно, один или несколько белков выполняют эту транспортную функцию.
Рис. 3—21. Начальные этапы биосинтеза витамина D. 7-Дегидрохолестерин (провитамин D), образующийся из ацетил-СоА, накапливается в коже, где в ответ на солнечное или ультрафиолетовое излучение вследствие фотометаболизма превращается в витамин В3 (холекальциферол) через промежуточные стадии, включающие образование превитамина D.
Механизм действия 1,25(OH)2D, очевидно, сходен с механизмом действия надпочечниковых и половых стероидов тем, что в нем участвует связывание дигидроксилированного витамина с цитозольными рецепторными белками. Витаминорецепторный комплекс затем транслоцируется в ядро, в котором он стимулирует синтез РНК и в результате синтез связывающих и/или транспортирующих кальций белков. Современные данные убедительно свидетельствуют о том, что 1,25(OH)2D является конечной активной формой витамина и что она представляет собой конечный продукт последовательных реакций гидроксилирования. Через несколько часов после введения животным меченого 1,25 (ОН)2D, когда уже отчетливо виден транспорт кальция в кишечнике и скелете, большую часть меченого вещества удается обнаружить в неизмененном виде; это свидетельствует о том, что для проявления биологической активности дальнейший метаболизм не требуется. Некоторые исследователи, однако, в экстрактах кишечника идентифицировали небольшие количества трижды гидроксилированного метаболита — 1,24,25-триоксивитамина D, — причем кишечник содержит, по-видимому, и фермент, способный гидроксилировать 1,25 (ОН)2D в 24-м положении. Таким образом, возможно, хотя и не доказано, что определенная часть биологической активности 1,25(OH)2D в кишечнике обусловлена его гидроксилированием в 1,24,25 (ОН)2D. Помимо уже описанных реакций гидроксилирования, в почках и, вероятно, в других тканях присутствуют активности, гидроксилирующие 25-OHD в 24-м положении, что приводит к образованию 24,25 (ОН)2D. Биологические эффекты этого особого дважды гидроксилированного метаболита выяснены неполностью. По крайней мере, одна из его функций могла бы заключаться в ингибировании секреции паратиреоидного гормона (см. далее).
Биосинтетический путь образования биологически активного витамина D через последовательные реакции гидроксилирования отличается от пути образования стероидных гормонов надпочечников по крайней мере одним интересным аспектом. Все ферментативные стадии, необходимые для гидроксилирования и синтеза стероидных гормонов надпочечников, происходят в одном и том же органе — коре надпочечников, и в одной и той же клетке коры, хотя и в разных субклеточных органеллах. В отличие от этого, различные этапы гидроксилирования на пути синтеза ди- и тригидроксилированных метаболитов витамина D происходят по крайней мере в трех разных органах (кожа, печень и почки), что делает необходимым существование высоко избиратель-

ных процессов захвата, ферментативной модификации и выделения метаболитов, равно как и транспорта промежуточных метаболитов из органа в орган через кровоток. Факт столь разительного отличия путей биосинтеза, происходящего в ходе последовательного гидроксилирования этих двух видов стероидных гормонов безусловно интересен. Хотя причины таких различий не известны, можно было бы предположить, что они связаны с эволюцией механизма, обеспечивающего существование множества пунктов, в которых происходит регуляция образования активной формы витамина D.
РЕГУЛЯЦИЯ
Главная регулируемая стадия биосинтеза витамина D локализуется на уровне
превращения 25-OHD в 1,25 (ОН)2D под влиянием 1 -гидроксилазы 25-OHD в почках. Биосинтез витамина может в какой-то степени регулироваться и на уровне 25гидроксилирования в печени, а также на уровне превращения провитамина D в витамин D в коже, но общее значение этих регуляторных этапов не выяснено.
Рис. 3—22. Схематическое изображение предполагаемых пунктов регуляции в процессе метаболизма витамина D.
1 — 25-гидроксилирование в печени; 2 — 1-гидроксилирование в почках: паратиреоидный гормон стимулирует, а гиперфосфатемия подавляет превращение 25-оксивигамина D3 в 1,25-диоксивитамина D3: 3 — действие 1,25-диоксивитамина D3 на цитозольные рецепторы в кишечнике и кости — главных органах-мишенях
(НаЬег J.F., Mahaffey J.E., Ann. Rev. Med., 1978, 29, 327).
С физиологической точки зрения важно, что активность почечной 1 - гидроксилазы 25-OHD находится в обратной зависимости от уровня ионизированного кальция во внеклеточной жидкости. Так, снижение уровня ионизированного кальция в плазме приводит к усилению образования 1,25 (ОН)2D из его предшественника 25-OHD и, наоборот, повышение уровня кальция подавляет образование дигидроксилированного метаболита. В первом случае всасывание кальция в кишечнике и резорбция его из скелета стимулируются, тогда как во втором случае эти процессы тормозятся и, таким образом, происходит обратный сдвиг уровня кальция во внеклеточной жидкости в
направлении его нормализации. Однако кальций, вероятно, изменяет активность 1 - гидроксилазы не непосредственно. Он осуществляет свое влияние опосредованно путем регуляции высвобождения паратиреоидного гормона в кровь, а паратиреоидный гормон уже действует на почки, регулируя степень гидроксилирования в 1-м положении (рис. 3—22). По-видимому, это действие паратиреоидного гормона на процесс 1- гидроксилирования также не прямое, а опосредуется влиянием гормона на трансмембранные потоки фосфатного иона в клетках почечных канальцев. Активность laгидроксилазы, очевидно, непосредственно зависит от окружающей концентрации фосфатного иона; гипофосфатемия стимулирует, а гиперфосфатемия угнетает образование
1, 25(OH)2D.
Помимо фосфатных ионов, оказывающих сильное влияние на. скорость образования 1,25 (ОН)2D, другие факторы могут регулировать или модулировать активность
