
6 курс / Эндокринология / Эндокринология_и_метаболизм_Фелиг_Ф_,_Бакстер_Дж_Д_,_Бродус_А_Е
.pdf
гуляторного участка активным нуклеотидом вместо обычно транзиторного эффекта связывания ГТФ [32]. Этот механизм лежит и в основе выраженного действия холерного токсина на активность аденилатциклазы с «фиксированием» фермента в постоянно активном состоянии. Указанный феномен зависит от присутствия ГТФ и обусловливается ингибированием токсинов гормонзависимой ГТФазной активности [33]. Этот эффект холерного токсина реализуется через стимуляцию переноса АДФ-рибозы (от НАД) на ассоциированный с аденилатциклазой ГТФ-связывающий белок [34], что приводит к угнетению активности ГТФазы.
Все эти данные позволяют считать, что активность аденилатциклазы «включается» возникающим под действием гормона связыванием ГТФ в присутствии АТФ как субстрата и «выключается» путем гидролиза ГТФ в регуляторном участке [33] (рис. 4— 11). «Выключение» реакции блокируется нефизиологическими агентами, такими, как Gpp (NH) p и холерный токсин, а также может служить способом регуляции активности аденилатциклазы другими внутриклеточными сигналами.
Дальнейшие указания на значение регуляторного участка были получены при попытках реконструкции гормончувствительной активности аденилатциклазы путем слияния клеток или добавления растворимых клеточных экстрактов к комплементарным мембранам. В опытах по слиянию клеток гетерокарионы, образуемые из характерных
для эритролейкемии клеток крови (лишенных -рецепторов) и эритроцитов индюшки (с инактивированной аденилатциклазой), обнаруживали катехоламинчувствительную циклазную активность, отсутствовавшую в донорских клетках [35]. Подобно этому, рецепторы ЛГ, содержащиеся в богатых липидами экстрактах яичников, были перенесены в клетки сетчатой зоны коры надпочечников, в которой они опосредовали действие гонадотропинов на продукцию цАМФ и кортикостероидов [6]. В экспериментах по реконструкции солюбилизированная детергентом аденилатциклаза включалась в состав содержащих рецепторы мембран мутантных клеток, дефицитных по аденилатциклазе, с восстановлением стимулируемой катехоламинами активности фермента [36]. Подобно упомянутым результатам исследований со слиянием клеток эти данные подчеркивают пространственную независимость гормональных рецепторов и аденилатциклазы и свидетельствуют о способности рецепторов к движению в латеральном направлении и взаимодействию с нуклеотидрегуляторной единицей аденилатциклазы в клеточной мембране. Такие данные свидетельствуют о том, что между гормональными рецепторами и компонентами аденилатциклазной системы существует общий сопрягающий механизм, проявляющийся при взаимодействии гетеротопных рецепторов и аденилатциклазы клет- ки-хозяина. Это могло бы указывать на существование области конформационного сходства у всех рецепторов пептидных гормонов при сохранении уникальности их областей, ответственных за специфическое связывание гормонов [36]. Выяснению вопроса о том, действительно ли рецепторы пептидных гормонов обладают общим доменом, определяющим возможность взаимодействия с регуляторными компонентами эффекторных мембранных ферментов, должен был бы способствовать более подробный структурный анализ этих рецепторов.
Рис. 4—11. Роль циклических нуклеотидов в гормональной регуляции аденилатциклазы. Гормонрецепторное взаимодействие приводит к связыванию ГТФ регуляторным участком и активации аденилатциклазы. Гидролиз ГТФ до ГДФ, локализованной в этом участке ГТФфазой, восстанавливает неактивную форму фермента. Токсин холерного вибриона (ТХВ) необратимо инактивирует фермент, блокируй активность ГТФазы. Связывание
регуляторным участком негидролизуемых аналогов ГТФ, таких, как Gpp (NH) P, также вызывает длительную активацию фермента (Cassel и соавт. [33] в модификации). Фн — фосфор неорганический.
Результаты опытов по реконструкции, проведенные на мутантных клетках, об-
ладающих -адренергическими рецепторами и аденилатциклазой, которая, хотя и присутствовала, но была «разобщена» (т. е. не реагировала на катехоламины), показали восстановление стимулируемой катехоламинами активности при добавлении экстрактов клеток дикого типа. Это свидетельствует о том, что сопрягающий фактор (возможно, нормальная нуклеотидрегуляторная единица), включающийся в мембрану мутантной клетки, замещает предположительно дефектный у таких мутантов регуляторный участок [36].
Помимо участия в активации аденилатциклазы, гуаниловые нуклеотиды часто влияют и на кинетику связывания и сродство гормонрецепторного взаимодействия. Анализ солюбилизированных мембранных систем и раздельных эффектов гуаниловых нуклеотидов на связывание гормона и активацию циклазы указывает на структурную и функциональную обособленность участков, влияющих на конформацию рецептора и ферментативную активность [32]. Разделенность «рецепторной» и «каталитической» единицы регуляторного белка надежно доказывается результатами этих и более ранних исследований, но вопрос о механизме взаимодействия компонентов реакции остается нерешенным. Важным аспектом влияния ГТФ на сродство рецепторов к лиганду является способность нуклеотида снижать «прочность» связывания гормона почти с необратимой ассоциации до состояния (в некоторых случаях) с гораздо меньшим сродством. Это наблюдалось в отношении рецепторов глюкагона, а также в отношении связывания
лигандов-агонистов с -адренергическими рецепторами. В отличие от этого, гуани-
ловые нуклеотиды не изменяли связывание -антагонистов, что указывает на роль сопряжения с аденилатциклазой в способности нуклеотидов повышать диссоциацию связанного с рецептором агониста [20]. Хотя данные, полученные при исследовании глюкагоновой системы, свидетельствуют в пользу существования обособленных мест действия нуклеотидов на регуляцию рецепторного связывания и активность аденилатциклазы, однако роль этих мест в гормональной активации и рецепторферментном сопряжении все еще остается не выясненной. Состояние низкого сродства рецептора, вызываемое ГТФ, рассматривается как благоприятное предшествующее состояние процесса трансмембранного сопряжения, а разобщенная форма рецептора, обладающая высоким сродством, могла бы отражать неактивное состояние фермента. Последнее могло бы иметь отношение к «десенситизации» аденилатциклазы повышенными концентрациями гормона [20].
Роль фосфорилирования в эффектах цАМФ: протеинкиназы
Вслед за открытием цАМФ и анализом его роли в опосредовании эффектов глюкагона и адреналина на гликолиз было выяснено, что циклический нуклеотид принимает участие в регуляции разнообразных метаболических функций. Свидетельством тому служит глобальное присутствие цАМФ у прокариот и эукариот и его участие в реакциях, связанных не только с действием гормонов [4]. Было установлено, что способность цАМФ активировать фосфорилазкиназу в печеночных клетках является общим свойством эукариотических клеток, в которых все эффекты цАМФ реализуются через фосфорилирование белковых субстратов. Подобно цАМФ в эукариотических клетках присутствует фермент, называемый цАМФ-зависимой протеинкиназой, который опосредует эффекты цАМФ на клеточный метаболизм [37]. У прокариот эффекты цАМФ реализуются через другой механизм — взаимодействие цАМФ-связывающих белков с регуляторными участками генома.
В животных тканях цАМФ-зависимая протеинкиназа катализирует фосфорилирование многих белковых субстратов, перенося фосфат с АТФ на специфические сериновые (и иногда треониновые) остатки. По данному месту фосфорилируется ряд известных белковых субстратов, в том числе ферменты, такие, как фосфорилазкиназа, гликогенсинтетаза и гормончувствительная липаза, и неферментные клеточные белки, такие, как гистоны, ядерные негистоновые, рибосомные белки, белки микротрубочек и мембран [38]. Большинство субстратов, обладающих ферментативной активностью, существует либо в фосфо-, либо в дефосфоформах, взаимопревращение которых из активного в неактивное состояние происходит в результате согласованного действия

протеинфосфокиназы и фосфопротеинфосфатазы. Протеинфосфокиназы, в том числе
цАМФ-зависимая протеинкиназа, переносят -фосфатную группу с АТФ на белковые субстраты, тогда как фосфопротеинфосфатазы катализируют гидролиз фосфопротеинов, отщепляя от них фосфатные группы. Этот цикл фосфорилирование—дефосфорилирование считается в настоящее время повсеместно распространенным механизмом регуляции метаболизма, причем применительно не только к ферментам, но и к сократительным реакциям, мембранным активностям и ядерным процессам. На функциональном уровне такие эффекты проявляются физиологическими процессами мышечного сокращения, секреции и деятельности нейронов.
Открытие Greengard того факта, что все животные клетки содержат цАМФзависимую протеинкиназу, привело к созданию концепции, согласно которой разнообразные эффекты цАМФ реализуются через этот единственный класс ферментов [39]. С этой точки зрения, специфичность опосредуемых цАМФ реакций определяется характером протеинкиназы и особенно характером белковых субстратов, присутствующих в клетках данного типа. Считается, что каждый белковый субстрат контролирует специфический метаболический или физиологический процесс, скорость которого увеличивается или уменьшается при фосфорилировании регуляторного белка. Способ, с помощью которого фосфорилирование белка опосредует биологические эффекты гормонов и трансмиттеров, действующих через цАМФ, представлен на рис. 4—12.
Следовало бы полагать, что для катализа фосфорилирования отдельных белковых субстратов при опосредовании многочисленных эффектов цАМФ должно существовать множество протеинкиназ. Однако в животных клетках идентифицировано лишь небольшое число основных форм этого фермента; поэтому специфичность каждой реакции фосфорилирования должна определяться локализацией и характером белкового субстрата. Протеинкиназы широко различаются по своей зависимости или независимости от циклических нуклеотидов (табл. 4—2).
Рис. 4—12. Общая схема действия пептидного гормона через аденилатциклазный и протеинкиназный метаболический путь, предполагающая контроль регуляторных белков с помощью фосфорилирования и дефосфорилирования (Greengard [37] в модификации).
Таблица 4—2. Классификация протеинкиназ
1.Ферменты, зависимые и не зависимые от циклических нуклеотидов
2.цАМФ- и цГМФ-зависимые ферменты
3.цАМФ-зависимые ферменты I и II типов
Протеинкиназы, не зависимые от циклических нуклеотидов, присутствуют во всех областях клетки и регулируются, по-видимому, другими внутриклеточными сигналами. Недавно обнаруженный класс протеинкиназ для своей активности требует присутствия липидных компонентов мембраны и кальция; ферменты этого класса могут быть частью трансмембранных контролирующих систем, регулируемых кальцием. Большинство контролируемых гормонами протеинкиназ клеток-мишеней зависит от цАМФ или
(реже) от цГМФ. Такие зависимые от циклических нуклеотидов протеинкиназы сосредоточены в цитозоле, по встречаются также в плазматических мембранах и в других клеточных органеллах. Они активируются микромолярными концентрациями циклических пуриновых нуклеотидов (цАМФ и цГМФ) и быстро стимулируются при повышении продукции циклических нуклеотидов в результате действия гормона на клеточную мембрану. Оба типа зависимых от циклических нуклеотидов протеинкиназ активируются при связывании нуклеотида специальным участком фермента. цАМФ-зависимая протеинкиназа в неактивной форме представляет собой тетрамер, состоящий из субъединиц двух типов: для связывания цАМФ и для катализа переноса фосфата. Неактивный тетрамер состоит из двух связывающих, или регуляторных (Р), субъединиц и двух ферментных, или каталитических (К), субъединиц. При связывании цАМФ с Р2-субъединицами тетрамер Р2К2 диссоциирует, высвобождая активные каталитические субъединицы, обладающие фосфотрансферазной активностью [38]. Эту реакцию можно представить следующим образом:
Р2К2 (неактивная) + 4цАМФ Р2•цАМФ4 + 2К (активная).
После своего образования свободная К-субъединица обнаруживает функциональное сходство с цАМФ-независимыми протеинкиназами, но ее можно отличить по характерному размеру (молекулярная масса 38000) и реакции на термостабильный ингибиторный белок, который блокирует ее каталитическую активность и предотвращает рекомбинацию с регуляторной субъединицей. Каталитические субъединицы, по всей вероятности, едины во всех формах цАМФ-зависимых протеинкиназ, тогда как регуляторные субъединицы обнаруживают индивидуальные особенности. Считается, что регуляторные субъединицы, высвобождающиеся при диссоциации протеинкиназы, остаются в виде Р2-димера и позднее подвергаются повторной ассоциации со свободными каталитическими субъединицами, в результате чего восстанавливается неактивный голофермент. В отсутствии цАМФ регуляторные и каталитические субъединицы связаны друг с другом с высоким сродством и в физиологических условиях присутствуют преимущественно в виде неактивного голофермента [40]. цГМФ-зависимые протеинкиназы вначале были обнаружены у беспозвоночных, но позднее их нашли и в тканях млекопитающих, где они функционируют иным образом, чем цАМФ-зависимый фермент. Их сродство к цАМФ гораздо ниже, чем к цГМФ, а ферментативная активность обычно также уступает таковой цАМФ-зависимого фермента. Активация осуществляется путем связывания цГМФ регуляторным участком фермента, причем считают, что подобно цАМФ-зависимой протеинкиназе этот фермент также диссоциирует с высвобождением активной каталитической единицы. Недавно была установлена гомология между двумя формами зависимых от циклических нуклеотидов ферментов, что привело к мысли об их общем эволюционном происхождении из примитивной фосфотрансферазы [41].
Растворимые формы цАМФ-зависимой протеинкиназы из тканей млекопитающих с помощью ионообменной хроматографии удается разделить на два главных типа (табл.
4—3).
Протеинкиназа I типа имеет менее кислый оптимум, быстро диссоциирует под влиянием субстрата (гистонов) или высокой концентрации соли (0,5 М NaCl) и медленно реассоциирует после вызванной цАМФ диссоциации. Фермент II типа имеет более кислый оптимум и медленнее диссоциирует под действием гистонов и соли, но быстро реассоциирует, образуя неактивный олигомер. В большинстве тканей присутствуют обе формы протеинкиназ, но их соотношение в клетках разного типа варьирует. Так, в скелетной мышце кролика преобладает фермент I типа, а в сердечной мышце крупного рогатого скота—фермент II типа. Оба голофермента обычно сходны по составу и молекулярной массе субъдиниц: каждая связывает по две молекулы цАМФ, а их каталитические субъединицы, по всей вероятности, идентичны. Различия касаются молекулярной массы и функции регуляторных субъединиц, причем главное различие заключается в том, что фермент I типа связывает Mg-АТФ, тогда как фермент II типа катализирует фосфорилирование своей собственной регуляторной субъединицы за счет АТФ. Связывание АТФ ферментом I типа снижает его сродство к цАМФ и, повидимому, способствует сохранению неактивного состояния фермента. Субъединица I типа, хотя и связывает АТФ, не фосфорилируется каким бы то ни было ферментом, что отличается от «аутофосфорилирования», свойственного ферменту II типа [42].
Таблица 4—3. Свойства цАМФ-зависимой протеинкиназы

|
|
|
Тип I |
|
|
Тип II |
|
|
|
|
|
|
|
|
|
|
Тканевой источник |
|
Скелетная мышца кро- |
|
|
Сердечная мышца бы- |
|
|
|
|
лика Клетки Лейдига |
|
|
ка Сердечная мышца |
|
|
|
|
крысы |
|
|
свиньи Головной мозг |
|
|
|
|
|
|
|
быка |
|
|
|
|
|
|
|
||
|
Структура субъединиц |
|
Р2К2 |
|
|
P2K2 |
|
|
|
|
|
|
|
|
|
|
Молекулярная масса |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Голофермент |
165 000 |
174000 |
|
|||
|
|
|
|
|
|||
|
Р2 |
|
98000 |
|
98000 |
|
|
|
К |
38000 |
38000 |
|
|||
|
|
|
|
|
|
|
|
|
Элюция с ДЭАЭ- |
|
0,1 М NaCl |
|
|
0,2 М NaCl |
|
|
целлюлозы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Диссоциация под дейст- |
|
Быстрая |
|
|
Медленная |
|
|
вием соли и гистонов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реассоциация после уда- |
|
Медленная |
|
|
Быстрая |
|
|
ления цАМФ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Функциональное значение этих двух эффектов на Р-субъединицы не ясно, хотя фосфорилирование ферментов II типа могло бы представлять собой эволюционно более позднюю форму связывания субстрата (АТФ), характерного и для фермента I типа. Фосфорилирование протеинкиназы II типа сопровождается снижением скорости воссоединения диссоциированных Р- и К-субъединиц. Таким образом, фосфорилирование могло бы служить фактором контроля за активностью диссоциированного фермента и регулировать скорость восстановления его неактивной формы. Ускорение дефосфорилирования Р-субъединицы должно было бы способствовать рекомбинации голофермента Р2К2, приводящей к высвобождению и разрушению цАМФ. Таким способом могла бы осуществляться регуляция соотношения активного и неактивного ферментов в отсутствие изменений концентрации цАМФ. Другая возможность заключается в том, что ферменты II типа, участвующие в быстрых циклах метаболических процессов, что наблюдается в сердечной и нервной тканях, приобрели способность более тонко регулироваться (инактивироваться) эффектами этапа фосфорилирования: дефосфорилирование на регуляторную субъединицу по механизму ультракороткой обратной связи.
После установления роли цАМФ-зависимой протеинкиназы в фосфорилировании и активации фосфорилазы киназы было показано, что этот фермент фосфорилирует основные белки, в том числе гистоны, казеин и протамин, как и многие денатурированные белки (такие, как протеин яичного белка, лизоцим и бычий сывороточный альбумин), в своем нативном состоянии не являющиеся субстратами фосфорилирования. Небольшие основные пептиды также фосфорилируются этим ферментом, как и синтетические пептидные последовательности, сходные с участками фосфорилирования нативных и денатурированных белковых субстратов. Эти данные указывают на то, что реакция фосфорилирования, осуществляемая протеинкиназой, является не слишком специфичной в отношении аминокислотных последовательностей отдельных белков, но обладает сравнительно высокой специфичностью по отношению к остаткам серина, локализованным в определенных участках первичной аминокислотной последовательности многих белков. При анализе структур, необходимых для фосфорилирования, обнаружили, что пептидные субстраты протеинкиназы обладают двумя близко расположенными основными аминокислотами, одной из которых является аргинин, локализующийся через 2—5 остатков от фосфорилируемого серинового остатка на аминоконцевой стороне пептида [43].
В физиологически важных белковых субстратах цАМФ-зависимой протеинкиназы были определены две формы аминокислотной последовательности на участке фосфорилирования
В этих последовательностях на месте Х может стоять любая аминокислота, хотя остатки, располагающиеся в непосредственной близости к серину, обычно имеют гидрофобные боковые цепи. Участок фосфорилирования I типа, где основные амино-
кислоты отделены от серина двумя остатками, присутствует в -субъединице фосфорилазы киназы и в гликогенситетазе. Участок II типа ним промежуточным остатком) присутствует в пируваткиназе и регуляторной субъединице цАМФ-зависимой протеинкиназы II типа. Поскольку скорость фосфорилирования главным образом зависит от сравнительно часто встречающейся первичной последовательности на определенном участке пептидной цепи, специфичность отдельных белков как субстратов фосфорилирования должна определяться их вторичной и третичной (т. е. трехмерной) конформацией, которая может ограничивать присутствие потенциально фосфорилируемых участков для каталитической единицы фермента. Предполагаемая роль вторичной структуры в определении субстратной специфичности сводится к положению фосфорилируемого серина на гидрофильной поверхности белкового субстрата, в сформирован-
ных водородными связями складках -структуры, которая может быть «узнана» протеинкиназой [44].
Механизмы гликогенолиза и липолиза
Гормональная регуляция межуточного обмена и продукции энергии является одной из наиболее изученных областей действия пептидных гормонов. Общие аспекты гормональной регуляции гомеостаза глюкозы выяснены сравнительно полно, но клеточные механизмы оказались более сложными, чем считали ранее. В периоды голодания основным источником глюкозы крови служит печень, высвобождающая сахар со скоростью, зависящей от содержания глюкозы в крови и действия катаболических гормонов, таких, как глюкагон и катехоламины. В физиологических условиях главным ингибитором высвобождения глюкозы является инсулин, причем секретируясь после приема пищи, он противодействует эффектам катаболических гормонов. Глюкоза, высвобождаемая печенью при голодании, вначале продуцируется за счет гликогенолиза, но после истощения запасов гликогена в органе — за счет глюконеогенеза из лактата и аминокислот.
Исследования Rail и Sutherland по гликогенолизу в печени собак показали, что цАМФ, образуемый аденилатциклазой в ответ на действие глюкагона и адреналина, вызывает активацию гликогенфосфорилазы [45]. Эта реакция зависит от превращения фосфорилазы киназы из неактивной (дефосфо-) формы в активный фосфорилированный фермент, который затем катализирует превращение гликогенфосфорилазы b в активную фосфорилазу а в ходе последующего этапа фосфорилирования. Активная фосфорилаза разрушает гликоген до глюкозо-1-фосфата, превращающегося в глюкозо-6-фосфат, а затем в свободную глюкозу, высвобождаемую в кровь (рис. 4— 13). цАМФ-зависимый фермент, ответственный за активацию фосфорилазы киназы, названный вначале киназой фосфорилазкиназы, оказался широко распространенным в природе-и способным катализировать фосфорилирование многих белковых субстратов,
а |
не только фосфорилазу киназы. Это привело к мысли о том, что все эффекты цАМФ |
у |
высших организмов опосредуются реакциями фосфорилирования белков, осуществляе- |
мыми цАМФ-зависимой протеинкиназой, выступающей в роли внутриклеточного рецептора цАМФ [39].
Общая схема метаболизма гликогена в печени, приведенная на рис. 4—13, начинается с активации протеинкиназы катаболическими гормонами, вслед за чем происходит фосфорилирование фосфорилазкиназы и гликогенсинтетазы [46]. Фосфорилирование активирует киназу и инактивирует синтетазу, вызывая ускорение фосфоролитического расщепления гликогена и снижение его синтеза из. УДФ-глюкозы. Протеинкиназа опосредует влияние цАМФ на распад гликогена и в скелетной мышце, обеспечивая ткань глюкозо-1-фосфатом для гликолиза. В печени, помимо стимуляции распада гликогена до глюкозы и угнетения синтеза гликогена, цАМФ стимулирует также глюконеогенез из таких предшественников, как аланин, лактат и пируват.
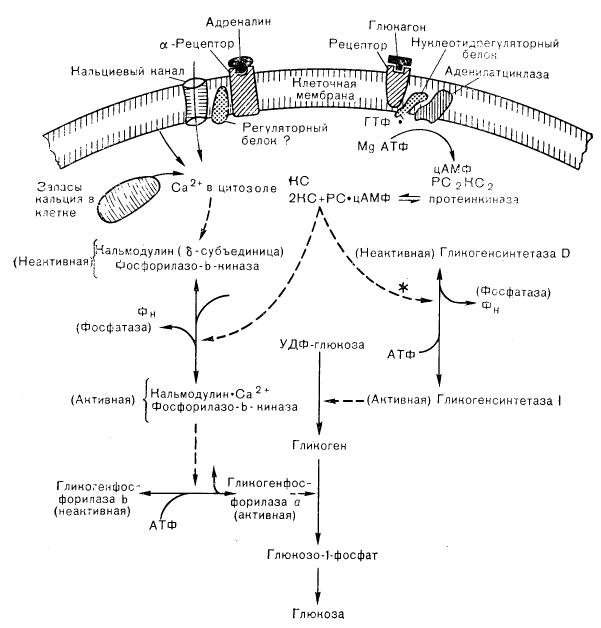
Рис. 4—13. Регуляция печеночного гликогенолиза гормонами, действующими через цАМФ-зависимую протеинкиназу и кальцийзависимые процессы. Каталитическая субъединица (КС); отделяющаяся под действием цАМФ от голофермента протеинкиназы, фосфорилирует и активирует гликогенфосфорилазу (через фосфорилазу киназы) и обусловливает фосфорилирование и инактивацию гликогенсинтетазы (вероятно, через тот же фермент), что приводит к распаду гликогена и увеличению продукции глюкозы. Повышение содержания кальция в цитозоле, обусловленное поглощением или мобилизацией кальциевых запасов, действует как фактор, опосредующий влияние -агонистов (а также вазопрессина и ангиотензина II) на активацию фосфорилазкиназы, путем связывания с кальмодулином — -субъединицей фосфорилазо-b-киназы. PC — регуляторная субъединица; Фн — фосфор неорганический.
Хотя главным регулятором быстрого высвобождения глюкозы из печени считается глюкагон, но катехоламины также, по-видимому, играют важную роль в этом процессе у некоторых видов животных и человека. Первоначально считали, что действие как глюкагона, так и катехоламинов на активацию фосфорилазы опосредуется цАМФ; кальцию отводили дополнительную роль в стимуляции фосфорилазкиназы. Что касается глюкагона, то до сих пор еще полагают, что его влияние на печеночный гликогенолиз (и глюконеогенез) зависит от цАМФ, действующего, вероятно, в концентрациях, гораздо более низких, чем те, которые создаются при экспериментальной стимуляции печеночных клеток глюкагоном. Однако в отношении катехоламинов современные данные свидетельствуют о том, что в отличие от действия глюкагона стрессорные гор-

моны, такие, как катехоламины, вазопрессин и ангиотензин II, стимулируют гликогенолиз и глюконеогенез не через цАМФ, а с помощью других механизмов. Хотя адре-
налин активирует аденилатциклазу через печеночные -адренергические рецепторы, повышая образование цАМФ, в настоящее время считают что влияние катехоламинов
на печеночный гликогенолиз опосредуется главным образом -адренергическими ре-
цепторами и не зависит от цАМФ. Вместо этого -адренергическая активация фосфорилазы зависит, по-видимому, от ионов кальция [47].
Вазопрессин и ангиотензин II также стимулируют печеночную фосфорилазу с помощью цАМФ-независимого механизма, в котором важную роль играет «кальциевый статус» гепатоцита, опосредующий действие всех трех стрессорных гормонов. Считают, что эти пептиды активируют печеночную фосфорилазу путем мобилизации внутриклеточных запасов кальция (что приводит к повышению его концентрации в цитозоле) и далее к стимуляции фосфорилазо-b-киназы [48]. Роль внутриклеточных источников кальция, мобилизуемого при действии гормонов, приписывают митохондриям, микросомам и плазматической мембране; в последней это является результатом ускоренного кругооборота фосфатидилинозитола. Современные данные свидетельствуют в пользу митохондриального кальциевого пула как источника, из которого катехоламины (а также вазопрессин и ангиотензин II) черпают кальций, поступающий в цитоплазму и внеклеточную жидкость. Это означает, что второй медиатор, образуемый гормонрецепторным взаимодействием в плазматической мембране, приводит к мобилизации внутриклеточных кальциевых запасов, увеличивая результирующий выход кальция из
митохондрий [47]. При -адренергической стимуляции печеночных клеток наблюдали и повышение уровня пГМФ, но это, вероятно, отражает изменения концентрации свободного внутриклеточного кальция и последующую активацию гуанилатциклазы. Функциональное значение эффектов гормонов этой группы на печень может заключаться в их связи с острым стрессом, поскольку они индуцируют печеночный гликогенолиз в таких концентрациях, которые присутствуют в крови лишь при шоке и обезвоживании
[49].
Рис. 4—14. Регуляция липолиза цАМФ-зависимой протеинкиназой. Активация гормончувствительной липазы путем фосфорилирования приводит к ускорению распада триглицеридов с образованием глицерина и свободных жирных кислот (по данным Steinberg и соавт. [5] в модификации). КС — каталитическая субъединица; PC — регуляторная субъединица. Фн — фосфор неорганический.
Помимо действия на гликолиз, обеспечивающего присутствие глюкозы как источника энергии, цАМФ играет также важнейшую роль в мобилизации свободных жирных кислот из жировой ткани. Это обусловливается фосфорилированием и активацией гормончувствительной липазы, которая регулирует скорость-ограничивающий этап гидролиза эфирных связей в процессе распада триглицеридов (рис. 4—14). Быстро действующие гормоны, в том числе глюкагон, адреналин и АКТГ, повышают активность гормончувствительной липазы путем фосфорилирования, которое определяется цАМФ-за- висимой протеинкиназой. Поскольку жировая ткань содержит также фосфорилазу и
гликогенсинтетазу, то присутствие трех ферментных систем, контролируемых цАМФзависимой протеинкиназой, повышает необходимость существования «пост-цАМФ овых» механизмов, которые регулировали бы и интегрировали отдельные ферментативные процессы, «запускаемые» протеинкиназой [50].
Насколько общей является роль фосфорилирования в эффектах цАМФ?
Тот факт, что многие гормоны повышают содержание цАМФ в своих клеткахмишенях и что в большинстве клеток млекопитающих присутствуют близкие уровни цАМФ-зависимой протеинкиназы, привел к представлению о том, что эффекты цАМФ в эукариотических тканях реализуются путем фосфорилирования регуляторных белков. Этот механизм действия радикально отличается от того, который функционирует у прокариот, у которых цАМФ действует с помощью стероидоподобного механизма, заключающегося в том, что цАМФ-связывающий белок, регулирует транскрипцию генов после связывания с бактериальной ДНК [54]. Как уже отмечалось, можно полагать, что бактериальный цАМФ-связывающий белок и регуляторная цАМФ-связывающая субъединица образовались в процессе эволюции из примитивной глюкотрансферазной системы. У эукариотических организмов связывание цАМФ с высоким сродством полностью ограничено только регуляторной субъединицей протеинкиназы, которая действует в функциональном соответствии с аденилатциклазой, реализуя эффекты различных гормонов. Поскольку число отдельных цАМФ-зависимых протеинкиназ ограничено двумя или тремя основными типами, то, как уже отмечалось, функциональное разнообразие гормональных эффектов должно зависеть от специфичности ферментов и присутствия специфических субстратов или специфических участков белковых субстратов.
Хотя в некоторых тканях млекопитающих были идентифицированы и другие цАМФсвязывающие белки, они не обнаруживали свойственных регуляторной субъединице протеинкиназы высокого сродства и специфичности связывания. цАМФ в качестве субстрата связывается и с фосфодиэстеразами, присутствующими в большинстве клеток, но опять-таки эта связь не имеет той высокой специфичности и сродства, которые характерны для связи цАМФ с регуляторной субъединицей протеинкиназы. Таким образом, современная точка зрения, согласно которой цАМФ действует только через протеинкиназу, по всей вероятности, соответствует действительности; это относится и к представлению о том, что в действии цАМФ всегда участвует фосфорилирование. Рассматривалась и возможность миграции комплекса цАМФ-Р в ядро и другие клеточные участки с развитием в них регуляторных эффектов,, но чаще предполагается транслокация в ядра голофермента или свободной каталитической субъединицы. Некоторые данные о перемещении связывающих или ферментных субъединиц между цитоплазмой и фракциями клеточных частиц наверняка могли зависеть от условий эксперимента, но другие, по-видимому, отражают истинную транслокацию фосфокиназной активности в ядро. Поскольку большинство эффектов белковых гормонов не зависит от изменения синтеза РНК и белка, вряд ли можно думать, что ядерные влияния цАМФ являются компонентом быстрых регуляторных действий циклического нуклеотида. Хотя цАМФ-зависимая протеинкиназа может играть роль в фосфорилировании ядерных белков [52] и регуляции транскрипции и синтеза РНК, значение этих эффектов протеинкиназы в качестве механизма, с помощью которого цАМФ мог бы регулировать функцию клеток-мишеней, нуждается в дальнейшей оценке.
Гормоны, использующие цАМФ в качестве второго медиатора
Хотя известно, что многие пептидные гормоны действуют путем опосредованной рецептором активации аденилатциклазы и образования цАМФ, в других случаях невозможно продемонстрировать роль цАМФ в механизме действия пептидов. К предполагаемым внутриклеточным медиаторам действия пептидных гормонов относятся кальций, цГМФ, калий, простагландины и изменения мембранного потенциала и внутриклеточного окислительно-восстановительного потенциала. На самом деле, существует мало надежных доказательств роли большинства из этих факторов в действии пептидных гормонов, хотя на кальций как на главный внутриклеточный регулятор в стимулированных гормонами клетках указывают достаточно многочисленные косвенные данные. Изменение концентрации ионов во внутриклеточных пространствах измерить очень трудно, что создает проблемы при попытке приписать кальциевым и калиевым сигна-
лам специфические эффекторные свойства при действии гормонов. В отличие от этого уровень индуцированного гормоном цАМФ может быть относительно велик по сравнению с базальным внутриклеточным содержанием нуклеотида, причем при стимуляции кле- ток-мишеией пептидными гормонами значительные количества цАМФ часто высвобождаются во внеклеточную жидкость. Внеклеточный цАМФ у низших организмов (например, слизистая плесень) играет биологическую роль, но у высших животных за ним не признают значения межклеточного медиатора. В тканях млекопитающих внеклеточные уровни цАМФ повышаются только при чрезмерной гормональной стимуляции, что наблюдают в почках при инфузии или гиперсекреции паратиреоидного гормона.
Как правило, однако, изменения уровня цАМФ, вызываемые физиологическими концентрациями пептидных гормонов, весьма малы, что иногда создает впечатление расхождений между реакциями клеток-мишеней и степенью продукции цАМФ. Такие кажущиеся противоречия были объяснены с помощью тщательных измерений уровня цАМФ в отдельных клеточных пространствах (например, связанного с регуляторной субъединицей протеинкиназы). Такой подход обнаружил корреляцию между уровнями Р-цАМФ и реакциями стероидогенеза в семенниках, яичниках и надпочечниках, возникающими при действии соответствующих тропных гормонов [6]. Вместе с тем применение аналогичных подходов к анализу действия других пептидных гормонов, таких, как ангиотензин II и ГнРГ, выявило отсутствие корреляции между реакциями цАМФ и других клеточных процессов (например, секреции альдостерона и высвобождения ЛГ) на гормон, что указывает, вероятно, на большую роль других факторов (таких, как кальций) в качестве второго медиатора действия этих лигандов. Значение кальция как внутриклеточного регулятора гормонального эффекта подробнее описывается в следующем разделе.
Пептидные гормоны с указанием роли цАМФ в опосредовании их действия перечислены в табл. 4—1. Некоторые пептиды и белки можно считать наверняка зависимыми от роли цАМФ в качестве второго медиатора (АКТГ, ЛГ, ФСГ, ТТГ, глюкагон), тогда как другие (ангиотензин II, ГнРГ) в большей степени зависят, вероятно от кальция, а третьи определенно не опосредуют свое действие циклическим нуклеотидом (СТГ, пролактин, инсулин и другие факторы роста). Даже в тех случаях, когда действие пептидного гормона на конкретную клеточную реакцию можно отнести за счет цАМФ как второго медиатора, это не исключает существования других эффектов (например, на клеточный рост и сохранение дифференцированных функций), которые могут опосредоваться и не циклическими нуклеотидами.
КАЛЬЦИЙ
Значение кальция как активатора клеточных функций было выяснено почти 100 лет назад, когда Ringer показал его роль в сократимости сердечной мышцы лягушки. Помимо участия кальция в мышечном сокращении и нейромышечной передаче, было установлено, что он играет существенную роль в секреторных процессах, а также участвует в более общих механизмах внутриклеточной регуляции [53]. Функция кальция в качестве внутриклеточного медиатора постулируется гипотезой сопряжения стимула и секреции, которая исходит из того, что ионы кальция служат первичным соединительным звеном между стимулом и секрецией [54]. Позднее выяснилось значение кооперативных взаимодействий между кальцием и циклическими нуклеотидами при действии гормонов [29]. В настоящее время кальций и циклические нуклеотиды считаются главными компонентами внутриклеточной сигнальной системы, которая регулирует активность клеток в ответ на внешние стимулы [29, 30]. Каждый из этих медиаторов совершает быстрый кругооборот, так что их внутриклеточная концентрация отражает динамическое равновесие между возникновением и исчезновением сигнала. Этот динамический баланс и быстрый кругооборот молекул медиатора обусловливает возможность быстрого реагирования на прекращение стимула. Повышение внутриклеточного содержания «вторых медиаторов» при действии гормонов обычно обусловливается ускорением их образования, что наблюдается при стимуляции аденилатциклазы или притоке кальция. В некоторых случаях, однако, изменение уровня сигнала определяется снижением скорости его исчезновения, что происходит при изменении уровня цАМФ вследствие изменения активности фосфодиэстеразы. В этом отношении взаимодействия, существующие между кальцием и генерацией и метаболизмом циклических нуклеотидов, весьма важны, поскольку ферменты, контролирующие как синтез, так и разрушение цАМФ и цГМФ, регулируются зависимыми от кальция механизмами обратной
