
3 курс / Фармакология / Интеллектуальные_липидные_наноконтейнеры_в_адресной_доставке_лекарственных
.pdf
159
апоптоза [1190]. Эти агенты вызывали ингибирование сигнальных путей протеин киназы MAPK (mitogen-activated protein kinase), но активировали протеинкиназу стресса SAPK [1191]. Кроме того, они ингибируют регуляторный путь клеточного выживания: фосфатидилинозитол-3-киназа – Akt/PBK и синтез некоторых фосфолипидов [1192,1193]. Было также обнаружено [1194], что апоптоз клеток различных форм рака под действием АРС сопровождается активацией каспазы-8 и -3, и расщеплением суб-
станций клеточной гибели, таких как PARP (poly-ADP-ribose polymerase).
Среди различных форм АРС наибольшее клиническое значение имеет гексадецилфосфохолин (НеРС, Рис.21), известный в медицине, как милтефозин – эффективное средство против паразитарных заболеваний, например лейшманиоза [1195], допущенное для клинического использования в лечении некоторых форм рака [1196], а также перспективное при лечении ВИЧ инфекции [1197], поскольку инициирует апоптоз инфицированных макрофагов, препятствуя размножению ВИЧ [1198]. Липосомы, содержащие НеРС и загруженные доксорубицином, обладают выраженным антиопухолевым действием [1199,1200].
Рис.21. Некоторые фосфолипиды, используемые при создании термочувствительных липосом.
Недавно было показано, что липосомы, содержащие НеРС обладают термочувствительностью подобно липосомам, содержащим лизофосфатидилхолин, упомянутым ранее, что позволяет усиливать антиопухолевый эффект НеРС, действием доксорубицина, который высвобождается из липосом при повышении температуры опухоли [1187].

160
4.4.2. Термочувствительные полимеры
В последние годы большие успехи достигнуты в создании различных термочувствительных полимеров. Некоторые из них могут быть использованы для создания термочувствительных липосом или мицелл. Принцип действия термочувствительных полимеров основан на тонком балансе гидрофобных и гидрофильных сил. Нарушение этого баланса в области критической температуры приводят к тому, что полимерная цепочка набухает или, наоборот, сжимается (коллапсирует). Коллапс (конденсация) происходит в случае увеличения гидрофобности блоков. При этом цепочки различной архитектуры могут образовывать мицеллы, в которых гидрофобные блоки формируют ядро, окруженное оболочкой из гидрофильных цепей (Рис.22). В присутствии липидов, способных образовывать липосомы, гидрофобные блоки полимера могут встраиваться в бислой путем интеркаляции между молекулами липидов. Эти изменения обратимы и при возврате температуры к исходному значению растворимость полимера возрастает, что приводит к разрушению мицелл или нарушению целостности липосом.
Рис.22. В термочувствительных полимерах гидрофобные блоки могут ответвляться от длинной гидрофильной цепи – графтсополимеры, архитектура расчески – comblike (а), или блоки могут располагаться последовательно – блок сополимеры, архитектура последовательного соединения (б). Оба типа сополимеров способны образовывать мицеллы, имеющие гидрофобное ядро, где могут находится жирорастворимые лекарства, и гидрофильную оболочку, которую иногда называют короной. Гидрофобные блоки полимеров способны также интеркалировать в липидный бислой липосом. Изменение температуры может приводить к изменению гидрофобности блоков. Это, в зависимости от полимера, вызывает его набухание или конденсацию, что приводит к разрушению липосом или мицелл и высвобождению лекарственных веществ (обозначено черными точками).

161
Растворение и конденсацию полимеров можно рассматривать как процесс фазового перехода. Системы, образующие растворимую фазу выше некоторой температуры, но испытывающие фазовое разделение ниже этой температуры, обладают верхней критической температурой растворения (ВКТР). Напротив, системы, испытывающие фазовое разделение выше некоторой температуры, обладают нижней критической температурой растворения (НКТР) [1201].
Одним из наиболее исследованных термочувствительных полимеров, используемых для доставки лекарственных веществ, является полиизо-
пропилакриламид, PNIPAAm – poly(N-isopropylacrylamide), который об-
ладает удобной для медицинского использования НКТР, находящейся в пределах 32 ºС (Рис.23, а) [1202,1203]. Ниже этой температуры полимер растворим в воде, тогда как выше 32ºС начинают доминировать гидрофобные силы, что сопровождается помутнением раствора. Величину НКТР можно изменять путем прикрепления к полимеру дополнительных гидрофобных или гидрофильных групп. Указанные полимеры обычно биосовместимы и обладают низкой цитотоксичностью [1201,1204]. Небольшие модификации PNIPAAm приводят к изменению физических свойств полимера. Так, близкородственный полимер poly(N,N’-diethyl acrylamide), обозначаемый как PDEAAm (Рис.23, б), характеризуется величиной НКТР 26 – 25 º С [1205]. Величина НКТР сополимера DOPE, PNIPAAm и APr (N-acryloylpyrrolidine) находится в пределах температуре 40
– 45 º С.
Рис.23. Некоторые термочувствительные полимеры, используемые при создании мицелл или липосом.
Липосомы, содержащие указанные полимеры, способны высвобождать лекарственные вещества при температуре выше НКРТ [1156]. Кроме того, было показано, что липосомы, прикрепленные комплексом авидинбиотин на поверхности бусинок из термочувствительного геля, образо-

162
ванного PNIPAAm и акриловой кислотой: p(NIPAM-co-AA), были способны высвобождать загруженное в них вещество при повышении температуры выше РКТР, которая для данного полимера составляла 32ºС [1206]. Примером более сложной конструкции является сополимер полиизопропилакриламида с гидроксибутиратом и гидроксивалератом, обозначаемый как PHBHV-b-PNIPAAm (Рис.23, в) [1207]. Данное вещество способно спонтанно образовывать мицеллы, диаметром около 500 нм, обладает большим эффективным объемом для лекарственных веществ (77%), и выраженной чувствительностью к изменениям температуры в области физиологических значений.
PNIPAAm наиболее часто используется при создании термочувствительных наночастиц, имеющих мицеллярную структуру [1208-1211]. Для создания мицелл используют сополимеры PNIPAAm с более гидрофобными молекулами, которые участвуют в формировании ядра мицеллы, тогда как PNIPAAm образует термочувствительную оболочку, способную коллапсировать при нагревании выше НКТР в результате чего внутреннее содержимое мицеллы «выдавливается» наружу. Так, сополимер PNIPAAm c полифосфазеном, обозначаемый как Poly(NIPAm-co-DMAA), имел НКТР при 37ºС и образовывал мицеллы наноразмеров. Эти мицеллы можно было загружать доксорубицином, который эффективно высвобождался при температуре выше 37ºС [1212]. Для создания термочувствительных мицелл можно использовать также сополимеризацию PNIPAAm с такими природными полимерами, как хитозан [1213]. Образующиеся при этом мицеллы имеют диаметр около 100 нм при комнатной температуре, но способны агрегировать и образовывать более крупные структуры при повышении температуры до 40ºС.
Внекоторых случаях в мицеллах удается объединять как термо-, так
ирН-чувствительность, путем создания триблок-сополимера, например:
poly(methyl methacrylate)-b-poly(N-isopropylacrylamide-co-poly(ethylene-
glycol) methyl ether methacrlate)-b-poly(methyl methacrylate) (PMMA-b- P(NIPAM-co-PEGMEMA)-b-PMMA), соединенных в цепи последователь-
но (ABC-архитектура) [1214,1215]. Трехблочная структура, получаемая путем прикрепления гидрофобных блоков PMMA к гидрофильной двухблочной структуре NIPAAM и DMAEMA также позволяет создавать мицеллы, объединяющие термо- и рН-чувствительность [1209]. Образующиеся мицеллы имеют диаметр 80 – 120 нм, в зависимости от рН среды. Величина НКТР мицелл составляет 32ºС, 36,6ºС и 39,5ºС для величин рН 5,0; рН 7,4 и рН 9,0 соответственно. Интересно, что термочувствительность полимеров может оказывать влияние на процессы эндоцитоза частиц в клетки. Указанное явление было обнаружено при исследовании ми-
целл из сополимера PNIPAAm-co-DMAA, [poly(N-isopropylacrylamide-co- N,N-dimethylacrylamide)] [1216]. Вероятно, это связано с индуцированной
163
температурой агрегацией мицелл наноразмеров (25нм) при 40ºС, в результате чего образуются более крупные частицы (600 нм), способные инициировать процессы эндоцитоза.
Интерес представляют также биодеградируемые полимеры на основе лактатов метакриламида, которые образуют мицеллы, размером 10 – 60
нм [1217-1219]. Например, сополимер poly(N-(2-hydroxypropyl)
metacrylamide mono/dilactate) или сокращенно: poly(HPMAmmono/dilactate (Рис.23, г). Интересно, что одна часть сополимера – HPMA-monolactate имеет НКТР при 65ºС, тогда как другая часть – HPMAdilactate имеет НКТР при 13ºС. Было показано, что результирующая НКТР находится в промежутке между этими значениями и зависит от соотношения компонентов в полимерной цепи. А именно, величина НКТР растет с увеличением содержания HPMA-monolactate. Таким образом, меняя состав полимера, можно создавать мицеллы с заданной величиной НКТР
[1220].
4.5. Эхолипосомы. Адресация ультразвуком.
Эхолипосомы представляют собой стабилизированные липидом субмикронные пузырьки газа, способные отвечать на действие ультразвукового облучения [1221-1223]. Они могут применяться для доставки лекарственных веществ, инкорпорированных внутри липосом, или в качестве специфического контрастера для ультразвуковой диагностики патологических процессов. Кроме того, эхолипосомы, совместно с ультразвуковым облучением, могут служить в качестве активного терапевтического агента. С помощью направленного ультразвукового облучения можно осуществлять акустическую адресацию лекарственных веществ, заключенных в пузырьках газа, стабилизированных липидом.
4.5.1. Акустический спектр
Распространение звуковых волн связано с молекулярным движением, при котором чередуются процессы сближения молекул в результате сжатия (компрессии) с процессами разрежения молекул (декомпрессии). В результате механического перемещения молекул возникают распространяющиеся волны. Одной из важнейших характеристик волновых процессов является их частота. Диапазон звуковых частот (акустического спектра), которые способно воспринимать ухо человека, называемый слышимым звуком, находится в пределах от 20 Гц до 20 КГц (Рис.24). .
Диапазон звуковых волн с частотами более 20 КГц называется ультразвуком, а с частотами менее 20 Гц – инфразвуком. Частоты в диапазоне

164
от десятков КГц до нескольких МГц используются в терапевтических целях. Для визуализации патологических процессов используются более высокие частоты. Частоты 2,2 – 7,5 МГц нашли широкое применение в абдоминальной, акушерской, гинекологической ультразвуковой диагностике и эхокардиографии. Для органов с более поверхностной локализацией, таких как щитовидная железа, глаза, периферическая сосудистая система (периферическая васкулатура) используются более высокие частоты (7,5 – 15 МГц), которые позволяют получать изображения с более высоким пространственным разрешением, но не проникают глубоко в тело
Рис.24. Шкалы акустического спектра (а) и биомедицинского применения ультразвука (б).
Обозначения: Терапия – физиотерапевтические процедуры, АБ – абдоминальная и АГ – акушерская сонография, ЭК – эхокардиография, ПВ – диагностика периферической васкулатуры, ПО – диагностика поверхностных орга-
нов [1222].
4.5.2. Типы акустических волн
Классификация акустических волн может быть основана на характере движения частиц материала, в котором распространяются звуковые волны. Для удобства описания физического процесса движения волн вводится понятие «частица», которая представляет собой малую часть объема среды (газа, жидкости или твердого тела), и движется, как целостный элемент, при распространении волны [1222]. Частицы, изображенные как точки (Рис.25), представляют собой малые объемы материала, которые существенно меньше длины волны, хотя могут содержать миллионы молекул.
Когда волна движется в среде, важно оценить, как направление движения частиц соотносится с направлением распространения волны. Если частицы перемещаются вперед и назад вдоль направления движения волны, такие волны называются продольными. Продольные волны могут
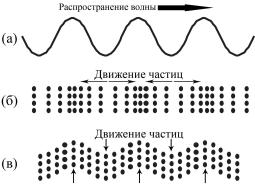
165
Рис.25. Распространяющаяся волна может быть представлена в виде синусоиды (а). При этом движение частиц может происходить вдоль направления распространения волны – продольная волна (б), или поперек направления распространения волны – поперечная волна (в).
распространяться в любых материалах: газах, жидкостях и твердых телах. Если частицы периодически отклоняются в направлении, перпендикулярном направлению движения волны, такие волны называют поперечными. Поперечные волны существуют только в твердых материалах. В организме человека они могут присутствовать, например, в костной ткани. Поперечные волны не встречаются в мягких тканях, которые ведут себя подобно жидкостям, поскольку для них характерно высокое содержание воды. Так, стекловидное тело глаза содержит почти 99% воды, печень – около 70%, кожа – 60%, хрящ – около 30%, жировая ткань – не более 10%. Важны также размер и форма клеток, ориентация и физические характеристики фибрилл макромолекул.
При распространении ультразвуковых волн в различных средах, включая ткани человеческого тела, амплитуда волны уменьшается с расстоянием. Величина затухания определяется процессами поглощения (адсорбции) и рассеяния энергии волн. Адсорбция связана с преобразованием энергии ультразвуковых волн в тепло, тогда как рассеяние вызвано тем, что направление распространения части волновой энергии изменяется. Большой интерес представляет также явление акустической кавитации, при котором энергия ультразвука концентрируется в кавитационных пузырьках. Обычно, кавитационные пузырьки возникают там, где уже существуют пузырьки воздуха микронных и субмикронных размеров, которые служат в качестве «центров нуклеации». Акустические волны низкой интенсивности вызывают осцилляцию присутствующих в растворе пузырьков (Рис.26).
Волны низкой интенсивности способствуют развитию стационарной кавитации, при которой происходит циклическое изменение размера пузырьков синхронно с волной. При более высокой интенсивности облучения наблюдается мгновенная или инерциальная кавитация, при которой происходит рост размеров и фрагментация пузырьков. Этот процесс со-

166
провождается повышением температуры, образованием свободных радикалов и возникновением ударных волн [1224]. Однако традиционно эти механизмы действия ультразвука на объекты называют нетепловыми [1222]. Высокоскоростная микрофотосъемка позволяет наблюдать формирование и фрагментацию кавитационных пузырьков [1225,1226]. Вследствие быстрого расширения и коллапса пузырьков, так называемого «внутреннего коллапса», аналогичного локальному взрыву микроскопических масштабов, возникают ударные волны, а температура в непосредственном окружении пузырька может достигать 5000К [1223]. Для ультразвука 5 – 10 МГц оптимальный радиус пузырьков, участвующих в кавитации, составляет 0,3-0,2 мкм, а пороговое значение звукового давления составляет 0,6 – 0,9 МПа. При более низких частотах диапазон размеров пузырьков, участвующих в кавитации, сильно расширяется, а пороговое значение давления снижается
Рис.26. Схематическое изображение (а,б) и высокоскоростная микросъемка (в) действия акустических волн на кавитационные пузырьки [1225]. Размер пузырька на микрофотографии слева около 3 мкм.

167
В соответствии с теорией, в жидкостях может возникать внутренняя кавитация, если в ней содержатся подходящие центры нуклеации. В качестве центров нуклеации могут служить, прежде всего, пузырьки газа. Спонтанная нуклеация в моделях тканей при отсутствии предсуществующих центров нуклеации не зависит от частоты в пределах 1 – 15 МГц и возникает при давлении звука выше порога 4 МПа [1227]. Однако в реальных тканях пороговое значение выше, чем в жидкостях [1228]. Поэтому для создания кавитации в тканях необходимо добавлять искусственные центры кавитации. Так, для увеличения эхогенных свойств крови в нее добавляют ультразвуковые контрастеры (UCA – ultrasound contrast agents), которые могут содержать различные газообразные вещества и служат в качестве центров нуклеации. Ультразвуковые контрастеры представляют собой микропузырьки газа, стабилизированные поверхностноактивными веществами (ПАВ), такими как длинноцепочечные жирные кислоты, спирты, эфиры или различные фосфолипиды. В связи с низкой диэлектрической проницаемостью газов, они ведут себя как гидрофобные агенты и контактируют с гидрофобными частями амфифильных молекул. Поэтому липиды образуют вокруг пузырьков газа монослой, в котором молекулы обращены полярной частью в окружающий водный раствор, тогда как их гидрофобные части экспонированы в газообразную среду
(Рис.27).
Рис.27. Субмикронный пузырек газа, стабилизированный монослоем липида. Лекарственные вещества (фигуры черного цвета)
могут находиться на внешней (гидрофильной) или внутренней (гидрофобной) поверхностях липида, а также могут быть интеркалированы между молекулами липида.
Акустически активные ультразвуковые контрастеры, иногда называемые эхогенными липосомами или эхолипосомами (echogenic liposomes, echoliposomes), имеют субмикронные размеры и могут содержать пузырьки воздуха [1221]. Однако липосомы, содержащие воздух, имеют короткое время «жизни» в растворах, поскольку воздух хорошо растворим в воде и быстро удаляется из липосом. Для увеличения стабильности пузырьков их заполняют плохо растворимыми и нерастворимыми в воде газами к которым относятся фторорганические соединения, например, перфторуглероды (Табл.4).

168
Таблица 4. Газообразные вещества, используемые для создания ультразвуковых контрастеров.
Соединение |
Температура |
Молек. |
Растворимость |
|
кипения (° С) |
масса |
в воде |
Азот |
– 195,8 |
28 |
Плохая |
Аргон |
– 189,4 |
39,95 |
Плохая |
|
|
|
|
Гексофлуорид серы(SF6) |
Сублимирует |
147,07 |
Плохая |
Перфлуоропропан (C3F8) |
– 36,7 |
188,2 |
Нерастворимо |
Перфлуоробутан (С4F10) |
– 2 |
238,04 |
Нерастворимо |
Перфлуоропентан (C5F12) |
29,5 |
288,05 |
Нерастворимо |
|
|
|
|
Перфлуорогескан (C6F14) |
57,11 |
338,06 |
Нерастворимо |
Кроме того, компоненты газа должны быть химически инертны, не вовлекаться в процессы метаболизма и не проявлять токсического действия. Растворимость перфторуглеродов в воде падает, а температура кипения возрастает при увеличении молекулярной массы. При 37° С молекулы перфторуглеродов с длиной углеродной цепи меньше 6-ти атомов находятся в газообразном состоянии. Однако практическое применение находит также перфлуорогексан, с длиной цепи в шесть атомов углерода, который при физиологической температуре находится в жидком состоянии. Можно предположить, что при 37° С часть перфлуорогексана сублимирует и под действием ультразвука разогревается, что приводит к испарению всего вещества.
Эхогенные липосомы можно получать встряхиванием суспензии липосом в присутствии соответствующего газа, а также лиофилизацией или распылением-высушиванием суспензии липидов и последующим хранением в газовой среде. Для создания эхо-липосом, содержащих лекарственные вещества, недавно были разработаны новые остроумные методы. Было показано, что предварительно сформированные липосомы, содержащие лекарство, могут приобрести эхогенные свойства, если данную суспензию липосом выдержать в атмосфере соответствующего газа при повышенном давлении.
Количество растворенных в липосомах газов возрастает, если их заморозить. После замораживания липосомы можно хранить при нормальном давлении, а затем нагреть до физиологической температуры непосредственно перед использованием [1229]. Эхогенные свойства сохраняются дольше в липосомах, содержащих длинноцепочечные насыщенные липиды. Предполагается, что липиды с повышенной температурой плавления и обладающие большей ригидностью, лучше удерживают газы. Так, смесь липидов из яичного фосфатидилхолина, дипальмитоилфосфатидилэтаноламина, дипальмитоил-фосфатидилглицерина и холестерина (молярное соотношение липидов: 27:42:8:8:15) в течение 1 часа теряла около 50% газа. Такая стабильность, по мнению авторов, совершенно
