
2 курс / Нормальная физиология / Клиническая_физиология_и_патофизиология_для_анестезиологов_Черний
.pdf
вызывает сужение артерий и подъем АД, раздражение второго - расширение сосудов и падение АД.
Главными сосудосуживающими нервами органов брюшной полости являются симпатические волокна, проходящие в составе внутренностного нерва. Симпатические сосудосуживающие нервы к конечностям идут в составе спинномозговых смешанных нервов, а также по стенкам артериол.
Сосудорасширяющие эффекты (вазодилатация) относятся к парасимпатическому отделу нервной системы.
Импульсы, идущие от сосудосуживающего центра продолговатого мозга, проходят к нервным центрам симпатической части вегетативной нервной системы, расположенным в боковых рогах грудных сегментов спинного мозга, регулирующих тонус сосудов отдельных участков тела.
Артерии и артериолы постоянно находятся в состоянии сужения, в значительной мере определяемого тонусом сосудодвигательного центра. Тонус сосудодвигательного центра зависит от афферентных сигналов, приходящих от периферических рецепторов, расположенных в некоторых сосудистых областях и на поверхности тела, а также от влияния гуморальных раздражителей. Рефлекторные изменения тонуса артерий - сосудистые рефлексы - могут быть разделены на 2 группы: собственные и сопряженные рефлексы.
Собственные сосудистые рефлексы вызываются сигналами от рецепторов самих сосудов. Особенно важное значение имеют рецепторы, сосредоточенные в дуге аорты и в области разветвления сонной артерии на внутреннюю и наружную. Указанные участки сосудистой системы получили название
сосудистых рефлексогенных зон.
Рецепторы, расположенные в дуге аорты, являются окончаниями центростремительных волокон, проходящих в составе аортального нерва. Этот нерв функционально был обозначен как депрессор. Электрическое раздражение центрального конца нерва обусловливает снижение АД вследствие рефлекторного повышения тонуса ядер блуждающих нервов и рефлекторного снижения тонуса сосудосуживающего центра. В результате
сердечная деятельность тормозится, а сосуды внутренних органов расширяются.
В рефлексогенной зоне сонного синуса (каротидный синус, sinus caroticus) расположены рецепторы, от которых идут центростремительные нервные волокна, образующие синокаротидный нерв. Этот нерв вступает в головной мозг в составе языкоглоточного нерва. Понижение системного АД обусловлено тем, что растяжение стенки сонной артерии возбуждает рецепторы каротидного синуса, рефлекторно понижает тонус сосудосуживающего центра и повышает тонус ядер блуждающих нервов.
Рецепторы сосудистых рефлексогенных зон возбуждаются при повышении АД в сосудах, поэтому их называют прессорецепторами, или барорецепторами.
Понижение АД вследствие, например, уменьшения объема крови в организме (при кровопотерях), ослабления деятельности сердца или при перераспределении крови и оттоке ее в избыточно расширившиеся сосуды какого-нибудь крупного органа ведет к тому, что прессорецепторы дуги аорты и сонных артерий раздражаются менее интенсивно, чем при нормальном АД. Влияние аортальных и синокаротидных нервов на нейроны сердечно-сосудистого центра ослабляется, сосуды сужаются, работа усиливается и АД нормализуется.
Рефлекторная регуляция АД осуществляется не только при помощи механорецепторов, но и хеморецепторов.
Хеморецепторы сосредоточены в каротидных тельцах. Они чувствительны к СО2, гипоксии; раздражаются также СО, цианидами, никотином. От хеморецепторов возбуждение передается к сосудодвигательному центру и вызывает повышение его тонуса. В результате сосуды суживаются и АД повышается. Одновременно происходит возбуждение дыхательного центра.
Гуморальная регуляция сосудистого тонуса
Сосудосуживающие вещества. К ним относятся гормоны мозгового вещества надпочечников - адреналин и норадреналин, а также задней доли гипофиза - вазопрессин. Адреналин и
116 |
117 |
|
норадреналин суживают артерии и артериолы кожи, органов брюшной полости и легких, а вазопрессин действует преимущественно на артериолы и капилляры и оказывает влияние на сосуды в очень малых концентрациях.
К числу сосудосуживающих гуморальных факторов относится серотонин, продуцируемый в слизистой оболочке кишок и в некоторых участках головного мозга. Серотонин образуется также при распаде тромбоцитов. Физиологическое значение серотонина в данном случае састоит в том, что он суживает сосуды и препятствует кровотечению из пораженного сосуда. Во второй фазе свертывания крови, после образования тромба, серотонин расширяет сосуды.
Особый сосудосуживающий фактор - ренин - образуется в почках, причем тем в большем количестве, чем меньше кровоснабжение. Ренин представляет собой протеолитический фермент. Сам ренин не вызывает сужения сосудов, но, поступая в кровь, расщепляет а,-глобулин плазмы - ангиотензиноген и превращает его в относительно малоактивный ангиотензин I, который под влиянием фермента дипептидкарбоксипептидазы превращается в очень активное сосудосуживающее вещество ангиотензин II. Последний быстро разрушается в капиллярах ангиотензиназой. В условиях нормального кровоснабжения почек образуется сравнительно небольшое количество ренина. В большом количестве он продуцируется при снижении системного АД.
Открытие ренина и механизма его сосудосуживающего действия объяснило причину высокого АД, сопутствующего некоторым заболеваниям почек.
Сосудорасширяющие вещества. Во многих тканях тела происходит образование сосудорасширяющих веществ, получивших название простагландинов, которые представляют собой производные насыщенных жирных кислот. Из подчелюстной, поджелудочной желез, из легких и некоторых других органов получен сосудорасширяющий полипептид - брадикинин. Он вызывает расслабление гладких мышц артериол и понижает уровень АД.
К сосудорасширяющим веществам относится ацетилхолин (АХ), который образуется в окончаниях
парасимпатических нервов и симпатических вазодилататоров. АХ быстро разрушается в крови.
Гистамин - вещество, образующееся в слизистой оболочке желудка и кишок, а также в других органах, в частности в коже и скелетных мышцах. Он расширяет артериолы и увеличивает кровенаполнение капилляров. Снижение АД и нарушения кровообращения при этом подобны тем, какие возникают при большой кровопотере.
В последнее время установлена важная роль эндотелия сосудистой стенки в регуляции кровотока. Эндотелиоциты под влиянием химических раздражителей, приносимых кровью, способны сами выделять вещества, действующие на сосудистый тонус и вызывающие расширение сосудов (например, оксид азота).
Сосуды ряда органов и тканей обладают индивидуальными особенностями регуляции, которые объясняются структурой и функцией данного органа.
Список литературы
1.Зильбер А.П. Клиническая физиология в анестезиологии
иреаниматологии.-М.: Медицина, 1984.
2.Патологическая физиология. Учебник / Под ред. А.Д.Адо, М.А.Адо, В.И.Пыцкого, Г.В.Порядина, Ю.А.Владимирова.- М.: Триада-Х, 2000.-С.514-536.
3.Физиология человека. Учебник / Под ред. В.М.Покровского, Г.Ф. Коротько.- М.: Медицина. 1998.- 368с.
118 |
119 |
|

Глава 5.
НАРУШЕНИЯ ТРАНСПОРТА КИСЛОРОДА
ИИХ КОРРЕКЦИЯ У БОЛЬНЫХ
ВКРИТИЧЕСКИХ СОСТОЯНИЯХ
Кислород является важнейшим биогенным химическим элементом, обеспечивающим дыхание всех живых организмов на земле. Энергия, необходимая для осуществления процессов жизнедеятельности, высвобождается в результате окисления внутриклеточных химических структур с последующей аккумуляцией в макроэргических связях фосфатных соединений. В нормальных условиях эффективность биологического окисления соответствует функциональной активности клеток, тканей и органов. При нарушении этого соответствия возникает состояние энергетического дефицита, приводящее к разнообразным функциональным и морфологическим нарушениям, вплоть до гибели тканей. Взрослый человек потребляет в течение суток в среднем 420 л кислорода, и эта цифра может значительно возрастать при физической нагрузке и различных гиперметаболических состояниях. В отличие от других веществ, принимающих участие в метаболизме, кислород не может запасаться в тканях «впрок» и гибель организма в условиях аноксии наступает в течение 5 мин.
Значительно чаще, чем «полная» аноксия, в клинической практике встречается гипоксия - состояние, возникающее при недостаточном снабжении тканей организма кислородом или нарушении его утилизации в процессе биологического окисления. В зависимости от этиологического фактора, патогенетических особенностей, темпа нарастания и продолжительности гипоксического состояния проявления гипоксии могут значительно варьироваться. Первой патогенетической классификацией гипоксии, получившей широкое распространение, была классификация Баркрофта (1925), в которой он выделил три типа гипоксии (аноксий): аноксическую, анемическую и застойную. В 1932 г. Питере и Ван-Слайк предложили различать четвертый тип - гистотоксическую аноксию, возникающую в результате
неспособности тканей использовать кислород. В настоящее время термин «аноксия» употребляется редко, поскольку полное отсутствие кислорода, как и полное прекращение окисления при жизни организма практически не встречается. Тем не менее, современные классификации гипоксии существенно не отличаются от классификации Баркрофта. Все они выделяют следующие типы гипоксии:
1.Гипоксическую:
-вследствие понижения уровня FiO2 (процентного содержания, парциального давления О2 в воздухе или газовой смеси);
-вследствие дыхательной недостаточности (неспособности аппарата внешнего дыхания артериализовать притекающую венозную кровь).
2.Гемическую, возникающую вследствие снижения кислородной емкости крови.
3.Циркуляторную, в основе которой лежит нарушение транспорта крови в ткани.
4.Тканевую, обусловленную нарушением усвоения кислорода в процессах окислительного фосфорилирования.
Проблема гипоксии продолжает оставаться центральной в анестезиологии и интенсивной терапии, несмотря на постоянный рост числа посвященных ей исследований. Несомненно, что транспорт кислорода является тем «фокусом», где обнаруживают общие интересы патофизиологи, биохимики, фармакологи и клиницисты. Однако актуальность проблемы обусловлена в первую очередь тем, что профилактика и лечение при гипоксии составляют наиболее важную и ответственную часть ежедневной работы анестезиолога.
Без преувеличения можно утверждать, что обеспечение адекватного системного и регионарного транспорта кислорода при критических состояниях является важнейшей задачей современных диагностических и терапевтических мероприятий, главным аспектом интенсивной терапии, во многом определяющим ее конечные результаты. Нарушение окислительных процессов при различных патологических
120 |
121 |

состояниях является основным синдромом, формирующим многочисленные морфофункциональные изменения, а оценка кислородного метаболизма служит интегральным маркером анализасостояния, прогноза и эффективности интенсивной терапии. На пути из атмосферного воздуха к клетке кислород последовательно проходит ряд морфофункциональных структур: воздухоносные магистрали - альвеола - легочный капилляр - артериальные магистрали - тканевой капилляр - внутриклеточный транспорт. Перемещение молекул кислорода из одной структуры в другую осуществляется путем пассивной диффузий по градиенту концентраций, т.е. процесс не является энергозависимым. Однако каждая физиологическая функция, обеспечивающая доставку кислорода к местам диффузии, энергозависима и нарушение любой из этих функций может повлечь кислородное голодание тканей.
Сэтих позиций последнее может быть обусловлено:
1.Снижением фракционной концентрации кислорода во вдыхаемом воздухе или газовой смеси.
2.Нарушениями газообмена в альвеоло-капиллярной единице (различные варианты вентиляционно-перфузионных нарушений).
3.Снижением кислородной емкости крови (анемия, уменьшение количества функционально полноценного
^гемоглобина).
- 4. Нарушениями доставки кислорода к тканям и тканевого газообмена (сердечная, циркуляторная недостаточность, сниженная экстракция кислорода).
5.Несоответствие доставки кислорода метаболическим запросам тканей при различных гиперметаболических состояниях.
6.Нарушением утилизации кислорода в клетке.
7.Комбинациями нарушений.
Исходя из этого, системный кислородный мониторинг включает анализ следующих параметров:
-РаО2 (напряжение кислорода в артериальной крови);
-НЬ (содержание гемоглобина);
-SaO2 (насыщение гемоглобина артериальной крови кислородом);
122
-СаО2 (объемное содержание кислорода в артериальной
крови);
-СИ (сердечный индекс);
-DO2 (индекс доставки кислорода);
-VO2 (индекс потребления кислорода);
-КЭО2 (коэффициент экстракции кислорода);
-PvO, (напряжение кислородом в венозной крови);
-SvO2 (насыщение кислородом гемоглобина венозной
крови);
-CvO2 (объемное содержание кислорода в венозной крови);
-концентрация молочной кислоты в артериальной или смешанной венозной крови.
Для исчерпывающей оценки кислородного статуса необходимо прямое измерение 7 показателей: РаО2, Hb, SaO2, CB, pvO2, SvO2, уровня лактата в артериальной или смешанной венозной крови. На основании прямых измерений производится расчет содержания кислорода в артериальной и венозной крови, СИ, DO2, VO2, КЭО,. Ввиду того, что изменения каждого из перечисленных параметров могут повлечь изменения кислородного статуса тканей, целесообразен краткий анализ их физического смысла и клинического содержания. Поскольку наиболее употребляемыми и доступными для исследования в клинических условиях (кроме содержания гемоглобина) являются показатели РаО2, SaO2, СИ, они будут рассмотрены наиболее подробно.
Напряжение кислорода в артериальной крови
Нормальные значения РаО2 при дыхании атмосферным воздухом находятся в интервале 80-100 мм рт.ст и имеют тенденцию к снижению с возрастом (приблизительно на 3 мм рт.ст. в 10 лет, начиная с 40 лет). Измерение РаО2 осуществляется прямым методом (РаО, - электрод газоанализаторов) и методом чрескожной оксиметрии. Точность последнего определяется адекватностью периферического кровотока.
Показатель РаО2 отражает количество кислорода, физически растворенного в плазме крови. Это количество составляет 0,03 • РаО2 в 1 л крови. Таким образом, при РаО2 = 100 мм рт.ст. содержание растворенного О2 равно 3 мл/л и
123
представляет крайне незначительную часть общего количества кислорода в крови (как будет показано ниже, общее содержание кислорода в артериальной крови составляет 170-190 мл/л).
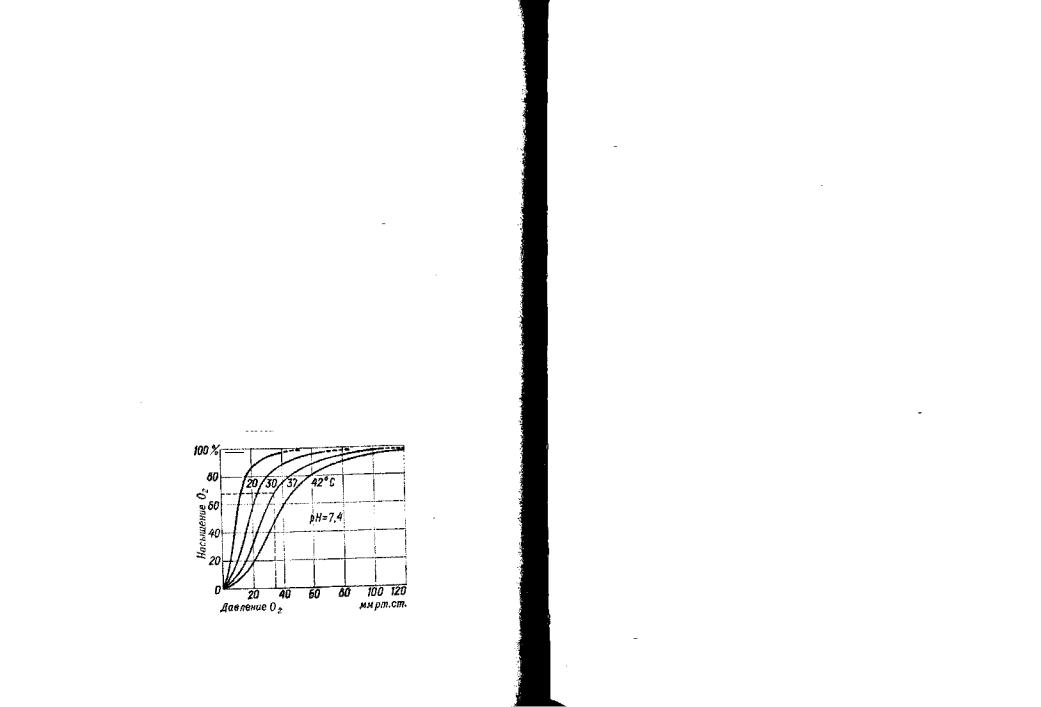
В аспекте кислородного статуса РаО2 имеет значение лишь постольку, поскольку определяет уровень сатурации гемоглобина. Зависимость SaO2 от РаО2 выражается графически при помощи такназываемойкривойоксигенации-деоксигенации(диссоциации) гемоглобина. Эта зависимость нелинейна, и кривая имеет S- образную форму (рис. 14). Нижняя граница нормы сатурации (90%) достигается при РаО2, находящемся в области 60 мм рт. ст. Выше этой точки насыщение гемоглобина очень мало зависит от РаО2 (т.е. значительное увеличение уровня РаО, практически не изменяет уровень SaO2). Однако S-образный характер кривой приводит к тому, что при РаО2 ниже 60 мм рт. ст. характер зависимости SaO2-PaO2 существенно меняется: незначительное снижение уровня РаО2 может резко уменьшить сатурацию и, следовательно, критически ухудшить доставку кислорода тканям. Смещение кривой диссоциации вправо приводит к ослаблению связывания кислорода гемоглобином и отмечается при ацидозе и гипертермии (т.е. при тех же значениях напряжения кислорода сатурация ниже, ухудшается артериализация крови в легких, но улучшается отдача кислорода в тканях). Сдвиг кривой влево происходит при гипотермии и алкалозе и характеризуется противоположнымиизменениямиэтойзависимости.
Ш%\
о*= 20—*-$ eg |
ш too |
Давление 0г |
ямрт.ст. |
Рис. 14. Кривая оксигенации-деоксигенации гемоглобина при различной
температуре тела и постоянном рН (П. Варги, 1983)
124
Клиническое значение РаОг
РаО2 является одним из основных критериев эффективности легочного газообмена. Принято считать, что гипоксемия является патогномоничным маркером дыхательной недостаточности, неспособности аппарата внешнего дыхания артериализовать притекающую венозную кровь. Однако необходимо помнить, что оксигенация артериальной крови складывается как из диффузии О, из альвеолярного газа, так и за счет предсуществующей оксигенации (за счет кислорода, содержащегося в венозной крови). При нормальной величине шунтового кровотока (до 10%) PvO2 оказывает незначительное влияние на РаО2, но при нарушении газообмена (увеличение фракции шунта) значение PvO2 может стать определяющим в конечном значении РаО2. Таким образом, не только патология легких, но и интенсивность тканевого метаболизма (высокий коэффициент экстракции О2) может послужить причиной развития критической гипоксемии.
Существует известный безопасный уровень гипоксемии (60 мм рт. ст.), не приводящий к заметному ухудшению кислородного транспорта. Из этого не следует, что достижение этого уровня должно служить сигналом к проведению дополнительных лечебно-диагностических мероприятий. Необходимо четко осознавать, что сатурация гемоглобина находится в нелинейной зависимости от РаО,: изменения последнего в пределах 100-60 мм рт. ст. практически не сказываются на доставке кислорода, однако при достижении этой критической точки нарушения доставки кислорода принимают "обвальный" характер и дальнейшее, даже незначительное, усугубление гипоксемии может привести к катастрофической гипоксии тканей. Поэтому любые тенденции к снижению РаО2 должны иметь своим следствием диагностические и лечебные мероприятия, направленные на выяснение их причины (оценка вентиляционно-перфузионных взаимоотношений, фракции шунта и т. д.) и его патогенетическую коррекцию. Лечебнодиагностический алгоритм при снижении РаО2 выглядит следующим образом:
1- РаО, в пределах нормы / нормовентиляция. Дальнейший мониторинг.
125

2.РаО, в пределах нормы /гипервентиляция.
2.1.Диагностика первичного поражения аппарата внешнего дыхания (аускультация, перкуссия, рентгенологическое исследование). Диагноз подтвержден (пневмония, ателектаз, бронхообструкция, внутриплевральная патология) ® этиотропная терапия (антибиотики, бронхолитики, муколитики, плевральная
пункция и т. д.).
2.2. Диагностика причины компенсаторного напряжения (инотропная, циркуляторная недостаточность, нейроэндокринная патология, сепсис, лихорадка, гиперметаболизм, гиповолемия, анемия и т.д.) - этиотропная терапия выявленных заболеваний и патогенетическая коррекция гомеостатических сдвигов (ОЦК, СИ, ОПСС, КОС, НЬ и т.д.). Оксигенотерапия.
3.РаО2 снижено / нормовентиляция. Практически не встречается.
4.РаО2 снижено / гиповентиляция.
Выявление причины гиповентиляции. Лечение основного заболевания, респираторная поддержка, оксигенотерапия.
5. РаО2 снижено/гипервентиляция.
Исследование вентиляционно-перфузионного коэффициента. Наиболее доступным методом исследования перфузии является вычисление отношения PaO2/FiO2, которое хорошо коррелирует с изменениями фракции шунта Qs/Qt (Qs - кровоток через шунт, Qt - общий кровоток).
Эта корреляция выглядит следующим образом:
5.1. РаО, / FiO2 > 200 - Qs / Qt < 20% (приемлемый уровень фракциишунта).
Преобладание нарушений вентиляции ® диагностика и лечение первичной ОДН.
5.2. РаО, / FiO2 < 200 - Qs / Qt > 20% (значительное шунтирование и/или увеличение периферического потребления кислорода; наиболее часто встречается при пневмонии, отеке легких, ОРДС, ТЭЛА).
Лечебно-диагностический комплекс соответствует таковому по п.2 с оксигенотерапией (FiO2 не должно превышать 60%).
6. Снижение РаО, до 60 мм рт. ст.
126
Экстренные мероприятия направлены на стабилизацию внешнего дыхания, центральной и периферической гемодинамики.
Следует помнить о той неоднозначной роли, которую может играть оксигенотерапия у больных в критических состояниях. Вопервых, с увеличением фракции шунта РаО2 все меньше реагирует на изменения FiOr Когда Qs/Qt достигает 50%, внутрилегочныи шунт ведет себя как истинный (анатомический) и никакие изменения FiO2 не могут повысить РаО2. Таким образом, можно не применять токсических концентраций О2, если величина шунтового кровотока превышает 50%, т. е. FiO2 можно уменьшить без значительного снижения РаО г Во-вторых, оксигенотерапия может угнетать сократительную способность миокарда и снижать сердечный выброс, в результате чего доставка кислорода может падать, несмотря на повышение РаО2.
Насыщение гемоглобина артериальной крови кислородом
Сатурация гемоглобина определяется как насыщение гемоглобина кислородом и рассчитывается как отношение количества НЬО2 к общему количеству НЬ (т. е. сумме НЬО2 и RHb):
НЬО2
* 100.
HbO2+RHb
Как правило, в условиях клиники для определения SaO2 используется неинвазивная оксиметрия, которая базируется на способности разных форм гемоглобина поглощать свет различной длины волны. Оксиметры первого поколения имели серьезные недостатки, главным из которых была невозможность дифференцировать гемоглобин артериальной и венозной крови. Оксиметры второго поколения позволяют измерить прохождение света только через пульсирующие сосуды (пульсоксиметрия). Двухволновые пульсоксиметры определяют только два гемоглобиновых режима: НЪО2 и RHb, а мет- и карбоксигемоглобин не абсорбируются красным и инфракрасным цветом. Точность
127

определения НЬО2 с помощью мультиволновых оксиметров колеблется в пределах 2-3%. Нарастание погрешности происходит при SaO2 ниже 70%, выраженных гемодинамических нарушениях. Результаты измерения SaO2 могут быть не всегда адекватны у курильщиков, при желтухе, а также при использовании ряда препаратов (нитроглицерин, лидокаин). В норме SaO2 составляет 95-100%. Лечебные мероприятия применяют при значениях SaO2, равных 90% и ниже. Как правило, снижение SaO2 связано с нарушением легочного газообмена и лечебные мероприятия должны быть направлены на коррекцию этих нарушений. Иногда снижение SaO2 обусловлено уменьшением количества функционально активного гемоглобина (отравление СО, метгемоглобинообразователями); лечение в этих случаях носит этиотропный характер.
Следует помнить, что показатель SaO2 неадекватен для выявления ранних изменений в легочном газообмене, так как его существенное снижение наблюдается при падении РаО2 ниже 60 мм рт. ст.
Сердечный индекс
После артериализациивенозной кровидальнейшийтранспорт кислорода осуществляется по сосудистым магистралям, и его адекватность определяется состоянием гемодинамики, основным параметром которой является сердечный выброс.
Сердечный выброс (СВ) представляет собой объем крови, изгоняемой из желудочков сердца в период систолы. Наиболее точно СВ может быть измерен прямыми методами (метод разведения индикатора или метод термодилюции). Метод разведения индикатора основан на том, что при быстром введении красителя (например, синий Эванса) в кровь объемная скорость кровотока будет пропорциональна средней концентрации красителя в нижележащих отделах сосудистого русла. В настоящее время в качестве прямого метода измерения СВ используют метод термодилюции (терморазведения), осуществляемый после катетеризации легочной артерии. При этом 5-10 мл (у взрослых) 5% раствора глюкозы или 0,9% раствора натрия хлорида (20-25°С)
быстро вводят через проксимальное отверстие катетера. В правых отделах сердца происходит смешивание этого раствора с кровью. Далее охлажденная кровь попадает в легочную артерию и протекает мимо дистального конца катетера, на котором расположен термистор, регистрирующий изменение температуры. На основании разницы между температурами крови и введенного раствора строится термодилюционная кривая, площадь которой обратно пропорциональна объемной скорости кровотока в легочной артерии. При отсутствии внутрисердечного шунтирования крови справа налево величину объемной скорости кровотока в легочной артерии принимают в качестве значения СВ. Построение термодилюционных кривых в настоящее время осуществляется компьютерами. На точность измерения могут оказывать влияние продолжительность введения термоиндикатора, внутрисердечные шунты, низкий СВ. Однако общепризнано, что метод терморазведения является наиболее точным методом определения СВ. К числу наиболее распространенных неинвазивных методов относятся эхокардиография и интегральная реография.
Для оценки системного кислородного транспорта (как, впрочем, и состояния гемодинамики вообще) целесообразна стандартизация показателей инотропной функции сердца. Обычно вместо прямого значения СВ используется производный показатель - СИ, нормальные значения которого находятся в интервале 2,5-3,5 л/мин/м2.
В целом, лечебные мероприятия при нарушениях гемодинамики направлены на восстановление адекватного перфузионного давления в тканях и проводятся следующих образом:
1.Инфузионнаятерапия.
2.Уменьшение постнагрузки (диуретики, ганглиоблокаторы, вазодилататоры).
3.Инотропная поддержка.
4.Вазопрессоры.
Коррекция нарушений СВ должна производиться с учетом комплексной оценки состояния гемодинамики (ОПСС, ДЗЛК или ЦВД). Примерный алгоритм выглядит так:
128 |
129 |
|

1.Низкий СИ/низкое или нормальноеДЗЛК - инфузионная терапия.
2.Низкий СИ / высокое ОПСС - добутамин, вазодилататоры.
3.Низкий СИ / нормальное ОПСС - дофамин в средних
дозах.
4.Низкий или нормальный СИ/низкое ОПСС - альфа-, бетаагонисты.
5.Высокий СИ / низкое ОПСС - альфа-агонисты.
Объемное содержание кислорода в артериальной крови
СаО2 в артериальной крови состоит из кислорода, связанного с гемоглобином, и физически растворенной фракции. 1 г НЬ связывает при полном насыщении (SaO2=l 00%) 1,3 мл кислорода. Количество физически растворенного кислорода определяется, как отмечалось выше, по формуле: РаО2 0,03 мл О2 в 1 л плазмы. Исходя из этого, СаО2= (1,3- HbSaO2) + (0,03-PaO2).
Таким образом, при уровне НЬ, равном 140 г/л, РаО2 = 100 ммрт. ст. и SaO2 -98%; CaO2= 1,3-1400,98+1000,03=181 мл О2/1 л крови или 18,1 мл /100 мл крови (18,1 мл/л, 18,1 об.%).
Очевидно, что уменьшение кислородной емкости крови может быть связано со снижением количества гемоглобина (кровотечение, анемия) и степени его насыщения (нарушения легочного газообмена, отравление СО и метгемоглобинообразователями). «Вклад» РаО2 в СаО2 несуществен, однако при снижении РаО2 до 60 мм рт. ст. этот показатель начинает опосредованно (через SaO2) влиять на кислородную емкость крови.
Индекс доставки кислорода, индекс потребления кислорода, напряжение кислорода в венозной крови, насыщение кислородом венозной крови, коэффициент экстракции кислорода
Доставка кислорода - это скорость транспорта кислорода артериальной кровью, которая зависит от величины СВ и содержания кислорода в артериальной крови:
DO2 = СИ • СаО2.
В норме DO2 определяют при СаО2, равном 18%, и СИ, составляющем 2,5-3,5 л/мин-м2. Таким образом, нормальный DO2 составляет 520-720 мл/мин-м2.
VO2 (потребление кислорода) определяется как производное СИ и артериовенозной разницы в содержании кислорода:
VO2 = СИ (СаО, - CvO2) или VO2 = СИ • 1,3 : НЪ (SaO2 - SvO2).
При нормальных значениях СИ и насыщения гемоглобина смешанной венозной крови кислородом (66-77%) величина VO2 колеблется от 110 до 160 мл/мин • м2.
КЭО2 - это часть кислорода, поглощаемая тканями из капиллярного русла:
КЭО2 (%) = (VO2 / DO2) -100.
Нормальное значение КЭО2 в покое - 22-32%, что свидетельствует о том, что лишь малая доля доступного О2 извлекается из капиллярной крови в обычном состоянии. Это позволяет тканям приспосабливаться к снижению доставки О, путем увеличения его утилизации (КЭО2 способен повышаться до 60-80%).
Столь широкий резерв компенсации обеспечивает удовлетворительный DO2 даже при резком (в 2-2,5 раза) снижении кровотока. Однако необходимо учитывать ряд особенностей взаимоотношения DO2 -VOr
Во-первых, в сердце и диафрагме высокая экстракция кислорода (60-70%) из капиллярного ложа происходит уже в норме, поэтому уровень оксигенации этих органов весьма чувствителен даже к малым изменениям кровотока. Для полного удовлетворения метаболических потребностей миокарда необходима высокая объемная скорость кровотока, особенно у больных с поражением коронарных сосудов.
Во-вторых, экстракция кислорода нарушается в ответ на изменение кровотока лишь в определенной области DO,. Существует точка DO2, когда поглощение кислорода максимально и не может больше возрастать. Эта точка - критический уровень доставки кислорода, который представляет собой порог DO2, необходимый для адекватной оксигенации тканей. Постоянное
131
130

значение этого уровня не выявлено, что указывает на необходимость индивидуального мониторинга DO2 и VO2 при тяжелых состояниях; однако у большинства больных критический уровень DO2 находится в пределах 300 мл/ минм2.
В-третьих, у больных в критических состояниях нарушено поглощение кислорода из системы микроциркуляции. Экстракция кислорода может оставаться на том же уровне, и VO2 становится зависимым от потока крови в широком диапазоне изменений DOr Эта закономерность является общей для различных тяжелых состояний.
В-четвертых, если РаО2 можно оценить по показателям газов артериальной крови, то SvO2 требует прямого измерения (трансмиссионная спектрофотометрия). Это обусловлено S- образной формой кривой оксигенации-деоксигенации гемоглобина. Значения РаО2 попадают на ее отлогую часть и могут быть оценены с незначительной ошибкой; значения SvO2, напротив, попадают на крутую ее часть и могут значительно варьировать даже при небольшой ошибке в измерениях.
Уровень молочной кислоты |
|
|
Если скорость метаболических процессов значительно |
|
|
повышена, «нормальный» уровень потребления кислорода может |
|
|
не быть достаточным. Таким образом, оценка основных |
|
|
компонентов системы транспорта кислорода (DO, и VO2) |
|
|
позволяет определить снабжение им тканей, но не дает |
|
|
информацию о его адекватности. При абсолютном либо |
|
|
относительном дефиците кислорода включается анаэробный тип |
|
|
дыхания, конечным этапом которого является образование |
|
|
молочной кислоты. Следовательно, концентрация лактата в |
|
|
сыворотке крови может быть использована для оценки баланса |
|
|
между VO2 и метаболическими запросами даже тогда, |
когда |
|
величины VO2 находятся в пределах нормы. При |
этом |
|
гиперлактацидемия может служить одним из показаний к |
|
|
инфузионной или инотропной терапии даже при нормальных или |
;| |
|
повышенных показателях VO,. Если повышение уровня лактата |
| |
|
ассоциировано со снижением VO2, то целью первого этапа |
| |
|
лечебных мероприятий должно быть достижение адекватного |
| |
|
132 |
|
|
сердечного выброса и DO,. Концентрацию лактата определяют в артериальной или смешанной венозной крови. У здоровых людей при мышечном покое она не превышает 2 ммоль/л, у пациентов отделений интенсивной терапии допустимой является концентрация до 4 ммоль/л.
Иногда уровень лактата может повышаться без выраженной ишемии (например, гиповитаминоз В6, пневмония, судорожный синдром, респираторный алкалоз), что свидетельствует о недостаточно высокой специфичности данного теста.
Некоторые параметры регионарного кислородного гомеостаза
Глобальные критерии кислородного транспорта и потребления не всегда способны отражать специфическую ситуацию на регионарном уровне. В настоящее время появились возможности оценивать кислородный гомеостаз в ряде важных органов и тканей организма.
Интестинальный уровень кровотока. При СВ 25% крови поступает в интестинальный кровоток. При снижении транспорта кислорода к кишкам могут возникать ишемическии колит, некроз (инфаркт) кишок, транслокация энтеробактерий - сепсис. Спланхническая ишемия не распознается при системном кислородном мониторинге; оценка адекватности тканевой оксигенации этой зоны производится методом желудочной или кишечной тонометрии с оценкой рН слизистой оболочки желудка (кишок). Методология этой процедуры отражает степень нарушения кислородного баланса гастроинтестинального тракта, почти всегда реагирующего на ишемические процессы. В настоящее время установлено, что кровотечение от стрессовой ульцерации встречается только у пациентов, имеющих pHi ниже 7,24 (для слизистой оболочки желудка). При абдоминальных операциях pHi в сигмовидной кишке ниже 6,86 указывает на интестинальную ишемию. Желудочная тонометрия эффективна для прогноза выживаемости пациентов, предсказания развития послеоперационных осложнений и, соответственно, времени начала интенсивнойтерапии.
133

Печеночное венозное насыщение (Shv 0J является
маркером печеночного кровотока, отражающим соотношение между потребностями органа в кислороде и его потреблением. При ShvO2 ниже 40% отмечена хорошая корреляция данного параметра с развитием в послеоперационный период печеночной недостаточности. Однако определенный критический уровень ShvO2 пока не установлен.
Кислородная сатурация мозговой ткани определяется в соответствии с артерио-югулярной разницей по Ог Разработаны приборы для мониторинга насыщения гемоглобина кислородом в яремной вене при помощи волоконной оптической системы. В норме SaO2 - S.O2 = 99 (100) - 55 (75) %. Таким образом, церебральная экстракция кислорода составляет 25-45%. В настоящее время появились неинвазивные инфракрасные спектроскопы, позволяющие оценивать кислородный гомеостаз головного мозга, не прибегая к взятию проб крови.
Коррекция гипоксии с помощью фармакологических средств
Кроме вышеизложенных общих принципов лечения при нарушении кислородного транспорта, целесообразен краткий анализ возможностей коррекции гипоксии с помощью фармакологических средств.
Одним из самых эффективных и перспективных путей профилактики и терапии гипоксии, а следовательно, лечения различной тяжелой патологии в практике интенсивной терапии представляется применение антигипоксантов - фармакологических средств, ослабляющих иди ликвидирующих гипоксические нарушения путем поддержания и повышения энергопродукции в системе митохондриального окислительного фосфорилирования.
Применение антигипоксантов (наиболее эффективны - гутимин, амтизол, олифен) приводитк многообразным позитивным метаболическим и функциональным сдвигам, что продемонстрировано при травматическом и ожоговом шоке, острой дыхательной i недостаточности, массивной кровопотере, инфаркте миокарда, :'• инсультах, ЧМТ, менингите, гипоксии плода в родах, различных i оперативных вмешательствах.
134
Антигипоксанты способны накапливаться в митохондриях клеток, препятствуя в условиях гипоксии угнетению дегидрогеназ, поддерживая работу дыхательной цепи и повышая степень сопряжения между окислением и фосфорилированием, что обусловливает увеличение энергопродукции, в том числе на единицу потребленного Ог
Весьма перспективным представляется применение в анестезиологии и интенсивной терапии фармакологического класса актопротекторов (бемитил, этомерзол и др.). Актопротекторы первоначально создавались как средства неистощающего типа для поддержания двигательной активности и физической работоспособности в экстремальных условиях. Эти средства эффективны при двигательной гипоксии, отличающейся отсутствием первичного угнетения митохондриальных функций. Цель применения препаратов в таких случаях заключается не просто в поддержании исходной мощности окислительного фосфорилирования, авувеличенииэтоймощности. Приназначении актопротекторов такая цель достигается благодаря очень быстрой активации синтеза митохондриальных белков, включая ферменты. Развитие антигипоксического эффекта у бемитила и его аналогов не только при двигательной, но и при других видах гипоксии уже подтверждено в эксперименте и клинике. Непрямой характер антигипоксического действия актопротекторов определяют и особенности их применения. Нерациональным представляется назначение актопротекторов в фазу глубокой гипоксии, характеризующейся резким энергодефицитом, поскольку для проявления их действия требуется активация энергозависимых синтезов белков. В то же время актопротекторы высокоэффективны в пред- и постгипоксический периодах.
Весьма перспективной группой препаратов, способных блокировать сразу несколько патогенетических звеньев нарушений кислородного гомеостаза, являются также перфторорганические соединения (ПФОС). Эмульсии этих веществ обладают необычными свойствами, наиболее привлекательными среди которых - химическая инертность, способность растворять в себе большие количества газов и отдавать их там, где их концентрации более низкие (кислород - в
135
