
6 курс / Неонатология / Неонатология_Н_П_Шабалов_7_е_издание_Том_2_2020
.pdf1.Острый, включая молниеносную (катастрофическую) форму:
• гиперкоагуляционная фаза;
• переходная фаза;
• гипокоагуляционная фаза;
• фаза восстановления свертывания.
2.Подострый (фазы такие же, как при острой форме).
3.Хронический (с длительным периодом гиперкоагуляции и/или гиперагрегации тромбоцитов), в том числе при хронических воспалительных и иммуновоспалительных процессах, хроническом гемолизе.
Комплекс методов диагностики ДВС-синдрома
1. Определение клеточных маркеров:
•подсчет количества тромбоцитов в крови;
•определение спонтанной агрегации тромбоцитов;
•оценка фрагментации эритроцитов.
2.Выявление признаков тромбинемии и активации фибринолиза - увеличения содержания РФМК (растворимые фибрин-мономерные комплексы) в плазме (по фенантролиновому тесту) и в сыворотке (по ТСС - тест склеивания стафилококков), уровня фибринопептида А, фрагмента D и D-димера.
3.Оценка общих коагуляционных тестов (активированное парциальное тромбопластиновое время, протромбиновый и тромбиновый тесты, содержание в плазме фибриногена).
В приведенную классификацию, на наш взгляд, целесообразно добавить понятия «компенсированный» и «декомпенсированный» ДВС-синдром, поскольку при отсутствии любых проявлений кровоточивости (компенсированный ДВС-синдром) в подавляющем большинстве случаев нет необходимости в чисто гемостазиологической терапии.
Уже достаточно давно ведущие отечественные специалисты, занимающиеся проблемами гемостаза и ДВС-синдрома, указывали, что процесс внутрисосу-дистого свертывания крови, внутрисосудистого фибринообразования - необходимое явление в любом живом организме (М.С. Мачабели, Д.М. Зубаиров, З.С. Баркаган, И.Н. Бокарев, В.Г. Лычев). И.Н. Бокарев ввел термин «постоянное внутрисосудистое свертывание крови», подчеркивая волнообразность этого явления с периодами временного повышения интенсивности как при физиологических (физическая нагрузка), так и при патологических (острые инфекционные болезни и др.) состояниях. При слишком быстро наступающей и массивной тромбинемии, когда антисвертывающие механизмы недостаточны для ее инактивации, происходит протеолитический взрыв, поражение сосудистого эндотелия, блокада микроциркуляции сгустками/тромбами, повышенное потребление про- и антикоагулянтов, т. е. ДВС-синдром.
Частота развития ДВС-синдрома у больных новорожденных не установлена. Используя общепринятые тесты, Д.О. Иванов (1996) выявил следующую частоту развития ДВСсиндрома у новорожденных (табл. 18.20). Из приведенных в таблице данных видно, что нередко ДВС-синдром у новорожденных клинически не проявляется.
Таблица 18.20. Частота ДВС-синдрома и геморрагического синдрома при различных формах неонатальной патологии (в %) (Иванов Д.О., 1996)
Форма неонатальной патологии |
ДВС- |
Геморрагический |
|
синдром |
синдром |
Постгипоксический синдром (тяжелый) |
33 |
11,1 |
Постгипоксический синдром, осложненный |
28,1 |
21,9 |
пневмонией |
|
|
Сепсис |
100 |
50 |
Гемолитическая болезнь новорожденных |
7,7 |
7,7 |
Недоношенные гестационного возраста менее 32 |
31,2 |
25,9 |
нед |
|
|
Оперированные в неонатальном периоде |
91,6 |
68,8 |
Клиническая картина специфичных черт не имеет. Характерны длительные кровотечения из мест инъекций, пурпура и экхимозы, артериальная гипотен-зия, акроцианоз, олигурия или анурия, признаки разных степеней угнетения ЦНС, мелкоочаговая неврологическая симптоматика, дыхательная недостаточность и СДР взрослого типа, клинические проявления тромбозов - некрозы кожи, острая почечная недостаточность, спонтанные кровотечения - легочные, кишечные, носовые, гематурия, кровоизлияния во внутренние органы и мозг. Таким образом, у новорожденных с декомпенсированным ДВС-синдро- мом развивается разной степени выраженности полиорганная недостаточность без или с признаками повышенной кровоточивости. У большинства больных развивается и микроангиопатическая гемолитическая анемия. Для новорожденных типично волнообразное течение ДВС.
Диагноз ставят на основании клинической картины при одновременном обнаружении резкого удлинения протромбинового и парциального тромбо-пластинового времени, снижения ряда факторов свертывания крови, в том числе I, V, VIII, а также АТ III, тромбоцитопении при положительном эта-ноловом тесте и большом количестве продуктов деградации фибриногена и фибрина в крови (ПДФ), наличии фрагментированных эритроцитов (см. табл. 18.18). Методы диагностики нарушений гемостаза и диагностический алгоритм при кровоточивости у новорожденных приведены на рис. 18.7 и схеме 18.1.
Для диагностики наследственных дефектов гемостаза крайне важны составление родословных и тщательный анализ возможных признаков повышенной кровоточивости у членов семьи. Вместе с тем необходимо помнить, что 2025% гемофилий - следствие спорадических мутаций, поэтому в родословной может и не быть лиц с повышенной кровоточивостью. Важную роль играет ге-мостазиологическое обследование родителей.
Лечение. Прежде чем приступить к лечению, необходимо составить четкое представление об основных этиологических и поддерживающих факторах ДВС-синдрома у конкретного больного.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
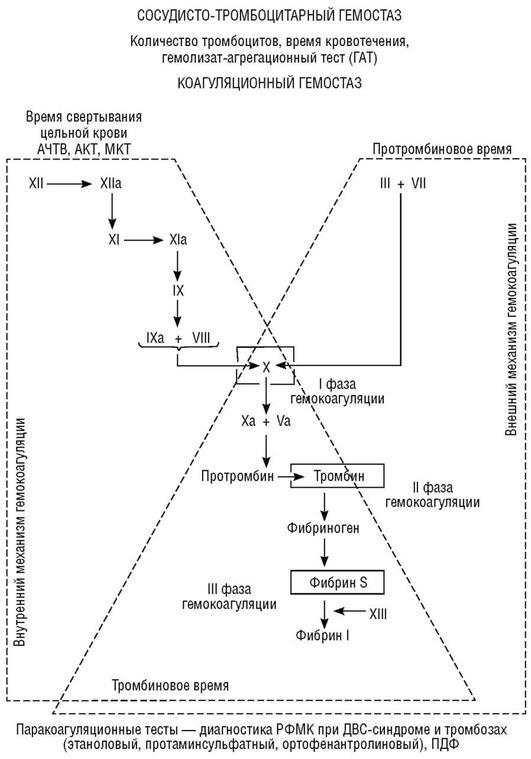
Рис. 18.7. Методы диагностики нарушений гемостаза
В большинстве случаев активная терапия гипоксемии (вентиляция - вспомогательная или искусственная, контролируемая кислородотерапия), гиповолемии и анемии («расширители объема» - переливание свежезамороженной плазмы,
изотонического раствора натрия хлорида, раствора Рингера♠, а при тяжелой анемии - отмытой эритроцитной взвеси), артериальной гипотензии
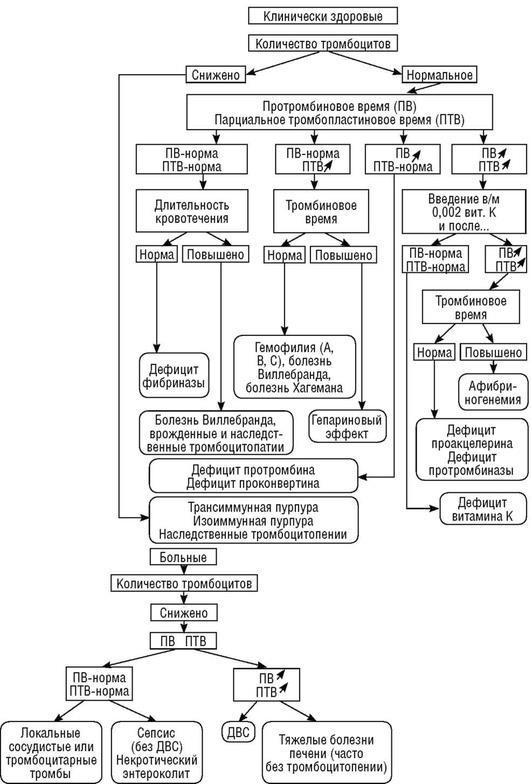
Схема 18.1. Диагностический алгоритм при кровоточивости у новорожденных (Гросс С., Стюарт М., 1998)
допамин без или в сочетании с добутамином, Адреналин♠ или, при надпочеч-никовой недостаточности, - гидрокортизон), патологического ацидоза (ИВЛ, а при необходимости - натрия гидрокарбонат), инфекции (антибиотики, Пентаглобин♠), токсикоза (поддержание адекватного диуреза, плазмаферез) приводит к купированию ДВС-синдрома в течение нескольких часов.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Считается целесообразным всем детям, которые не получили витамин К в родах, однократно ввести его.
При серьезной кровоточивости может быть показана заместительная терапия
- переливание тромбоцитной массы, свежезамороженной плазмы (15 мл/кг струйно) или активированного рекомбинантного фактора VII (rFVII, Ново-сэвен♠ - 100-200
мкг/кг), криопреципитата. Переливание плазмы показано не только для восполнения дефицита прокоагулянтов, но и антикоагулянтов (ибо типичным для ДВС-синдрома у новорожденных является дефицит антитромбина III). Переливание плазмы повторяют каждые 8-12 ч. Также назначают 2% раствор пентоксифиллина (0,1-0,2 мл в растворе 5% Глюкозы♠ 2-3 раза в сутки). При микроциркуляторной блокаде применяют ингибитор МАО допа-мин по 2-5 мкг/кг в минуту внутривенно капельно.
По общепринятому мнению, полезность гепаринотерапии у большинства детей с ДВС-
синдромом спорна. Гепарин показан детям с клиническими признаками развития тромбозов (гангренозно-некротические изменения кожи, острая почечная недостаточность, синдромы тромбозов больших сосудов и др.). Его назначают лишь после переливания свежезамороженной плазмы и восстановления уровня антитромбина III (кофактора действия гепарина). Обычно рекомендуют нагрузочную дозу Гепарина♠ 75-100 ЕД/кг массы тела внутривенно болюсно в течение 10 мин и далее поддерживающую дозу 25 ЕД/кг в час. При отсутствии визуальных и на УЗИ тромбов и убедительных доказательствах ДВС-синдрома нагрузочная доза Гепарина♠ 25-40 ЕД/кг и поддерживающая - 10-15 ЕД/кг в час. В настоящее время преимущественно используются низкомолекулярные гепарины (фраксипарин, иноксапарин и др.), которые обладают более высокой нейтрализующей активностью в отношении фактора Ха, имеют более высокий период полувыведения и в низких, средних дозах не изменяют существенно показатели общих коагуляционных тестов. Фраксипарин назначают в стартовой дозе 150-250 анти-Ха ЕД/кг с дальнейшим снижением дозы до 80-150 анти-Ха ЕД/кг с обязательной непрерывной инфузией в течение суток. Очень существенен мониторинг состояния гемостаза и важно, чтобы уровень Ха был в пределах 0,35-0,6 ЕД/мл и снижались уровни растворимых мономерных комплексов. Отменяют гепарины лишь при постепенном снижении дозы и назначении тромбоцитарных антиагрегантов (Курантил♠ и др., см. выше в главе).
Профилактика. Предотвращение критических состояний, ассоциированных с высоким риском развития ДВС-синдрома, - основа его профилактики. Совершенствование материалов, из которых приготовляют сосудистые катетеры, уменьшает их тромбогенность (см. главу 6, подраздел «Парентеральное питание»). При полном парентеральном питании через сосудистые катетеры считается целесообразным во все растворы добавлять гепарин в дозе 1,0 ЕД на 1 мл инфузируемой жидкости, чтобы за 1 ч ребенок получил от 3 до 5 ЕД гепарина.
Однако у недоношенных это может повышать риск внутрижелудоч-ковых геморрагий, поэтому у них используют дозы 0,5 ЕД на 1 мл инфузируемой жидкости.
18.6. ТРОМБОЗЫ И ЭМБОЛИИ
На секции прижизненные тромбы при тщательном исследовании обнаруживали у 9-10% умерших новорожденных, но выявление их повышается до 20% и даже 60% в случаях длительного применения сосудистых катетеров. Симптоматические вторичные тромбоэмболические осложнения диагностируют в отделениях интенсивной терапии новорожденных с частотой 2,4 на 1000 новорожденных (Schmidt B., Andrew M., 1995).
Еще великий Рудольф Вирхов (1856) постулировал три главных фактора, приводящих к тромбозам:
1) аномалии и повреждения сосудистой стенки;
2)расстройства (замедление) кровотока и текучести крови;
3)изменения в системе гемостаза. Эти положения актуальны и сейчас.
Аномалии и повреждения сосудистой стенки у новорожденных связывают, прежде всего, с сосудистыми катетерами (особенно опасны артериальные катетеры), замедленным закрытием артериального протока и образованием в нем тромба, могущего в дальнейшем быть источником эмбола. Ухудшение реологических свойств крови (меньшая «текучесть», гипервязкость) отмечается в первую очередь при полицитемии, тяжелых дегидратациях и гипоксии, врожденном дефиците антикоагулянтов.
Своеобразное состояние свертывающей системы крови у детей при рождении можно кратко охарактеризовать как направленность на «гипергемостаз», тромбоз, ибо оно является отражением аналогичной направленности гемостаза матери. Сразу после рождения ребенка и отделения последа «задача» гемостаза матери - предотвращение кровопотери через огромную «рану» - место отслойки плаценты. Отсюда и гиперкоагуляционная его направленность. Кровь новорожденного сворачивается в пробирке раньше, чем кровь детей более старших возрастных групп. Возможных причин для этого несколько (см. выше). Важными факторами, способствующими развитию тромбозов, являются:
•сосудистые катетеры;
•полицитемия;
•гипертромбоцитозы (например, при неонатальных кандидозах);
•шок и тяжелое течение бактериальных и вирусных инфекций с васкулитами;
•антифосфолипидный синдром у матери;
•гиперурикемия.
Согласно данным M. Аndrew и соавт. (1995) 90% венозных тромбозов у новорожденных связано с использованием центральных венозных катетеров.
Наследственный фактор также нередко играет важную роль в формировании тромбозов; в настоящее время доказано существование ряда наследственных тромбофилических состояний:
1) связанных с дефицитом и/или аномалиями физиологических антикоагулянтов:
-антитромбина III; - протеина С;
-протеина S;
-тромбомодулина;
-ингибитора внешнего пути активации свертывания; - избытком ингибитора протеина С;
-дефицитом кофактора II гепарина;
-аномалией ингибитора активатора плазминогена;
-избытком богатого гистидином гликопротеина - ингибитора комплекса антитромбин III - гепарин;
2) связанных с дефицитом или аномалиями прокоагулянтов:
- аномалией фактора V (Лейдена) - он активирован и резистентен связыванию активированным протеином С (у 2-6% представителей европейской расы имеется мутация гена, определяющего синтез аномального V фактора);
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
-аномалией протромбина (протромбин G20210→А);
-тромбогенными дисфибриногенемиями;
-дефицитом или аномалией плазминогена;
-дефицитом фактора ХII, прекалликреина, высокомолекулярного ки-ниногена;
3) обусловленных гиперагрегабельностью тромбоцитов:
-полиморфизмом гена гликопротеина IIIF;
-полиморфизмом гена метилентетрагидрофолатредуктазы, приводящим к гипергомоцистинемии.
Клиническая картина. A. Zipursky и B. Schmidt (1987) так обобщили клиническую картину тромботической болезни у новорожденных (табл. 18.21).
Диагностика. Для того чтобы установить наличие или отсутствие тромба, прибегают к различным вариантам ультразвукового обследования, контрастной ангиографии.
Лечение тромбозов у новорожденных, предлагаемое разными авторами, достаточно противоречиво, ибо практические рекомендации с позиций доказательной медицины отсутствуют.
Важна коррекция факторов высокого риска развития тромбозов. При по-лицитемии производят кровопускание и переливание свежезамороженной плазмы. При возможности удаляют сосудистые катетеры. У больных с наследственными дефицитами протеина С или антитромбина III рассматривают вопрос о целесообразности назначения антикоагулянтов типа неодику-марина. При поверхностных тромбах кожу над ними смазывают гепариновой мазью.
К специальной антитромботической терапии прибегают редко.
Таблица 18.21. Клиническая картина тромбоэмболической болезни новорожденных
(Zipursky A., Schmidt B., 1987)
Место обструкции сосуда |
Клиническая картина |
|
Вены |
Отеки и цианоз ног; часто ассоциированы с тромбами |
|
Нижняя полая вена |
вен почек Отек мягких тканей головы, шеи, верхней |
|
части грудной клетки, может развиться хилоторакс |
||
Верхняя полая вена |
||
Увеличенная почка(и), гематурия |
||
|
||
Почечные вены |
Часто геморрагический некроз надпочечников и |
|
|
||
Надпочечниковые |
клиническая |
|
вены |
картина надпочечниковой недостаточности |
|
Портальные |
Обычно в острой фазе клиническая симптоматика |
|
и печеночные вены |
отсутствует |
|
|
||
Артерии |
Застойная (перегрузочная) сердечная недостаточность: |
|
Аорта |
разница в систолическом давлении на верхних и нижних |
|
конечностях, сниженный феморальный пульс |
||
|
||
Периферические |
Отсутствие пульса при пальпации, изменение цвета |
|
|
||
Церебральные Легочные |
кожи, |
|
Коронарные Почечные |
снижение температуры кожи |
|
|
||
Мезентериальные |
Апноэ, генерализованные или локальные судороги |
|
|
||
|
|

Респираторные нарушения, легочная гипертензия
Застойная сердечная недостаточность, кардиогенный шок,
типичные изменения на ЭКГ, гипертензия, гемодинамическая
сердечная недостаточность, анурия
Клинические признаки некротизирующего энтероколита Гепарин - антикоагулянт (гетерогенная смесь полисахаридных цепей различной длины - от 3000 до 30 000 дальтон), усиливающий эффект АТ III на тромбин и в меньшей степени на Ха-фактор. Клиренс гепарина у новорожденных ускорен по сравнению с взрослыми. Консенсуса в отношении показаний и доз гепарина у новорожденных нет. Гепарин - препарат выбора при визуализированных тромбах. В наиболее популярных американских руководствах по неонатологии Avery's Neonatology (2018), Neonatal-Perinatal medicine (еds. A.А. Fanaroff, R.J. Мartin, 2002) рекомендуется нагрузочная доза 75-100 ЕД/кг массы тела внутривенно болюсно в течение 10 мин и далее поддерживающая доза 28 ЕД/кг/ч. Очень важен мониторинг состояния гемостаза. L. Luchtman-Jones и соавт. (2002) в руководстве Neonatal-Perinatal medicine пишут, что целесообразно, чтобы уровень анти-Ха-фактора был в пределах 0,35-0,6 МЕ/мл и АЧТВ (активированное частичное/парциальное тромбопластиновое время) - в пределах верхней границы нормы.
Наиболее частые побочные эффекты гепарина - кровоточивость (особенно часта при неритмичном его введении и отмене препарата) и тромбоцитопения. Тромбоцитопения может быть вызвана активацией и потреблением тромбоцитов, а также синтезом антител к комплексу тромбоцит + нефракционирован-ный гепарин.
W. Streif и соавт. (2003) применяли низкомолекулярный гепарин (Энокса-парин♠) вместо обычного гепарина у новорожденных с высоким риском тромбозов. Начальная доза, вводимая подкожно, составляла 1,3-1,5 мг/кг 2 раза в сутки. Для достижения уровня антиХа активности в указанных выше пределах дозу увеличивали до 1,6 мг/кг у доношенных и до 1,9 мг/кг у недоношенных. Поддержание в крови уровня фактора анти-Ха 0,3 ЕД/мл требовало введения Эноксапарина♠ в дозе 2,1 мг/кг у недоношенных и 1,7 мг/кг у доношенных 2 раза в сутки. Подобные дозы рекомендует и Avery's Neonatology (2018).
Тромболитическая терапия представлена в табл. 18.22, 18.23, противопоказания к тромболитической терапии - в табл. 18.24.
Таблица 18.22. Дозировка лекарственных препаратов, применяемых при антитромботической терапии новорожденных (Manco-Johnson M.J., 2013)
Лечение |
Нефракциоированный |
Эноксапарин♠ подкожно |
Тканевой |
|
гепарин непрерывно |
каждые 12 ч |
активатор |
|
внутривенно |
|
плазминогена |
|
|
|
непрерывно |
|
|
|
внутривенно |
Ударная |
Новорожденные <37 |
Данных нет |
Данных нет |
(насыщающая) |
нед: 50 ЕД/кг. |
|
|
доза |
Новорожденные >37 |
|
|
|
нед: 100 ЕД/кг. |
|
|
|
Дети >1 мес: 50 ЕД/кг |
|
|
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Инициальная |
Новорожденные |
Новорожденные и дети <12 |
Дети <3 мес: |
|
поддерживающая |
<28 нед: |
мес: 1,5 мг/кг 2 раза в день |
0,06 мг/кг в час |
|
подкожно (может |
(дозу можно |
|||
|
|
|||
доза |
15 ЕД/кг в час. |
потребоваться 1,25-2,0 |
удвоить, если |
|
|
Новорожденные |
мг/кг для достижения |
через 12-24 ч |
|
|
терапевтического уровня |
нет эффекта) |
||
|
|
|||
|
28-36 нед: |
анти-Ха) |
|
|
|
20 ЕД/кг в час (может |
|
|
|
|
потребоваться 30 ЕД/кг |
|
|
|
|
в час для достижения |
|
|
|
|
терапевтического уровня |
|
|
|
|
анти-Ха). |
|
|
|
|
Новорожденные >37 |
|
|
|
|
нед: |
|
|
|
|
28 ЕД/кг в час (может |
|
|
|
|
потребоваться 50 ЕД/кг |
|
|
|
|
в час для достижения |
|
|
|
|
терапевтического уровня |
|
|
|
|
анти-Ха) |
|
|
|
Мониторинг |
Активность анти-Ха 0,3- |
Активность анти-Ха 0,3-0,7 |
Уменьшение |
|
|
0,7 ЕД/мл |
ЕД/мл |
размеров или |
|
|
|
|
лизис сгустка |
|
|
|
|
при |
|
|
|
|
визуализации |
|
|
|
|
D-димера или |
|
|
|
|
ESP |
|
Примечание. ESP - продукты деградации фибриногена. |
|
|||
Таблица 18.23. Дозы и режимы дозирования тромболитических препаратов (Свирин П.В.
и др., 2013)
Препарат |
Дозы |
Урокиназа |
|
Нагрузочная доза |
4400 ЕД/кг |
Поддерживающая |
4400 ЕД/кг в течение 6-12 ч |
доза |
|
Мониторинг |
Фибриноген, тромбиновое время, активированное частичное |
|
тромбопластиновое время |
Тканевой активатор плазминогена |
|
Нагрузочная доза |
Нет |
Поддерживающая |
0,3-0,5 мкг/кг в час в течение 6 ч |
доза |
|
Мониторинг |
Фибриноген, тромбиновое время, протромбин, |
|
активированное частичное тромбопластиновое время |
Примечание. Параллельно назначают свежезамороженную плазму в дозе 10-20 мл/кг каждые 8-12 ч и нефракционированный гепарин в дозе 10 ЕД/кг в час.
Таблица 18.24. Противопоказания к тромболитической терапии (Свирин П.В. и др., 2013)
Абсолютные |
До 10 дней после кровотечения или операции |
|
|
До 7 |
дней после тяжелой асфиксии |
|
До 3 |
дней после инвазивных манипуляций |
Относительные |
До 48 ч после судорог |
|
Недоношенность менее 32 нед |
|
Сепсис |
|
Небольшие кровотечения |
|
Тромбоцитопения или гипофибриногенемия |
Хирургическое удаление тромба или участка тела, органа, некротизированно-го из-за нарушенного кровоснабжения.
Профилактика аналогична таковой при ДВС-синдроме. Конечно, чем короче срок использования центрального катетера, тем меньше осложнений. В будущем, вероятно, для лиц, предрасположенных к тромбофилии, будут усовершенствованы меры профилактики. КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Приведите классификацию анемий и уточните, анемии какой группы развиваются наиболее часто у детей с ЭНМТ и ОНМТ в ОРИТН.
2.Назовите показания к переливанию эритроцитной взвеси, эритропоэти-на новорожденным.
3.Каков патогенез ранней и поздней анемии недоношенных?
4.В каких ситуациях надо применять гранулоцитарный колониестимули-рующий фактор?
5.Почему всем новорожденным необходимо вводить витамин К1?
6.Разъясните, почему новорожденные склонны как к повышенной кровоточивости, так и к развитию тромбозов.
7.Перечислите объем обследования при геморрагическом синдроме и тактику терапии при разном генезе повышенной кровоточивости у новорожденных.
Глава 19. БОЛЕЗНИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Заболевания сердечно-сосудистой системы у новорожденных могут быть диагностированы лишь тогда, когда они проявляются одним из следующих симптомов или симптомокомплексов (синдромов): сердечной недостаточностью (СН), аритмией, недостаточностью периферического кровообращения (шоком), цианозом и сердечными шумами. Диагностическая роль последних двух симптомов различна. Цианоз - важнейший дифференциально-диагностический признак, сердечный шум - традиционный кардиологический симптом, значение которого в неонатологии минимально.
19.1. ЦИАНОЗ
Симптом появляется тогда, когда количество восстановленного гемоглобина в крови у взрослого человека превышает 50 г/л.
Однако если речь идет о HbF, имеющем большее сродство к кислороду, эта величина существенно ниже и составляет около 40 г/л, что соответствует PaО2 40-50 мм рт.ст. и насыщению гемоглобина кислородом в пределах 88-90%.
Ниже перечислены причины цианоза у новорожденных. Дифференциальную диагностику основных причин проводят по результатам физикального осмотра (см. табл. 19.1) и посредством гипероксидных функциональных проб.
Причины цианоза у новорожденных
Физиологические (вазомоторная нестабильность):
•преходящий право-левый шунт;
•тугое обвитие пуповины вокруг шеи. Метаболические:
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
