
4 курс / Медицина катастроф / Неотложная_педиатрия_Национальное_руководство_Б_М_Блохин
.pdf
Одни из тяжелых осложнений синдрома длительного сдавления - инфицирование ран и развитие сепсиса на фоне тяжелой эндотоксемии. Токсемия обусловлена нарушением кровообращения, вплоть до ишемического некроза мышц в результате их длительного сдавления. Поврежденные мышцы теряют 75% миоглобина, 66% калия, 75% фосфора, 70% креатинина. При сдавлении пружина миоглобина распадается, и свободный миоглобин выходит в мышечное ложе, откуда всасывается в кровь. Он быстро оседает во всех
реабсорбционной способности. Развивается почечная недостаточность.
паренхиматозных органах, но в первую очередь это сказывается на функции почек. В кислой среде мочи миоглобин переходитme/medknigiв кристаллы солянокислого гематина, который в сочетании с метаболическим ацидозом приводит к блокаде канальцев почек и нарушению их
Существенную роль в возникновении токсемии играет избыток в крови свободного калия. Он как микроэлемент - необходимая составная часть питания сердечной мышцы, а при гиперкалиемии нарушается ритм сердечной деятельности, вплоть до полной остановки сердца. Кроме миоглобина и калия, токсемию усугубляют поступающие из сдавленных мышц креатинин, фосфор, адениловая кислота, гистамин, недоокисленные фракции и продукты распада белков. Все это приводит к нарушению функции двух главных фильтров организма: внутреннего - печени и внешнего - почек. Со стороны печени отмечаются нарушения белковой, пигментной и особенно дезинтоксикационной функций.
Следовательно, степень токсемии при синдроме сдавления отражает миоглобинурия, миоглобинемия, билирубинемия. Пусковой механизм для возникновения токсемии при синдроме длительного сдавления - рециркуляция кровотока в поврежденных тканях, поэтому его следует именовать синдромом длительного сдавления и рециркуляции.
Другой важный патогенетический фактор синдрома длительного сдавления - плазмопотеря. В тяжелых случаях она достигает 1/3 ОЦК и обусловлена возникновением массивного отека травмированных мягких тканей. Однако эти факторы - не единственные в патогенезе синдрома сдавления. Большое патогенетическое значение имеет ДВС-синдром, который ведет к нарушению кровотока в мелких сосудах и капиллярах.
Изучение свертывающей системы крови при различных заболеваниях, в том числе и при скелетной травме, показало., что при синдроме длительного сдавления наблюдается рассеянное свертывание крови в сосудах. При этом образуется множество микросгустков и агрегатов клеток крови, блокирующих микроциркуляцию в органах и тканях и ведущих к
дистрофическим нарушениям в них. Глубина и выраженность синдрома ДВС соответствуют https://tтяжести синдрома длительного сдавления тканей. Таким образом, ДВС - один из основных
факторов патогенеза синдрома сдавления.
Последовательность лечения синдрома длительного сдавления:
1. Немедленное проведение обезболивающей и инфузионной терапии сразу же после извлечения пострадавшего из завала (независимо от АД) с продолжением ее на всех этапах.
2. Применение плазмафереза в первые сутки с последующим замещением плазмы свежезамороженной донорской плазмой.
3. Хирургическое вмешательство - строго по показаниям (лампасные разрезы, 2-образное рассечение фасций, некрэктомия, наложение аппарата внешней фиксации при переломах, ампутация конечности).
4. Гемодиализ при развитии ОПН с ежедневным контролем содержания электролитов и азотистых метаболитов в крови.
5. Гемосорбция для детоксикации.
6. Гипербарическая оксигенация для улучшения микроциркуляции и уменьшения гипоксии поврежденных тканей.
7. Введение антибиотиков широкого спектра действия, ГК и психотропных средств.
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi

Некротизирующий фасциит. В настоящее время все процессы, связанные с бактериальными инфекциями, протекаемыми в фасциальных выстилках, объединяют общим термином «некротизирующий фасциит». Возбудителями некротизирующего фасциита могут выступать различные микроорганизмы. Отдельно принято рассматривать стрептококковый некротизирующий фасциит, что обусловлено некоторыми особенностями клинической
картины. Все остальные нозологические формы имеют относительно схожую клиническую |
|
картину, что позволяет их рассматривать в одном контексте. |
|
обратимое |
60me/medknigi |
1-й тип имеет полимикробную этиологию: анаэробы (Bacteroides spp, Peptococcus spp.) и грамотрицательные аэробы семейства Enterobacteriaceae. Также могут встречаться стрептококки, но не S. pyogenes.
2-й тип некротизирующего фасциита имеет мономикробную этиологию. Основной возбудитель - инвазивные штаммы S. pyogenes.
В связи с тем что для острого стрептококкового некротизирующего фасциита характерно чрезвычайно быстрое прогрессирующее развитие некроза кожных покровов, обусловленное тромбозом сосудов, питающих кожу, проходящих через поверхностную фасцию, ведущее место в лечении отводят хирургическим методам (рис. 7.3, см. цв. вклейку).
Клинические проявления некротизирующего фасциита: выраженная лихорадка, диарея, неукротимая рвота, артериальная гипотензия, эритродермия, а в случае, когда шок осложняет стафилококковую или анаэробную раневую инфекцию, - десквамация кожи вокруг раны. В хирургических стационарах шок, к признакам которого относятся выраженная лихорадка, геморрагические буллы и эритематозные кожные высыпания, а также развитие ДВС-синдрома и респираторного дистресс-синдрома взрослых с исходом в прогрессирующую полиорганную недостаточность, чаще всего вызывает S. pyogenes. Диагноз некротизирующего фасциита (критерии представлены ниже) подтверждается во время оперативного вмешательства. Осложнения некротизирующего фасциита, вызванного β-гемолитическим стрептококком группы А, представлены в табл. 7.7. Шок развивается в 95% случаев.
Таблица 7.7. Осложнения некротизирующего фасциита
|
|
|
|
|
|
. |
|
|
Осложнение |
|
Частота, % |
|
Шок |
|
95 |
|
ОРДС |
|
55 |
https://t |
|
||
|
Нарушение почечной функции: |
80 |
|
|
необратимое |
|
70 |
|
|
|
|
|
Бактериемия |
|
60 |
|
Смерть |
|
30 |
Диагностические критерии некротического фасциита и синдрома стрептококкового токсического шока
Диагноз вероятен
Некроз мягких тканей с вовлечением фасции.
Тяжелое системное поражение, приведшее:
• к шоку;
• синдрому ДВС;
• полиорганной недостаточности.
Диагноз не вызывает сомнений
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi

Некроз мягких тканей + тяжелое системное поражение + серологическое подтверждение инфекции, вызванной β-гемолитическим стрептококком группы А, которое выражается в 4- кратном увеличении уровня антител:
•к стрептолизину О;
•стрептодорназе В.
Некроз мягких тканей + тяжелоеme/medknigiсистемное поражение + гистологическое подтверждение (выделение грамположительных кокков из очага некроза).
Кардиогенный шок - шок, вызванный неспособностью сердца произвести адекватный СВ. Кардиогенный шок развивается у больных вследствие снижения минутного объема сердца за счет нарушений сократительной функции левого желудочка (инфаркт миокарда, миокардиты, кардиомиопатии, токсические поражения), вследствие нарушений внутрисердечной гемодинамики из-за механических причин (разрыв клапанов, хорд, папилярных мышц, межжелудочковой перегородки, тяжелые пороки, шаровидный тромб предсердий, опухоли сердца), слишком высокой или слишком низкой ЧСС (тахи- и брадиаритмии, нарушения предсердно-желудочковой проводимости), невозможности адекватного наполнения камер сердца в период диастолы из-за развившейся тампонады перикарда, а также препятствия движению крови от или к сердцу (эмболия легочной артерии, тампонада сердца, напряженный пневмоторакс, закрытие фетальных коммуникаций - овального окна и артериального протока - при дуктус-зависимых врожденных пороках сердца) (рис. 7.4). Наиболее частая причина кардиогенного шока - инфаркт миокарда.
Особый клинический вариант кардиогенного шока - аритмический шок, который развивается как результат падения минутного объема кровообращения вследствие тахикардии/тахиаритмии или брадикардии брадиаритмии. После купирования нарушения ритма достаточно быстро восстанавливается адекватная гемодинамика.
. https://t
Рис. 7.4. Патогенез кардиогенного шока
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi

При развитии шокового состояния отмечается болевой синдром, проявляемый выраженным беспокойством ребенка, сменяющимся заторможенностью. Отмечаются падение АД, нитевидный пульс, тахикардия, «мраморная» бледность кожных покровов, спавшиеся периферические вены, липкий холодный пот, акроцианоз, олигоанурия. Течение кардиогенного шока часто сопровождается развитием отека легких, мезентериальной ишемией, ДВС-синдромом, почечной недостаточностью.
Лечение шоковых состояний у детей преследует цель - обеспечить адекватную тканевую перфузию. Независимо от вида шока начинать лечение следует с первичной оценки пациента по системе ABCDE с восстановлением проходимости дыхательных путей и дыхания, дачи 100% кислорода, обеспечения непрерывного мониторирования жизненно важных параметров организма (ЭКГ, ЧСС, ЧД, SaO2, температура тела, глюкоза в крови, электролиты), обеспечения внутривенного периферического/центрального или внутрикостного доступа (минимум 2 доступа), а также регулярного проведения текущего осмотра пациента по системе
Основная причина кардиогенного шока - снижение сократимости сердечной мышцы, что приводит к падению СВ и нарушениюme/medknigiперфузии жизненно важных органов и тканей.
ABCDE.
Особенности течения шока при травме диктуют необходимость начала лечебных мероприятий как можно раньше, уже на месте травмы. В первую очередь могут потребоваться реанимационные мероприятия, остановка наружного кровотечения, аналгезия и транспортная иммобилизация.
Программа интенсивного лечения больного в шоке предусматривает следующие врачебные действия: восполнение дефицита ОЦК и обеспечение оптимальной пред- и постнагрузки, поддержание сократительной функции миокарда, респираторную поддержку, коррекцию метаболического ацидоза, антибиотикотерапию, иммунотерапию, аналгоседацию, предупреждение реперфузионных повреждений, нутритивную поддержку, коррекцию нарушений гемостаза.
Цели интенсивной терапии первого часа и терапии спустя 1 ч представлены на схемах (рис.
7.5, 7.6).
. https://tРис. 7.5. Объем лечения в течение 1 ч с момента постановки диагноза
Одна из главных целей в терапии шока - гарантировать оптимальную доставку кислорода. Измерение сатурации смешанной венозной крови (из легочной артерии) (SvO2) - идеальный метод оценки потребления кислорода. Сатурация венозной крови из верхней полой вены более 70% эквивалентна 62% сатурации смешанной венозной крови. Сатурация крови из верхней полой вены может быть использована как суррогатный маркер доставки кислорода. Ее величина более 70% при гемоглобине выше 100 г/л, нормальном АД и времени заполнения капилляров менее 2 с может свидетельствовать об адекватной доставке и потреблении кислорода. Кроме SvO2 из верхней полой вены, эффективность терапии шока можно контролировать по перфузионному давлению и СВ. Перфузионное давление рассчитывают как разницу между средним АД и ЦВД или средним АД и интраабдоминальным, а для определения СВ в последнее время широко используют неинвазивный метод допплерэхокардиографии.
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi
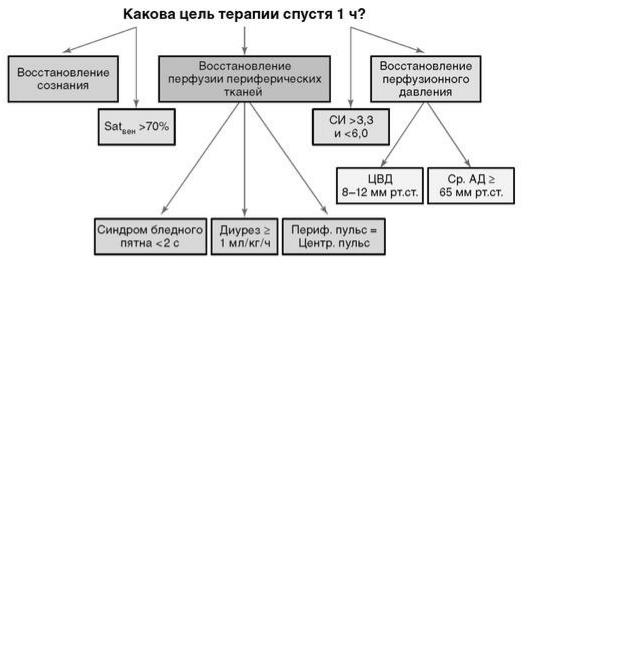
Нормальное время наполнения капилляров (симптом бледного пятна) и температура нижних конечностей гарантируют уровень сердечного индекса больше 2,0 л/мин/м2, сердечный индекс = СВ/Sпов.тела = 3,3-6,0 л/мин/м2. Наиболее высокая смертность отмечается среди детей с сердечным индексом менее 2 л/мин/м2.
Рис. 7.6. Объем лечения спустяme/medknigi1 ч с момента постановки диагноза
Лечение анафилактического шока начинают незамедлительно с введения 10 мкг/ кг 0,1% (максимум 0,5 мг) раствора эпинефрина (Адреналина♠) внутримышечно в наружную поверхность бедра или внутривенно. Введение эпинефрина при необходимости можно повторять каждые 5-15 мин. После введения первой дозы эпинефрина необходимо ввести 1-2 мг/кг метилпреднизолона и начать болюсное введение жидкости в дозе 20 мл/кг за 20 мин. В зависимости от клинической картины анафилактического шока показано использование ингаляций с сальбутамолом в дозе 0,15 мг кг при бронхоспазме, введение дифенгидрамина внутримышечно или внутривенно в дозе 1,0 мг/кг (максимум 50 мг) при кожных проявлениях, внутривенное капельное введение эпинефрина в дозе 0,1-1,0 мкг/мин в зависимости от состояния, допамин внутривенно.капельно в дозе 10-15 мкг/кг в минуту.
Лечение гиповолемического шока начинают с восполнения дефицита ОЦК и обеспечения
оптимального уровня преднагрузки и постнагрузки. От причины падения СВ зависит тактика https://tлечения конкретного пациента При нарушении сократительной функции сердца, например
при кардиогенном шоке, СВ уменьшается. Целевых значений СВ достигают с помощью введения инотропных препаратов. Что касается причины снижения СВ вследствие уменьшения преднагрузки, оптимальное лечение в данном случае - введение жидкости.
Падение СВ при шоковых состояниях может быть обусловлено и ростом диастолического давления в аорте. При развитии шокового состояния со сниженной сократительной способностью сердца рационально подключить к терапии препараты инотропного действия, а также вазодилататоры, способствующие уменьшению диастолического давления в аорте. Абсолютный или относительный дефицит ОЦК устраняют инфузионной терапией под контролем почасового диуреза, который в норме должен быть не менее 1 мл/кг в час у ребенка старше 3 лет, 1,5 мл/кг в час у ребенка от 1 до 3 лет, 2 мл/кг в час у ребенка до 1 года. ЦВД должно равняться 8-12 мм рт.ст. (или давление заклинивания легочных капилляров 8-16 мм рт.ст.), при котором достигается адекватная преднагрузка и гиповолемия не вызывает циркуляторной недостаточности. Ограничением интенсивности инфузионной терапии и необходимости применения инотропных средств может стать появление таких симптомов, как увеличение размеров печени, появление влажного кашля, нарастающих тахипноэ и влажных хрипов в легких. Снижение преднагрузки ниже нормы практически всегда ведет к уменьшению СВ и появлению признаков циркуляторной недостаточности. Несмотря на то что нейроэндокринные реакции ребенка на кровотечение соответствуют взрослому организму, степень гипотензии и снижение СВ, сопровождающие умеренную (15% объема крови) кровопотерю, у ребенка относительно больше, поэтому важную роль играет возмещение даже
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi

умеренной кровопотери. Объемы инфузионных средств и их взаимосочетание во многом зависят от этапа оказания медицинской помощи и стадии шока. Восполнение ОЦК приводит к увеличению венозного возврата с последующим увеличением АД, минутного объема сердца, что, в свою очередь, увеличивает перфузию и оксигенацию тканей. Объем и темп инфузии зависят от вида шока.
При гиповолемическом шоке на догоспитальном этапе инфузионную терапию рекомендуют начинать с применения болюсного введения изотонического раствора натрия хлорида. При подозрении на тампонаду сердца введение жидкости оправдано только при низком АД, если это не отсрочит перикардиоцентез. Первый болюс - 20 мл/кг вводят менее чем за 20 мин с последующей клинической оценкой его гемодинамического эффекта. При гиповолемическом, дистрибутивном и обструктивном шоках за первый час объем инфузии может быть увеличен до 60 мл/кг, а при СШ - до 200 мл/кг.
Основная цель инфузионной терапии - поддержание адекватного кровоснабжения тканей. Инфузионная терапия - первоначальное мероприятие для поддержания гемодинамики и прежде всего СВ. После введения изотонических кристаллоидов в дозе 20-60 мл/кг и сохраняющейся необходимости введения жидкости могут быть применены коллоидные растворы, особенно у детей с пониженным онкотическим давлением (при дистрофии, гипопротеинемии), а при анемии в результате кровопотери одногруппная эритроцитная масса - 10 мл кг в течение 1-2 ч. Абсолютное показание для переливания эритроцитной массы - гемоглобин ниже 70 г/л, а поддерживать его содержание следует, как минимум, на уровне 100 г/л. Применение при критических состояниях альбумина человека для коррекции гипоальбуминемии в первые 24 ч, по данным метаанализа рандомизированных исследований, приводит к повышению летальности больных. Установлено, что увеличение коллоидно-осмотического давления после введения альбумина носит транзиторный характер, а затем в условиях повышенной порозности капилляров происходит его экстравазация в интерстициальное пространство. В настоящее время использование инфузионных плазмозамещающих коллоидных растворов на основе гидроксиэтилкрахмала (Рефортан♠, Стабизол♠, Инфезол♠, ХАЕС-Стерил♠) в качестве препаратов выбора при гиповолемии и шоке не вызывает сомнений. Молекулы гидроксиэтилкрахмала способствуют снижению активации эндотелиальных клеток и уменьшают «капиллярную утечку».
Растворы гидроксиэтилкрахмала обеспечивают более длительное и выраженное |
|
объемозамещающее действие; характеризуются более длительным сроком пребывания в |
|
сосудистом русле; эффективно повышают коллоидно-осмотическое давление. Показано, что |
|
именно фракции гидроксиэтилированного. |
крахмала с молекулярной массой между 60000 и |
me/medknigi |
|
350000 Да участвуют в восстановлении порозных стенок капилляров при остром поражении |
|
тканей. Только эти фракции эффективно блокируют потерю альбумина и жидкости из |
|
внутрисосудистого пространства в интерстициальное. |
|
https://tПоложительная динамика от проведения инфузионной терапии сопровождается снижением ЧСС, увеличением АД и уменьшением шокового индекса (ЧСС/АД).
Болеутоление и седация являются необходимым компонентом программы лечения при многих видах шока, при которых факторы боли и гиперактивности ЦНС играют значительную роль. Из арсенала неингаляционных наркотических препаратов применяют кетамин. Достоинство данного препарата связано с антигипоксическим эффектом и отсутствием угнетающего влияния на кровообращение. Кетамин в дозе 2-3 мг/кг (затем 0,25 мг/кг в час) вызывает диссоциированную анестезию - состояние, при котором одни участки мозга угнетаются, а другие - возбуждаются. При терапии шока важно, что это проявляется выраженным аналгетическим действием, сочетающимся с поверхностным сном и со стимуляцией кровообращения. Кроме того, кетамин, освобождая эндогенный норадреналин, оказывает инотропное действие на миокард, а также, блокируя синтез ИЛ-6, уменьшает выраженность системной воспалительной реакции. Опиоидные анальгетики (кодеин + морфин + поскапин + папаверина гидрохлорид + тебаин -
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi

Омнопон♠ и тримеперидин - Промедол♠) как метод обезболивания при шоке у детей имеют значительно больше ограничений, чем показаний, из-за способности повышать ВЧД, угнетать дыхательный центр и кашлевой рефлекс.
Респираторная поддержка. В шоковом состоянии гипоксия у детей развивается не только вследствие нарушения тканевой перфузии, но и из-за гиповентиляции и гипоксемии, обусловленных снижением функции дыхательных мышц, а также внутрилегочным
переходу плазмы в интерстициальное пространство и в альвеолы. В результате этого уменьшается растяжимость легких, снижается продукция сурфактанта, нарушаются реологические свойства бронхиального секрета, происходит микроателектазирование. Суть диагностики ОДН при шоке любой этиологии состоит в последовательном решении трех диагностических задач: оценка степени ОДН, так как это диктует тактику и экстренность лечебных мероприятий; определение вида дыхательной недостаточности - отсюда выбор характера проводимых мероприятий; оценка ответа на первичные мероприятия - составление прогноза угрожающего состояния. Общая схема терапии состоит из восстановления проходимости дыхательных путей с помощью улучшения реологических свойств мокроты и трахеобронхиального лаважа; обеспечения газообменной функции легких методом оксигенации в сочетании с постоянным положительным давлением на выдохе. Показание к ИВЛ - неэффективность других методов лечения дыхательной недостаточности. ИВЛ - основной компонент замещающей терапии, используемой при полной декомпенсации функции внешнего дыхания. Если пострадавшему в течение первого часа не удается ликвидировать артериальную гипотензию, это также показание для перевода его на ИВЛ с FiO2 = 0,6. Кроме того, поскольку для работы дыхательных мышц расходуется до 40% СВ, перевод пациента на ИВЛ существенно улучшает показатели гемодинамики и органную перфузию. При этом нужно избегать высоких концентраций кислорода в газовой смеси. Важно отметить, что проведение неадекватной дыхательной терапии также представляет потенциальную угрозу развития тяжелых неврологических нарушений. Например, длительная
шунтированием вследствие респираторного дистресс-синдрома. Происходит увеличение кровенаполнения в легких, возникаетme/medknigiгипертензия в системе легочных сосудов. Повышенное гидростатическое давление на фоне увеличенной проницаемости сосудов способствует
вентиляция с использованием высоких концентраций кислорода (FiO свыше 0,6) без контроля
paO2 и paСО2 может приводить к гипероксии, гипокапнии, респираторному алкалозу, на фоне которого развивается выраженный спазм церебральных сосудов с последующей ишемией
. 2
мозга. Значительно ухудшает ситуацию сочетание гипокапнии и метаболического алкалоза, https://tкоторый развивается из-за необоснованно частого использования фуросемида (Лазикса♠).
Высокообъемная ИВЛ с дыхательным объемом 10-12 мл/кг приводит к усилению секреции цитокинов легкими и увеличению тяжести полиорганной недостаточности. Рекомендуемые параметры ИВЛ дыхательный объем - 6 мл/кг, FiO2 менее 0,6, пиковое давление в дыхательных путях не выше 35 мм вод.ст.; давление плато в дыхательных путях не выше 30 мм вод.ст.; неинвертированное соотношение вдоха к выдоху; ПДКВ - подбирают по результатам анализа на графическом дисплее петли «давление-объем». Устанавливаемое ПДКВ должно быть на 2 см вод.ст. выше нижней точки перегиба на петле «давление-объем». У взрослых пациентов обычно уровень ПДКВ устанавливается 10-15 см вод.ст. Необходимо учитывать, что высокие значения ПДКВ могут привести к уменьшению СВ, так как происходит пропорциональное повышение внутригрудного давления и снижение венозного возврата и, следовательно, преднагрузки. Параметры дыхательного цикла подбирают до достижения критериев адекватности ИВЛ: paO2 - больше 60 мм рт.ст., SaO2 - больше 93%, paCO2 - 35-45 мм рт.ст., допустима пермиссивная гиперкапния, которая, однако, имеет ограниченное применение у пациентов с метаболическим ацидозом и повышенным ВЧД.
Введение вазоактивных препаратов. Большое значение имеет своевременность назначения инотропной поддержки. По имеющимся литературным данным, у выживших пациентов инотропная поддержка начата в первые 5 ч после диагностики шокового состояния, у всех погибших - более чем через 10 ч. В связи с этим с 2007 г. в рекомендациях по лечению шока
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi

появилось разрешение на введение в периферические вены кардиоваскулярных препаратов, ранее не назначавшихся до установки центрального венозного доступа.
Допамин - препарат первого ряда у пациентов с резистентным к жидкости шоком. Допамин стимулирует α-, β- и дофаминергические симпатические рецепторы и
оказывает разнообразные эффекты, в том числе на выброс норадреналина. В малых дозах (0,5- 3 мкг/кг в минуту) он первично вызывает расширение сосудов почек, поддерживая почечную
перфузию, уменьшает артериовенозное шунтирование в тканях, повышая периферический кровоток, улучшая коронарноеme/medknigiи брыжеечное кровообращение. Эффекты малых доз
сохраняются и при воздействии на малый круг кровообращения, что способствует ликвидации легочной гипертензии. В средних дозах (3-10 мкг/кг в минуту) проявляется его инотропный эффект с повышением ударного объема и СВ, ЧСС, усиливается сократительная способность миокарда. В такой дозе допамин мало изменяет общее периферическое сосудистое сопротивление; снижает венозный возврат крови к сердцу, т.е. уменьшает преднагрузку, и, расширяя артерии, уменьшает постнагрузку. В больших дозах (1020 мкг/кг в минуту) допамин, обладая преимущественной α-сосудосуживающей активностью, снижает
периферическую и почечную перфузию, повышая постнагрузку на миокард. Преобладает повышение систолического и диастолического АД. Степень, с которой эти эффекты проявляются, индивидуальна, и требуется тщательный мониторинг для оценки ответа пациента на допамин.
Используют также инотропный вазодилататор добутамин в дозе 5-10 мкг/кг в минуту. Добутамин - β1-адренергический агонист с положительным инотропным и хронотропным эффектом, благодаря β2-адреномиметическому действию он расширяет
периферические сосуды в системном и легочном кровообращении, ослабляет спазм легочных сосудов в ответ на гипоксию. В дозах более 10 мкг кг в минуту, особенно у детей младше 2 лет, добутамин может вызвать гипотензию из-за α2-опосредованной блокады освобождения норэпинефрина из пресинапсов. По данным исследования Perkin и соавт., дети до 2 лет слабо отвечают на введение добутамина. Тем не менее основной эффект добутамина (повышение контрактильности) остается неизменным.
Парасимпатомиметики (атропин) при лечении шока у детей обычно бесполезны, хотя и повышают чувствительность.к эндогенным и экзогенным катехоламинам, особенно при восстановлении сердечной деятельности через фазу медленного ритма. В настоящее
время атропин используют для снижения бронхореи при введении кетамина. Использование https://tпрепаратов кальция (кальция хлорид, кальция глюконат) для стимуляции сердечной
деятельности, еще недавно применявшихся традиционно в практике реанимации, в настоящее время представляется сомнительным. Только при гипокальциемии препараты кальция дают отчетливый инотропный эффект. При нормокальциемии внутривенное болюсное введение кальция вызывает лишь возрастание периферического сопротивления, способствует усилению неврологических расстройств на фоне ишемии мозга.
Сердечные гликозиды, такие как дигоксин, строфантин-К, коргликон, способны улучшать показатели кровообращения при шоке благодаря положительному влиянию на СВ и хронотропному эффекту. Однако при развитии ОСН и аритмии при шоке сердечные гликозиды не должны быть препаратами первого ряда в связи с их способностью увеличивать потребность миокарда в кислороде, вызывая тканевую гипоксию и ацидоз, что резко снижает их терапевтическую эффективность и усиливает вероятность интоксикации.
Коррекция метаболических нарушений позволяет улучшить функцию миокарда и других клеток, снизить системное и легочное сосудистое сопротивление, уменьшить необходимость в респираторной компенсации метаболического ацидоза. Следует помнить, что метаболический ацидоз - лишь симптом болезни, и поэтому все усилия должны быть направлены на устранение этиологического фактора, нормализацию гемодинамики, улучшение почечного кровотока, устранение гипопротеинемии, гипо- и гипергликемии путем введения Глюкозы♠, инсулина. Сохраняющийся на фоне терапии шока ацидоз с признаками недостаточной перфузии тканей может указывать на неадекватность терапии или продолжающуюся
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi

кровопотерю (при геморрагическом шоке). Целенаправленно коррекцию КОС путем введения буферных растворов следует проводить только после устранения гиповолемии и гипогликемии при наличии декомпенсированного ацидоза при pH меньше 7,25 и в случае метаболического ацидоза с низким анионным интервалом, связанного с большими почечными и желудочно-кишечными потерями бикарбонатов. При шоке коррекцию ацидоза натрия гидрокарбонатом следует проводить осторожно, так как перевод ацидоза в алкалоз ухудшает
причиной внутричерепных кровоизлияний, особенно у новорожденных и недоношенных детей. У детей первых месяцев жизни нагрузка натрием не компенсируется усилением натрий-уреза, задержка натрия ведет к развитию отеков, в том числе к отеку мозга. Натрия гидрокарбонат вводят медленно внутривенно, в дозе 1-2 ммоль/кг. У новорожденных используют раствор в концентрации 0,5 ммоль/мл, чтобы избежать острого изменения осмолярности крови. Часто больному требуется 10-20 ммоль/кг для того, чтобы корригировать глубокий ацидоз. Назначение натрия гидрокарбоната допустимо при смешанном дыхательном и метаболическом ацидозе на фоне ИВЛ. Для коррекции метаболического ацидоза также показано использование трометамола (Трисамина♠), эффективного буфера, устраняющего вне- и внутриклеточный ацидоз. Его используют в дозе 10 мл/кг в час с добавлением в раствор натрия хлорида, калия хлорида и декстрозы (Глюкозы♠), так как трометамол (Трисамин♠) увеличивает выведение натрия и калия из организма. Новорожденным вводят трометамол (Трисамин♠) с добавлением только Глюкозы♠. Трометамол(Трисамин♠) не показан при центральных расстройствах дыхания и анурии. Уровень гликемии необходимо поддерживать в пределах 80-120 мг/дл (4,4-6,6 ммоль/л). Гипогликемию устраняют инфузией Глюкозы♠ со скоростью 8 мл/кг в минуту у новорожденных, 5 мл/кг в минуту у детей и 2 мл/кг в минуту у подростков. Гипергликемия в сочетании с высоким анионным интервалом служит показанием для назначения инсулина в дозе 0,5-1 ЕД/кг в час. Контроль уровня гликемии проводят ежечасно.
кислородтранспортные свойства крови из-за смещения кривой диссоциации оксигемоглобина влево и способствует накоплениюme/medknigiнатрия в организме, особенно при сниженной перфузии почек. Возникает опасность развития гиперосмолярного синдрома, который может быть
На протяжении многих.лет терапия стероидными гормонами широко применялась при
лечении шока. Наиболее часто используют гидрокортизон, преднизолон и дексаметазон.
https://tТеоретическая основа стероидной терапии - многообразие эффектов, включающих повышение СВ. ГК обладают стабилизирующим влиянием на активность лизосомальных
ферментов, антиагрегационным влиянием на тромбоциты, положительным воздействием на транспорт кислорода. Антигипотензивное действие вместе с мембраностабилизирующим и противоотечным эффектами, а также влияние на микроциркуляцию и торможение высвобождения лизосомальных ферментов составляют основу их противошокового действия и способности предупреждать развитие полиорганной недостаточности. При СШ применяют гидрокортизон при абсолютной адреналовой недостаточности. В современных исследованиях с высоким уровнем доказательности установлено, что:
• использование ГК в высоких дозах (метилпреднизолона, дексаметазона, бетаметазона) в терапии СШ нецелесообразно в связи с отсутствием влияния на летальность и увеличением риска госпитальных инфекций;
• добавление гидрокортизона в указанных дозах на протяжении 5-7 дней к комплексу терапии СШ позволяет ускорить момент стабилизации гемодинамики, отмены кардиотонической поддержки и снизить летальность в популяции больных с сопутствующей надпочечниковой недостаточностью.
Необходимо отметить особенности терапии отдельных типов шока.
Пациентам с ожогами для восполнения потерь жидкости в первые 24 ч рекомендовано использовать раствор калия хлорид + кальция хлорид + магния хлорид + натрия лактат + натрия хлорид (Рингера-лактат с магнием♠) в дозе 20 мл/кг для первого болюса, поскольку он
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi

содержит физиологические концентрации основных электролитов и снижает риск гиперхлоремического ацидоза. Объем вводимой жидкости для восполнения потерь для детей старше 6 лет можно рассчитать по формуле Parkland:
• 4 мл/кг х % ожога.
• Для детей младше 6 лет рассчитывают по формуле Carvejal:
Половину жидкости вводят за первые 6 ч.
• 5000 мл/м2/% ожога. me/medknigi
При гиповолемическом шоке, связанном с травмой или внутренним кровотечением, необходим тщательный осмотр пациента для поиска возможного кровотечения и его устранения, после чего продолжают внутривенное введение жидкости.
При кардиогенном шоке первый болюс объемом не более 5-10 мл/кг вводят менее чем за 20 мин. Необходимо раннее применение инотропных препаратов. Добутамин - препарат выбора при лечении кардиогенного шока, поскольку оказывает инотропное влияние на сердце и снижает постнагрузку, вызывая периферическую вазодилатацию. Допамин также эффективен при лечении кардиогенного шока у детей, но предпочтение отдают добутамину. При высоких дозах допамин вызывает вазоконстрикцию. Используют ингибиторы фосфодиэстеразы для лечения кардиогенного шока при высоком общем периферическом сосудистом сопротивлении.
Восстановление ударного объема и тканевой перфузии происходит после перикардиоцентеза и дренирования полости перикарда при тампонаде сердца, пункции и дренирования плевральной полости при напряженном пневмотораксе, проведения тромболитической терапии (урокиназой, стрептокиназой или алтеплазой) при тромбоэмболии легочных артерий, поскольку с помощью жидкости и инотро-пов можно обеспечить лишь временную стабилизацию состояния. Немедленная непрерывная круглосуточная инфузия простагландина E1 или E2 у новорожденных с дуктус-зависимыми пороками сердца предотвращает закрытие артериального протока, что при таких пороках сохраняет им жизнь. При функционирующем артериальном протоке и подозрении на дуктус-зависимый порок введение вазаспростана (Простина♠0) начинают.с низких доз - 0,005-0,015 мкг/кг в минуту. В случае когда есть признаки закрытия открытого артериального протока или он достоверно закрыт, инфузия
начинается с максимальной дозы - 0,05-0,1 мкг/кг в минуту, после открытия протока дозу https://tснижают до 0,005-0,015 мкг/кг в минуту.
Особенность лечения нейрогенного шока у детей - частое отсутствие положительной динамики на введение жидкости. В связи с этим необходимо использовать вазоактивные препараты с α-адренергическим действием.
Выбор соотношения кристаллоидных и коллоидных растворов при проведении инфузионной терапии у больных сепсисом зависит от оценки конкретной клинической ситуации и понимания задач лечения.
Задачи инфузионной терапии при сепсисе
Поддержание и восстановление циркулирующего объема и стабильности гемодинамики.
Восстановление нормального распределения жидкости.
Поддержание адекватного мочеотделения.
Улучшение микроциркуляции и доставки кислорода к тканям.
Предотвращение активации каскадных систем, в том числе коагуляции.
Профилактика реперфузионных повреждений.
Адекватное питание.
Еще больше книг на нашем telegram-канале MEDKNIGI https://t.me/medknigi
