
2 курс / Гистология / ФУНКЦИОНАЛЬНАЯ_И_КЛИНИЧЕСКАЯ_МОРФОЛОГИЯ_ЯИЧНИКОВ
.pdfСтадия полового цикла определялась по влагалищным мазкам (Кабак Я.М., 1968) и содержанию в крови прогестерона и эстрогенов (Журавлева Т.Б. и
др., 1976).
Забой животных осуществлялся в одно и тоже время суток (9-10 часов)
передозировкой нембутала (50 мг/кг).
С целью предварительной оценки качественного состояния фолликулов использованы методы, ранее апробированные другими исследователями
(Волкова О.В., 1983; Далмане А.Р., 1967). Для идентификации стадии развития фолликулов использована Международная гистологическая номенклатура
(1983).
Во время работы применен комплекс гистологических, гистохимических,
флуоресцентно-микроскопических, морфометрических методов исследования.
Общегистологические методы: окраска гематоксилин-эозином, окраска железным гематоксилином по Гейденгайну.
Гистохимические методы:
-окраска альциановым синим-сафранином в прописи Desaga (Гордон Д.С. и др., 1982; Desaga J. e.a., 1971) для выявления гликозаминогликанов;
-выявление липидов суданом чёрным, т.к. липидные компоненты структур часто бывают субстратом связывания биоаминов (Atheé L., Jonsson S., 1974).
Флуоресцентно-гистохимические методы, их параметрическое и статистическое обеспечение
Флуоресцентно-гистохимический метод А.Бъёрклунда (1972) в
модификации В.Н.Швалёва и Н.И.Жучковой (1987) явился в нашем исследовании основным методом для избирательного выявления симпатических нервных и других биоаминпозитивных структур яичника. При воздействии глиоксиловой кислоты катехоламины и индоламины образуют интенсивно флуоресцирующие соединения. Глиоксиловая кислота вызывает,
161

кроме того, сильную флуоресценцию N-ацетилированных индоламинов,
метоксилированных катехоламинов и триптофанили ДОФА-содержащих пептидов на NH2- или COOHконце. Эти соединения не выявляются с помощью стандартного метода Фалька-Хилларпа (Луппа Х., 1980).
Криостатные срезы толщиной 20 мкм из свежего нефиксированного материала высушивались под струёй тёплого воздуха (T=45оС) в течение 5
минут, обрабатывались раствором глиоксиловой кислоты, pH инкубационного раствора составляла при этом 7,0 для одномоментного выявления 5-
окситриптамина и катехоламинов (Furness J.B., Costa M., 1975). Срезы изучались с помощью микроскопа ЛЮМАМ-И3 с набором светофильтров,
адекватных режиму флуоресценции биоаминов (ЖС-18, ФС 1-2, СЗС 24-4, БС
8-3).
Часть материала обработана по параформальдегидному методу Фалька-
Хилларпа в модификации Е.М.Крохиной (1969). Метод основан на реакции моноаминов с парообразным параформом, в ходе которой образуются флуоресцирующие соединения (производные 3-4-, 6-7-гидрокси- и 3-4-
дигидроизохинолина), свечение которых идентифицировано с флуоресценцией индол- и катехоламинов (Гордон Д.С. и др., 1982). Образующиеся в результате реакции соединения образуют люминесцирующий комплекс, дающий ярко-
зелёную флуоресценцию. Карболины, которые в подобных реакциях формируют серотонин, светятся белым и жёлтым цветом.
Фотометрическая установка ФМЭЛ-1А, соединённая с регистрирующим прибором, с помощью отрезных интерференционных фильтров позволяет дифференцировать альдегидиндуцированное свечение серотонина и катехоламинов, а также по замерам интенсивности флуоресценции судить об их количественном содержании в структурах.
Для сочетанного изучения поглотительных и флуоресцентно-
гистохимических свойств макрофагов нами проведено флуоресцентно-
гистохимическое исследование материала после предварительного прижизненного введения морским свинкам подкожно трипанового синего.
162
Наличие в клетках гранул краски свидетельствует об их макрофагической способности.
Проверка специфичности реакции проведена предварительным введением внутрибрюшинно 5 мг/кг веса резерпина за 24 часа до забоя животных (Гордон Д.С. и др., 1982; Мельникова Л.М., 1979).
Морфометрический и количественный микроспектральный анализы биоаминпозитивных структур производился по следующим основным параметрам (Виноградов С.Ю., 1989; Виноградов С.Ю., Диндяев С.В., 1988;
Диндяев С.В., 1990):
-пространственная и удельная плотности периваскулярных сплетений и терминалей;
-среднее количество макрофагов в поле зрения;
-средняя пространственная плотность нервных волокон в поле зрения;
-относительное содержание серотонина и катехоламинов в варикозных расширениях и межварикозных участках симпатических терминалей и периваскулярных сплетений коркового и мозгового веществ, теки фолликулов, оболочки и паренхимы жёлтого тела.
Тестирование флуоресценции изучаемых структур осуществлялось зондами 0,1 (для элементов нервных волокон) и 0,5 (для макрофагов) с
интерференционными фильтрами «8» (длина волны пропускания 525 нм) и «6» (длина волны – 480 нм), что позволило микроспектрофлуориметрически идентифицировать соответственно альдегидиндуцированное свечение серотонина и катехоламинов, а по интенсивности флуоресценции судить об их содержании в исследуемых структурах (Гордон Д.С. и др., 1982; Виноградов С.Ю., 1989; Мотавкин П.А. и др., 1985; и др.). Замер интенсивности свечения производился в условных единицах шкалы регистрирующего прибора. С
помощью зонда 0,5 получали первичную цифровую информацию о биоаминовом статусе макрофагов.
163

Всего в ходе исследования было использовано более 490 основных и вспомогательных параметров оценки биоаминпозитивных структур яичников, а
число вариант первичных измерений основных параметров составило 33 400.
С целью оценки эндокринной функции яичников производилось радиоиммунологическое определение в сыворотке крови животных прогестерона и эстрогенов.
Оценка достоверности различий при сравнении средних величин осуществлялась с помощью непараметрических критериев Колмогорова-
Смирнова и Вилкоксона-Манна-Уитни (Гублер Е.В., Генкин А.Л., 1973; Зайцев Г.Н., 1984).
Для выявления и оценки внутри- и межрегиональных сопряжений изменений оценочных параметров биоаминпозитивных структур яичников применялся метод рангового корреляционного анализа Спирмена. Он же оказался адекватным при выявлении и анализе хроносопряжений гормонпродукции яичников с динамикой биогенных аминов. Минимальные достоверные значения показателя корреляции рангов в наших случаях 0,8 (р < 0,05) (Зайцев Г.Н., 1984).
В результате проведенных исследований в тканях яичников нами выявлены структуры, содержащие нейромедиаторные биогенные амины
(катехоламины и серотонин): периваскулярные сплетения, терминали,
макрофаги, тучные клетки.
Наши исследования в совокупности с другими работами (Виноградов С.Ю., 1987, 1989; Виноградов С.Ю., Погорелов Ю.В., 1993; Леонтюк Л.А., 1977,1982) позволили выделить в яичнике своеобразный структурно-
функциональный комплекс внутриорганного нейромедиаторного обеспечения
(ВКБО – внутриорганный комплекс биоаминового обеспечения). К его основным структурным элементам, участвующим в синтезе, захвате,
функциональной реализации, накоплении, транспорте, инактивации серотонина и катехоламинов, мы относим периваскулярные симпатические сплетения,
симпатические терминали, макрофаги, тучные клетки, сеть кровеносных
164
капилляров с приносящими и выносящими сосудами. Таким образом,
указанный комплекс представляет собой динамическую кооперацию сопряженных с обменом нейромедиаторных биоаминов гетерогенных и гетероморфных элементов, интегрированных на выполнение яичниками органоспецифической функции: созревание и выделение ооцитов, выработку половых стероидных гормонов (Диндяев С.В., Погорелов Ю.В., 1993).
Установлено, что характер биоаминового обмена в ВКБО соответствует рабочим потребностям основных структур яичника. Так, в варикозных расширениях и межварикозных участках нервных волокон теки фолликулов по мере их приближения к преовуляторному состоянию отмечается значительное увеличение содержания исследуемых нейромедиаторов (Диндяев С.В., 1990;
Леонтюк Л.А., 1977).
Симпатические терминали, как показали люминесцентно-
микроскопические исследования, имеют прямую топографическую связь с периваскулярными сплетениями, разветвлениями и продолжениями которых они являются (Диндяев С.В., Погорелов Ю.В., 1993; Леонтюк Л.А., 1977, 1982).
Более значительная динамика содержания нейромедиаторов в варикозных расширениях по сравнению с межварикозными участками подтверждает утверждения ряда исследователей, рассматривающих варикозы как активные структуры, выполняющие функции накопления, синтеза и сохранения медиаторов (Бэрнсток Д., Коста М., 1979; Фурдуй Ф.Н., 1981).
В топографической близости с симпатическими волокнами, особенно периваскулярными, выявляются макрофаги, дающие положительные реакции на серотонин, катехоламины и липидсодержащие комплексы. При флуоресцентном анализе после прижизненного введения трипанового синего нами выделены три группы макрофагов:
1)с выраженными фагоцитарными свойствами и низким содержанием биоаминов;
2)с высоким содержанием нейромедиаторов и низкой фагоцитарной
активностью;
165

3) переходная.
Эти группы макрофагов, по-видимому, не являются самостоятельными разновидностями, а представляют собой клетки, находящиеся в различных функциональных состояниях, или клетки, подвергающиеся возрастным изменениям. Одной из функций макрофагов является поглощение биоаминов
(Гордон Д.С. и др., 1974, 1982). Поглощённые биогенные амины в цитоплазме клеток присоединяются к различным группам липопротеидов с различной прочностью химических связей. Возможно, что в результате фиксации моноаминов на липидсодержащие комплексах со временем здесь накапливается метаболит катехоламинов меланин, превращая весь комплекс в липофусцин,
продолжающий фиксировать всё большие порции моноаминов (Гордон Д.С. и
др., 1974).
Мы считаем, что тканевые макрофаги захватывают неиспользованные
«остатки» биоаминов для резервации, инактивации и транспортировки в другие участки яичников. Частое расположение макрофагов около симпатических волокон и кровеносных сосудов свидетельствует о тесной рабочей кооперации этих структурных элементов ВКБО.
а б Рис. 16. Периваскулярные сплетения мозгового вещества яичников
кошек. Метод А.Бъёрклунда в модификации В.Н.Швалева и Н.И.Жучковой. Микроскоп ЛЮМАМ-И3, об.90, МФН-10, гомаль 3.
Симпатическая иннервация примордиальных фолликулов относительно менее развита по сравнению с фолликулами других классов. Обнаружение нами в яичниках кошек двух зон примордиальных фолликулов – с активным нейромедиаторным обменом и относительного покоя – позволяет расценивать первую как зону активного роста примордиальных фолликулов,
166

осуществляющую в данном цикле «поставку» основного количества фолликулов для дальнейшего роста и развития (см. рис. 16-20). Возможно, что в последующем цикле эти зоны «меняются ролями», т.е. в зоне относительного покоя усиливаются процессы биоаминового обмена, а в первой, наоборот,
снижаются.
|
а |
б |
Рис. 17. |
Симпатические терминали коркового вещества яичников |
|
кошки (а) и |
морской свинки (б). Метод |
А.Бъёрклунда в модификации |
В.Н.Швалева и Н.И.Жучковой. Микроскоп ЛЮМАМ-И3, об.90, МФН-10, гомаль 3.
Обнаружение нами нескольких зон примордиальных фолликулов с различным уровнем биоаминового обеспечения подтверждается другими исследователями (Волкова О.В., 1983; Черняева Л.К., 1984), наблюдения которых показали, что фолликулы вступают в фазу роста не изолированно, а
группами, расположенными в участках реактивно перестроенной стромы.
Известно, что в быстро растущих и дифференцирующихся зонах соединительной ткани ускоренно накапливаются биохимические активные соединения, обеспечивающие размножение и дифференцировку клеток
(Шаповалов Ю.Н., 1980). Обнаруженные локальные сдвиги в изменении уровня биоаминового обеспечения в зонах роста подтверждают положение об активном участии в росте фолликулов нейромедиаторов. Одновременно в фолликулярных клетках происходит становление специфических рецепторов ФСГ, эстрогенов и андрогенов, что определяет чувствительность клеток к соответствующим гормонам (Зеленецкая В.С., 1986).
167
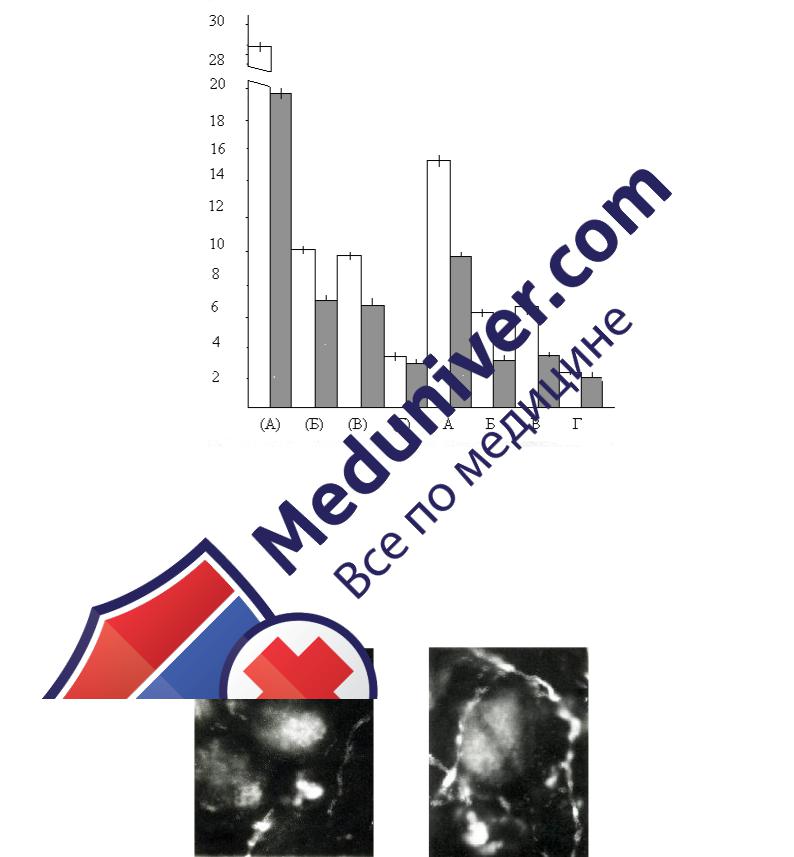
Рис. 18. Уровень биоаминов в нервных волокнах различных зон примордиальных фолликулов яичника кошки (в усл. ед.).
Незаштрихованные колонки соответствуют данным по 1 зоне, заштрихованные
– по 2 зоне. А – содержание серотонина в варикозных расширения, Б – содержание катехоламинов в варикозных расширениях, В – содержание серотонина в межварикозных расширениях, Г – содержание катехоламинов в межварикозных расширениях. ( ) – принадлежность к периваскулярным сплетениям, без скобок – терминали.
а |
б |
Рис. 19. Симпатическая иннервация 1 зоны примордиальных фолликулов яичников кошки. Метод А.Бъёрклунда в модификации В.Н.Швалева и Н.И.Жучковой. Микроскоп ЛЮМАМ-И3, об.90, МФН-10, гомаль 3.
168

а |
б |
Рис. 20. Симпатическая иннервация 2 зоны примордиальных фолликулов яичников кошки. Метод А.Бъёрклунда в модификации В.Н.Швалева и Н.И.Жучковой. Микроскоп ЛЮМАМ-И3, об.90, МФН-10, гомаль 3.
С началом формирования полости фолликула у морских свинок и кошек значительно возрастает, по нашим данным, плотность периваскулярных сплетений теки, всё большее количество терминалей подходит к гормонпродуцирующим клеткам.
Для полостного фолликула, как известно, характерно формирование внутренней теки, важной особенностью которой является её богатая васкуляризация, что обеспечивает тесный индивидуальный контакт каждого полостного фолликула с гормонами периферической крови (Зеленецкая В.С.,
1986).
На каждой стадии развития, начиная с первичной, нами выделены фолликулы, отличающиеся от других более высоким содержанием серотонина и катехоламинов во всех элементах ВКБО. Можно предположить, что это доминантные фолликулы. Мы не исключаем, что на способность доминантного фолликула связывать ЛГ определённое влияние благодаря своему воздействию на цАМФ оказывают и биогенные амины. Возможно, что они влияют на чувствительность рецепторов к ФСГ и ЛГ. Более высокому биоаминовому обеспечению таких фолликулов способствует значительно бóльшая васкуляризация их теки (diZerega G.S., Holgen G.D., 1981). В пользу участия биоаминов в отборе доминантного фолликула свидетельствуют результаты и
других исследований (Dyer C., Erickson G.F., 1985). 169

Рис. 21. Динамика плотности периваскулярных сплетений
внутренней теки фолликулов в процессе их роста
x – площадь флуоресцирующего профиля сосудов, y – пространственная плотность периваскулярных сплетений, w – удельная плотность периваскулярных сплетений
фп – фолликул первичный, фв – фолликул вторичный, фт – фолликул третичный
В третичных фолликулах нами отмечена флуоресценция нервных волокон в базальных слоях фолликулярного эпителия и яйценосном бугорке,
отсутствовавшая на предыдущих стадиях развития фолликула. Данное явление может быть объяснено активным включением на этой стадии развития фолликула в образование гормонов клеток зернистого слоя, их железистым метаморфозом (Журавлева Т.Б. и др., 1976; Зеленецкая В.С., 1986). Ряд исследователей (Леонтюк Л.А., 1977, 1982) связывает флуоресценцию нервных волокон в зернистом слое с врастанием их из теки. Мы предполагаем, что уже на ранних стадиях формирования зернистого слоя фолликула в нём имеются нефункционирующие, так называемые «молчащие» нервы. Реальность существования нефлуоресцирующих нервных волокон из-за отсутствия в них нейромедиаторов доказана для ряда органов (Виноградов С.Ю., 1989; Танюшев К.Г. и др., 1987; Швалёв В.Н., Стропус Р.А., 1979). В преовуляторный период
«молчащие» нервы, по нашему мнению, активизируются и в данной рабочей ситуации начинают пропускать дополнительные объёмы биоаминов. И только
170
