
2 курс / Гистология / Врожденные_пороки_сердца_Зиньковский_М_Ф_,_Возианов_А_Ф_ред_
.pdf212 |
Часть 3. ОТКРЫТЫЕ И ЗАКРЫТЫЕ ОПЕРАЦИИ |
|
|
|
|
Методика проведения ЭКМО
ЭКМО или МПЖС? Метод ЭКМО широко ис пользовался в практике лечения дыхательных расстройств новорожденных. У взрослых приме нялись аортальная контрапульсация, искусствен ные желудочки сердца и искусственное сердце. С появлением центрифужных насосов стало воз можным использование их в качестве искусствен ных желудочков и у детей массой менее 5 кг. При водим сравнительную характеристику этих двух методов (таблица 1).
Таблица 1. Сравнительная характеристика ЭКМО и VAD
Показатели |
ЭКМО |
МПЖС |
|
|
|
Тип насоса |
Роликовый |
Центрифужный |
|
|
|
Оксигенатор |
Да |
Нет |
|
|
|
Заполнение |
Большой объем |
Малый объем за% |
контура |
заполнения |
полнения |
|
|
|
Риск воздуш% |
Малый |
Больше |
ной эмболии |
|
|
|
|
|
Антикоагуля% |
АВС около |
АВС около |
ция |
180–200 с |
140–160 с |
|
|
|
Канюляция |
Возможна каню% |
Канюляция маги% |
|
ляция сосудов |
стральных сосу% |
|
шеи или магист% |
дов, грудина не |
|
ральных сосудов |
сведена |
|
при открытой |
|
|
грудной клетке |
|
|
|
|
Открытое |
Не влияет на SaO2 |
Вероятность деса% |
овальное окно |
|
турации |
|
|
|
Если принято решение о проведении вспомога тельного кровообращения в операционной, ис пользуют канюли для ИК. Если же механическая поддержка кровообращения будет осуществляться в послеоперационном периоде, для ЭКМО можно катетеризировать сосуды шеи, а для подключения МПЖС нужен доступ в средостение. При катете ризации магистральных сосудов в средостении грудную клетку оставляют открытой. У детей стар шего возраста может быть закрыта кожа, при этом грудину не сводят.
При проведении ЭКМО необходимы совмест ные усилия множества специалистов и наличие отдельной дежурной бригады, занятой исключи тельно наблюдением за пациентом, находящемся на ЭКМО. Бригада, осуществляющая также наб людение, должна состоять из врача, проводящего общее лечение пациента, врача, обученного при менению ЭКМО, перфузиолога, отвечающего за функцию АИК, и индивидуальной медицинской сестры. Начало применения ЭКМО и ее оконча
ние, т.е. канюляцию и деканюляцию, проводят опытные врачи хирурги или кардиохирурги. Каж дая процедура ЭКМО должна находиться под контролем определенного лица, отвечающего за программу ЭКМО в целом.
В принятии решения о применении ЭКМО участвуют все лица, которые будут проводить про цедуру. Существует два типа канюляции сосудов для подключения к аппарату (16):
1)вено венозная канюляция — применяется при изолированной дыхательной недостаточности (без сердечной недостаточности). Наиболее часто ее используют у новорожденных. Выбор сосуда и размер канюль определяют хирурги совместно с врачом, проводящим ЭКМО;
2)артериовенозная канюляция — применяется при дыхательной недостаточности, протекаю щей на фоне нестабильной гемодинамики. При ее выполнении можно использовать выведен ные через грудную стенку канюли, которые бы ли применены во время основной операции, или канюлировать сосуды шеи или бедра.
При артериовенозной канюляции кровь из ве нозной системы при помощи насоса поступает в оксигенатор и возвращается в организм, минуя сердце. Эта схема не всегда дает положительный эффект, так как напряжение стенок левого же лудочка и потребность в кислороде повышают ся, в то время как коронарный кровоток умень шается. Кровь, поступающая в коронарные ар терии, характеризуется пониженным содержа нием кислорода и поэтому усугубляется исход ная гипоксия миокарда. В течение первых 12 ч ЭКМО отмечается значительное ухудшение сократимости миокарда. При этом снижается сердечный выброс, растягивается левое пред сердие и нарастают явления отека легких. В
этой ситуации необходима декомпрессия левого желудочка сердца — при открытой грудной клетке дренируют левое предсердие, а при зак рытой грудной клетке выполняют чрескожную баллонную септостомию. В последующем шунт присоединяют к канюле, дренирующей веноз ную кровь. Эта процедура позволяет снизить потребность миокарда в кислороде и улучшить миокардиальный кровоток (25).
Аппарат ЭКМО состоит из мембранного окси генатора типа AVECOR, обеспечивающего окси генацию крови, роликового насоса, теплообмен ника, подогревающего кровь, системы магистра лей с датчиками давлений и температуры.
Роликовый насос автоматически управляется различными системами. Наиболее часто применя ется система управления с помощью преобразова

Глава 16. ИСКУССТВЕННОЕ КРОВООБРАЩЕНИЕ С ГИПОТЕРМИЕЙ У ДЕТЕЙ РАННЕГО ВОЗРАСТА |
213 |
|
|
|
|
телей давления, которые позволяют при сниже нии венозного возврата снижать производитель ность насоса и уменьшать скорость кровотока в системе оксигенации. Для полной оксигенации пациента скорость кровотока обычно равна 100 мл/кг/мин. Уровень СО2 в крови регулируется ко личеством кислорода, проходящего через оксиге натор. При помощи теплообменника у пациента поддерживается нормотермия. Общее ведение па циента при применении ЭКМО в целом не отли чается от общепринятой интенсивной терапии, с незначительными модификациями. Искусствен ную вентиляцию легких осуществляют в режиме с низким пиковым давлением вдоха, повышенным давлением в конце вдоха и низким содержанием кислорода в дыхательной смеси. Чаще, чем обыч но, проводят рентгенографию органов грудной клетки, газовый анализ крови и определение кис лотно основного баланса.
Объем введения жидкости при проведении ЭКМО зависит от клинического состояния паци ента, степени восполнения ОЦК и результатов до полнительных методов исследований. Периоди чески к магистралям ЭКМО присоединяют гемо фильтрирующее устройство (18).
Терапия ЭКМО требует проведения длитель ной гепаринизации. Высокая стоимость ЭКМО обусловлена необходимостью переливания боль шого количества препаратов крови, в том числе ежедневной инфузии тромбоцитарной массы, применения антитромбина ІІІ, частого контроля свертывающей системы и морфологического ана лиза элементов крови (19).
При проведении ЭКМО новорожденные и дети младшего возраста должны находиться в состоя нии глубокого наркоза с периодической миоре лаксацией. У детей старшего возраста и взрослых достаточно применение легкой седации с перио дическим введение анальгетиков при выполнении болезненных или неприятных манипуляций.
Мониторинг состояния нервной системы за ключается в выполнении регулярной ультрасоног рафии головы у новорожденного либо ЭЭГ у взрослых и детей старшего возраста. В целях про филактики септических осложнений применяют ванкомицин, а при подозрении или наличии ин фицирования выполняют целый комплекс диаг ностических исследований и проводят целена правленную антибиотикотерапию.
Ведение пациентов, находящихся на вспомогательном кровообращении
Пациентам, находящимся на ЭКМО, обычно проводят ИВЛ в минимальном объеме. В отличие от них пациенты, которым применяют лево или правожелудочковый обход, требуют тщательной оптимизации режимов вентиляции. Инотропная поддержка минимальна в обеих группах. Пациен ты полностью релаксированы и седированы в те чение всего времени вспомогательного кровооб ращения.
Методика ЭКМО похожа на методику ИК. Обя зательно использование роликового насоса. Ве нозный возврат происходит под действием силы тяжести в венозный резервуар (рис. 1). В контуре обязательно наличие мембранного оксигенатора.
Для право или левожелудочкового обхода обычно используют центрифужный насос (Biomedicus, Jostra). Производительность насоса зависит от пред и постнагрузки. Венозный возв рат к насосу активен и не зависит от силы тяжести.
При вспомогательном кровообращении конт ролируют следующие параметры:
•ЭКГ;
•температуру тела;
•давление в левом и правом предсердиях;
•давление в легочной артерии;
•АД;
•газовый состав крови;
•капиллярное насыщение крови (пульсоксимет рия);
•диурез.
Рис. 1. Схема контура ЭКМО
214 |
Часть 3. ОТКРЫТЫЕ И ЗАКРЫТЫЕ ОПЕРАЦИИ |
|
|
|
|
Объемная скорость вспомогательного кровооб ращения зависит от степени нарушения функции миокарда. Среднее АД должно поддерживаться на уровне 40 мм рт.ст. у новорожденных и детей пер вого года жизни, 60 мм рт.ст — у детей старшего возраста. При право или левожелудочковом обхо де давление в предсердиях поддерживают не ниже 5 мм рт. ст. для предотвращения попадания возду ха в контур. Это особенно важно для пациентов с левожелудочковым обходом, у которых попадание воздуха в круг циркуляции может привести к эм болии сосудов мозга и коронарных артерий. У па циентов с левожелудочковым обходом давление в правом предсердии поддерживают на уровне 5–10 мм рт.ст.; высокие уровни правопредсердного дав ления обычно свидетельствуют о нарушении функции правого желудочка.
У пациентов с одножелудочковым сердцем и функционирующим системно легочным анасто мозом последний во время ЭКМО должен быть закрыт для предотвращения перегрузки малого круга кровообращения, перерастяжения левых от делов сердца и отека легких.
Мониторируют обычные клинические показа тели адекватности сердечного выброса. Регулярно проверяют показатели газового состава крови, электролиты, уровень гемоглобина и гематокрита.
Системную гепаринизацию поддерживают на уровне АВС в диапазоне 140–160 с. АВС первона чально контролируют каждые 30 мин, затем каж дые 3 ч. Количество тромбоцитов поддерживают на уровне выше (120–150)•103/мм3, а уровень фибриногена — выше 15 мг%. Дополнительно пе реливают аминокапроновую кислоту, антитром бин III и свежезамороженную плазму (45). Конт ролируют наличие гемолиза и синдрома диссеми нированного внутрисосудистого свертывания. Ге матокрит поддерживают на уровне 30%, темпера туру тела — в пределах 35–37 0C.
При проведении ЭКМО стараются как можно быстрее снизить дозу вводимых катехоламинов, так как они способствуют повышению чувстви тельности β рецепторов. Целесообразно приме нять небольшую дозу допамина для повышения сократимости миокарда и сердечного выброса.
Ежедневно проводят клиническую неврологи ческую оценку. У новорожденных и детей первого года жизни выполняют нейросонографию. Значи тельные нарушения со стороны ЦНС иногда тре буют досрочного отлучения от вспомогательного кровообращения.
Часто встречающиеся проблемы при проведении левожелудочкового обхода:
• низкое левопредсердное давление вследствие
гиповолемии, правожелудочковой недостаточ ности, чрезмерная производительности насоса;
•высокое левопредсердное давление из за недос таточной производительности насоса, открыто го овального окна или септального дефекта;
•низкое правопредсердное давление вследствие малого объема циркулирующей крови, откры того овального окна или наличия септальных дефектов;
•высокое правопредсердное давление, обуслов ленное объемной перегрузкой, нарушением функции правого желудочка;
•невозможность поддержания адекватной произ водительности из за гиповолемии, смещения канюль, тромбоза канюль или насоса, перегиба канюль или трубок;
•метаболический ацидоз, являющийся следстви ем неадекватной производительности, гипово лемии, повреждения внутренних органов (пече ни, кишечника);
•гипоксия как проявление легочных проблем, открытого овального окна или наличия септаль ных дефектов;
•кровотечение вследствие передозировки гепа рина, ДВС синдрома, смещения канюль, нали чия хирургических источников.
Выход из вспомогательного кровообращения. Ре шение об отлучении пациента от вспомогательно го кровообоащения принимают после тщательной оценки гемодинамических показателей и данных, полученных при ЭхоКГ. Оптимизируют дозы инотропной поддержки и постепенно снижают производительность вплоть до прекращения меха нической поддержки. Проводят тщательный мо ниторинг адекватности сердечного выброса. Груд ную клетку оставляют открытой (не сводят груди ну) в течение 1–2 сут после окончания вспомога тельного кровообращения.
Осложнения при вспомогательном кровообраще нии. Наиболее частые осложнения — кровотече ние и эмболия. Небольшая кровоточивость часто связана с использованием антикоагулянтов или коагулопатией. Хирургические источники крово течения должны быть исключены в первую оче редь. Массивные кровотечения часто бывают фа тальными. Переливания препаратов крови могут вызывать нарушения функции легких.
Неврологические осложнения, такие, как внут ричерепные кровоизлияния или эмболии мозго вых сосудов, нередки. Тем не менее они не явля ются показанием к отлучению от вспомогательно го кровообращения. Среди прочих осложнений следует отметить почечную недостаточность, ин фекцию и механические повреждения контура.
Глава 16. ИСКУССТВЕННОЕ КРОВООБРАЩЕНИЕ С ГИПОТЕРМИЕЙ У ДЕТЕЙ РАННЕГО ВОЗРАСТА |
215 |
|
|
|
|
|
|
|
Данные различных клиник показывают, что |
дикальной коррекции тетрады Фалло) и пациентов |
|
при использовании ЭКМО у пациентов после опе |
с сердечной недостаточностью на фоне инфекци |
|
раций в условиях ИК выживаемость приближается |
онной кардиомиопатии составляет 42%. Выживае |
|
к 46%. У большинства этих пациентов нет ослож |
мость в группе пациентов, у которых легочной кро |
|
нений со стороны других органов и систем. Эти ре |
воток осуществляется за счет системно легочного |
|
зультаты получены и при использовании лево или |
анастомоза, не превышает 25%. В группе больных, |
|
правожелудочкового обхода. При этом риск разви |
подвергшихся гемодинамической коррекции кро |
|
тия кровотечений меньше, а эмболий больше. |
вообращения по Fontan, выживаемость составляет |
|
На основании данных, собранных начиная с |
всего 17% (выжившие пациенты на момент выпис |
|
1986 г., организация ELSO показала, что шансы вы |
ки из госпиталя) (45). |
|
живания новорожденных при применении ЭКМО |
Целью ЭКМО на послеоперационном этапе |
|
составляют 80% (годовой отчет, 1998). При приме |
кардиохирургической операции является времен |
|
нении этого метода после кардиохирургических |
ное обеспечение системы кровообращения и соз |
|
операций шанс выживания пациента меньше, учи |
дание таких условий, при которых возможны ком |
|
тывая сложность состояния больного перед приме |
пенсация и регенерация миокарда после опера |
|
нением ЭКМО. В 1986 г. положительные результа |
ции. Количество пациентов, которые подлежат |
|
ты применения ЭКМО были отмечены у 42% таких |
механической поддержке кровообращения в пос |
|
пациентов, а в последующие годы эффективность |
леоперационном периоде, постепенно растет: с |
|
применения ЭКМО колебалась от 37 до 57%. Безус |
7 % в 1986 г. до 20 % в 1997 г. Несмотря на то, что |
|
ловно, на результаты применения ЭКМО (в част |
из общего количества кардиохирургических паци |
|
ности артериально венозного метода) оказывают |
ентов эти больные составляют около 0,5–2%, кар |
|
влияние состояние пациента перед началом приме |
диохирургические центры, обеспеченные необхо |
|
нения метода и тип порока. Шанс выживания па |
димым оборудованием, имеют возможность безо |
|
циентов с нормальной (корригированной) анато |
пасного выполнения наиболее сложных кардио |
|
мией сердца или после полной анатомической кор |
хирургических операций. |
|
рекции врожденного порока (например, после ра |
|
|
Литература
1.Andersen MN, Senning A. Studies in oxygen consumption during extracorporeal circulation with a pump oxygenator. Ann Surg 1958;148:59.
2.Bengtsson F, Siesjo BK. Cell damage in cerebral ischemia: Physiological, biochemical and structural aspects. In Schurr A, Rigor BM (eds). Cerebral Ischemia and Resuscitation. Boca Raton, FL, CRC Press, 1990, pp 215–223.
3.Bigelow WG, Lindsay WK, Harrison RC, et al. Oxygen transport and uti lization in dogs at low body temperatures. Am J Physiol 160:125, 1950.
4.Castaneda AR, Lamberti J, Sade RM, et al. Open heart surgery during the first three months of life. J Thorac Cardiovasc Surg 68:719, 1974.
5.Croughwell N, Frasco P, Blumenthal JA, et al. The effect of temperature
on cerebral metabolism and blood flow in adults during cardiopul monary bypass. J Thorac Cardiovasc Surg 103:549–554,1992.
6.Elliot MJ. Ultrafiltration and modified ultrafiltration in pediatric open heart operations. Ann Thorac Surg 1993;56:1518.
7.England MD, Cavarocchi NC, O'Brien JF, Solis E, Pluth JR, Orszulak TA, et al. Influence of antioxidants (mannitol and allopurinol) on oxygen free radical generation during and after Сardiopulmonary bypass. Circulation 1986;74:III134.
8.Greeley WJ, Kern FH, Ungerleider RM, et al. The effect of hypothermic cardiopulmonary bypass and total circulatory arrest on cerebral metabolism in neonates, infants, and children. J Thorac Cardiovasc Surg 101:783–794, 1991.
9.Greeley WJ, Ungerleider RN, Kern FH, et al. Effects of cardiopul monary bypass on cerebral blood flow in neonates, infants, and chil dren. Circulation 80(suppl I):I–209, 1989.
10.Harris EA. Metabolic aspects of profound hypothermia. In Barratt Boyes BG, Neutze JM, Harris EA (eds). Heart Disease in Infancy. Edinburgh, Churchill Livingstone, 1973, pp 65–74.
11.Havel M, Teufelsbauer H, Knobl P, Dalmatiner R, Jaksch P, Zwolfer W, et al. Effect of intraoperative aprotinin administration on postoper ative bleeding in patients undergoing cardiopulmonary bypass. J Thorac Cardiovasc Surg 1991;101:968.
12.Jonas RA, Elliott ME (eds). Cardiopulmonary Bypass in the Neonate, Infant and Child. London, Butterworth Heinemann, 1993.
13.Jonas RA. Flow reduction and cessation. In Jonas RA, Elliott ME (eds). Cardiopulmonary Bypass in the Neonate, Infant and Child. London, Butterworth Heinemann, 1993.
14.Jonas RA, Wernovsky G, Ware J, et al. The Boston Circulatory Arrest Study: Perioperative neurologic outcome after the arterial switch oper ation. Circulation 86(suppl I):I–360, 1992.
15.Kirklin JW, Barratt Boyes BG. Cardiac Surgery. 2nd ed. New York, Churchill Livingstone, 1993, pp 61–128.
16.Kirklin JK, Westaby S, Blackstone EH, et al. Complement and the damaging effects of cardiopulmonary bypass. J Thorac Cardiovasc Surg 86:845, 1983.
17.Kramer RS, Sanders AP, Lesage AM, Woodhall B, Sealy WC. The effect of profound hypothermia on preservation of cerebral ATP content dur ing circulatory arrest. J Thorac Cardiovasc Surg 1968;56:699.
18.Langley SM, Chai PJ, Miller SE, Mault JR, Jaggers JJ, Tsui SS, et al. Intermittent perfusion protects the brain during deep hypothermic cir culatory arrest. Ann Thorac Surg 1999;68:4.
19.Lucchesi BR. Neutrophil derived oxygen radicals in myocardial reper fusion injury. In Zelenock GB, D'Alecy LG, Fantone JC, et al (eds). Clinical Ischemic Syndromes. St Louis, CV Mosby, 1990, pp 257–275.
20.Miyamoto K, Kawashima Y, Matsuda H, et al. Optimal perfusion flow rate for the brain during deep hypothermic cardiopulmonary bypass at 20°C. J Thorac Cardiovasc Surg 92:1065, 1986.
21.Murkin JM, Farrar JK, Tweed WA, McKenzie KN, Cuirauden G. Cerebral autoregulation and flow/metabolic coupling during cardiopulmonary bypass: the influence of PaCO2. Anesth Analg 1987;66:825.
216 |
Часть 3. ОТКРЫТЫЕ И ЗАКРЫТЫЕ ОПЕРАЦИИ |
|
|
|
|
22.Ratcliffe JM, Wyse RKH, Hunter S, et al. The role of the priming fluid in the metabolic response to cardiopulmonary bypass in children of less than 16 kg body weight undergoing open heart surgery. Thorac Cardiovasc Surg 36:65, 1988.
23.Rosenthal SM, LaJohn LA. Effect of age on transvascular fluid move ment. Am J Physiol 228:134, 1975.
24.SomaY, Hirotani T, YozuR, et al. A clinical study of cerebral circulation during extracorporeal circulation. J Thorac Cardiovasc Surg 97:187, 1989.
25.Steward DJ, Da Silva CA, Flegel T. Elevated blood glucose levels may increase the danger of neurological deficit following profoundly hypothermic cardiac arrest. Anesthesiology 68:653, 1988.
26.Swan H, Sanchez M, Tyndall M, Koch C. Quality control of perfusion: monitoring venousblood oxygen to prevent hypoxic acidosis. J Thorac Cardiovasc Surg 1990;99:868.
27.Swain JA, McDonald TJ, Griffith PK, et al. Low flow hypothermic car diopulmonary bypass protects the brain. J Thorac Cardiovasc Surg 102:76, 1991.
28.Swan H. The importance of acid base management for cardiac and cerebral preservation during open heart operations. Surg Gynecol Obstet 158:391, 1984.
29.van Oeveren W, Jansen NJ, Bidstrup BP, Royston D, Westaby S, Neuhof H, et al. Effects of aprotinin on hemostatic mechanisms during cardiopulmonary bypass. Ann Thorac Surg 1987;44:640.
30.Wernovsky G, Jonas RA, Newburger JW, et al. The Boston Circulatory Arrest Study: Hemodynamics and hospital course after the arterial switch operation. Circulation 86(suppl I):I–237, 1992.
31.Rebeyka I.M., Hanan S.A., Borges M.R., et al. Rapid cooling contrac ture of the myocardium. //J. Thorac. Cardiovasc. Surg.–1990.–V.100, N2 – P. 240–249.
32.Kirklin JW: The middle 1950's and C Walton Lillehei. // J Thorac Cardiovasc Surg 1986 – V. 98. P. 822 – 824.
33.Сердечно сосудистая хирургия: Руководство / Под ред. В.И. Бурако вского, Л.А.Бокерия – М.: Медицина, 1996.– 688 с.
34.Рage E., Earley J., Power B. Normal growth of ultrastructures in rat left ventricular myocardial cells. //Circ. Res. 1974.V.34 & 35(suppl. II): P. ll–12.
35.Fisher D.J., Heymann M.A., Rudolph A.M. Myocardial oxygen and car bohydrate consumption in fetal lambs in utero and in adult sheep. //Am. J. Physiol. 1980.V.238.P. 399–404.
36.Hendren W.G., Geffin G.A., Love T.R., et al. Oxygenation of cardio plegic solutions. //J. Thorac. Cardiovasc. Surg.1987.V.94.P. 614 619.
37.Bodenhamer R.M., DeBoer W.V., Geffin G.A., et al. Enhanced myocar dial protection during ischemic arrest. J. Thorac. Cardiovasc.
Surg.1983.V. 85.P. 769–774.
38.German J et al. Management of pulmonary insufficiency in diaphrag matic hernia using extracorporeal circulation with membrane oxygena tor (ECMO) J.Ped.Surg. 1977, 12, 905.
39.Zapol W.M. et al.Extracorporeal Membrane Oxygenation in severe res piratory failure, JAMA 1979, 242, 2193.
40.Barlett R.H. Experanza (ASAIO Presidental Address)/Trans. ASAIO 1985, 30, 723.
41.Anonymous UK collaborative randomized trial of neonatal extracorpo real membrane oxygenation. UK collaborative ECMO Trial Group, Lancet 1996, 348, 75.
42.Tracy Jr.T.F. et al. The registry of Extracorporeal Life Support Organisation. ECMO. Extracorporeal cardiopulmonary support in criti cal care (под ред. Zwischenberger L.B., Barlett R.H. Ann Arbor, Michigan: Extracorporeal life support organization, 1995.
43.Soeter J.R. et al. Prolonged extracorporeal oxygenation for cardiopul monary failure after tetralogy correction. J Thor Cardiov Surg 1973, 66, 214.
44.Fasules J.W. Extracorporeal Life Support for infants and children with cardiac diseases. ECMO. Extracorporeal cardiopulmonary support in critical care (Ed. Zwischenberger L.B., Barlett R.H.).
45.Wessel D.L. Intensive care management of cardiac patient on ECMO, Material of Postgradual Courses. Joint Meeting EACT/ESTS. Lisbona Portugal 16–19. 09. 2001.
46.Delius R.E., Caldarone Ch. Mechanical support of the Pediatric Cardiac patients. Pediatric Cardiac Surgery. Annual Seminars in Thoracic and Cardiovascular Surgery 2000, 3, 179.
Глава 17
ПАЛЛИАТИВНЫЕ И ЭТАПНЫЕ ОПЕРАЦИИ
МЕЖАРТЕРИАЛЬНЫЕ АНАСТОМОЗЫ
Впервые выполненный в 1945 г. анастомоз Blalock–Taussig (1) в его модифицированной (2, 3) форме стал стандартной промежуточной паллиа тивной операцией при цианотических пороках сердца (при пороках с гипоперфузией легких, глав ным образом при одножелудочковом сердце) для обеспечения дозированного легочного кровотока. Модифицированный анастомоз по Blalock–Taussig применяется также как элемент операции Norwood I при синдроме гипоплазии левых отделов сердца. При этом пороке закрывают артериальный проток, создают связь правого желудочка с аортой. Подк лючично легочный анастомоз становится един ственным источником легочного кровотока в тече ние 3–6 мес — периода, в течение которого ЛСС снижается до низкого уровня, позволяющего при нять пассивный системный венозный возврат в ле гочную артерию через кавопульмональный анасто моз. Анастомоз должен обеспечить достаточный, но не избыточный легочный кровоток без сниже ния сердечного выброса, повреждения легочных сосудов и объемной перегрузки желудочка. С по мощью уравнения Hagen–Poiseuille рассчитывает объемный ламинарный ток жидкости через пра вильную цилиндрическую трубку:
Q = pπd4/128Lμ,
где Q — объемная скорость, p — градиент давле ния, d — диаметр сосуда, L — длина сосуда, μ — вязкость жидкости.
Уравнение показывает, что небольшое увели чение диаметра шунта значительно — в четвертой степени — увеличивает объем кровотока, так как последний увеличивается. Для подавляющего большинства новорожденных сосудистый протез из тетрафлюороэтилена диаметром 3,0–3,5 мм обеспечивает оптимальный баланс кровотока по большому и малому кругам кровообращения. У детей массой менее 2,5 кг диаметр шунта должен быть соответственно меньшим. Грубый шов мо
жет уменьшить эффективный диаметр с соответ ствующим уменьшением кровотока. Длина шунта несущественно влияет на объем кровотока. От места наложения шунта (дистально или прокси мально вдоль безымянной или подключичной ар терии) зависит шунтовой ток, возникающий бла годаря разнице диаметров этих сосудов. Длина шунта и угол анастомоза важны с точки зрения сохранения естественного хода безымянной и ле гочной артерии и предупреждения их перегиба. Длинный шунт может перегнуться, короткий мо жет вызвать деформацию легочной артерии.
Модифицированный шунт Blalock–Taussig мо жет быть выполнен через боковую торакотомию или стернотомию. В последние годы в большин стве кардиохирургических центров предпочтение отдают срединному доступу по нескольким причи нам, в частности потому, что шунт является вре менной паллиативной процедурой, за которой последует вмешательство из срединного доступа. Другими преимуществами срединного доступа яв ляются техническая легкость выполнения анасто моза, лучшая проходимость шунта, лучшее билате ральное распределение кровотока, лучший доступ для перевязки артериального протока и других со путствующих процедур, а также меньшая деформа ция легочной артерии. Срединный доступ позво ляет обеспечить нормальную вентиляцию обоих легких во время операции и избежать травмы и ате лектаза легкого на стороне вмешательства.
Артериальный катетер для мониторирования системного давления по возможности должен нахо диться со стороны, противоположной шунту. Пуль соксиметрия позволяет оценить баланс между легоч ным и системным кровотоком и переносимость па циентом временного пережатия легочной артерии.
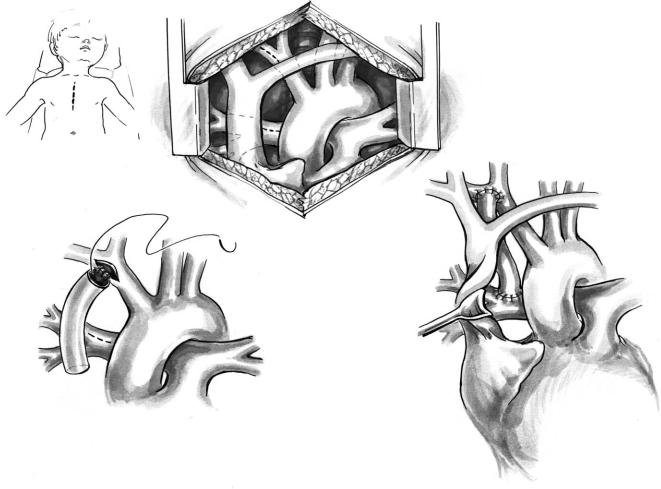
Модифицированный подключично! легочный анастомоз BlalockñTaussig из срединного доступа
Выполняют стандартную стернотомию и субто тальную резекцию вилочковой железы с прилежа
218 |
Часть 3. ОТКРЫТЫЕ И ЗАКРЫТЫЕ ОПЕРАЦИИ |
|
|
|
|
а
б
в
Рис. 1. Этапы выполнения модифицированного подключично легочного анастомоза Blalock–Taussig из срединного доступа
щими тканями, что облегчает повторную стерно томию. Рассекают верхнюю часть перикарда и с помощью швов держалок экспонируют структуры верхнего средостения. Мобилизуют безымянную артерию, бифуркацию, подключичную и общую сонную артерии. Безымянную вену полностью мобилизуют, чтобы по ходу операции ее можно было подтягивать резиновой тесьмой. Между аор той и верхней полой веной выделяют правую ле гочную артерию от бифуркации легочного ствола до ее деления на ветви (рис. 1, а).
Конец тонкостенного сосудистого протеза из Gore Tex диаметром 3,5–5 мм срезают под углом, соответствующим углу отхождения безымянной артерии от аорты. Намечают места разрезов (по казаны пунктиром на рис. 1, а) по верхнему краю правой легочной артерии и в месте соединения безымянной и подключичной артерий. Мягким изогнутым сосудистым инструментом отжимают место предполагаемого разреза. Этот зажим рас полагают спереди оттянутой книзу безымянной вены. Проксимальный анастомоз выполняют 7/0 или 6/0 полипропиленом, начиная проводить
швы изнутри протеза к краю разреза системной артерии (рис. 1, б). Линия шва не должна быть бугристой, инвертированной и деформирующей. После завершения проксимального анастомоза коротким зажимом («бульдогом») пережимают протез, освобождая системные артерии. Отмеря ют необходимую длину протеза и пересекают его поперек.
Перед наложением дистального анастомоза восходящую аорту отводят влево с помощью швов держалок, что существенно улучшает экспо зицию. Правую легочную артерию можно отжать изогнутым зажимом или ограничить место анасто моза изогнутым зажимом со стороны бифуркации и резиновыми тесемками на ветвях легочной арте рии. Перед рассечением легочной артерии следует произвести пробное пережатие под контролем са турации и гемодинамики. Необходимо убедиться, что в случае отжатия легочной артерии зажим не сдавливает коронарные артерии или аорту. Про дольную артериотомию выполняют медиальнее верхнедолевой ветви. Анастомоз выполняют 7/0 проленом (рис. 1, в).

Глава 17. ПАЛЛИАТИВНЫЕ И ЭТАПНЫЕ ОПЕРАЦИИ |
219 |
|
|
|
|
Если шунтирование производится как изоли рованная операция, артериальный проток перевя зывают и пересекают после открытия шунта. Мо билизация протока перед наложением анастомоза нежелательна при дуктусзависимых пороках, так как выделение протока может спровоцировать его спазм и нестабильность состояния пациента до создания альтернативного источника легочного кровотока. Короткое пробное пережатие анасто моза позволяет убедиться в его проходимости. Проводят тщательное мониторирование гемоди намических параметров для оценки соотношения легочного и системного кровообращения. В от дельных случаях избыточный легочный кровоток вынуждает хирурга сузить шунт перед закрытием раны.
Классический правосторонний анастомоз BlalockñTaussig (левосторонняя дуга аорты)
Анастомоз накладывают с противоположной от дуги аорты стороны. Таким образом, при левосто ронней дуге операцию производят через правую плевральную полость, а при правосторонней дуге
— через левую.
Правостороннюю боковую торакотомию вы полняют в III–IV межреберном промежутке. Вы деляют правую легочную артерию и обводят рези новыми тесемками ее ветви (рис. 2, а). Перевязы вают и пересекают непарную вену. Правую под ключичную артерию выделяют, полностью моби лизуют, перевязывают непосредственно прокси мальнее или дистальнее ее первой ветви и пересе
б
а
в |
г |
|
Рис. 2. Этапы выполнения правостороннего классического анастомоза Blalock–Taussig: а — подведены тесемки под вет ви правой легочной артерии, верхняя правая легочная вена отведена книзу, непарная вена пересечена; б — правая подк лючичная артерия выводится из петли возвратного нерва; в — пережата правая легочная артерия, произведен продольный разрез по верхней стенке легочной артерии; г — выполняется анастомоз с помощью непрервного или узловатых 7/0 по липропиленовых швов. Заднюю линию шва начинают изнутри сосуда

220 |
Часть 3. ОТКРЫТЫЕ И ЗАКРЫТЫЕ ОПЕРАЦИИ |
|
|
|
|
кают. Затем артерию освобождают из петли воз вратного глоточного нерва (рис. 2, б). Мягким со судистым зажимом пережимают правую легочную артерию как можно ближе к бифуркации и затяги вают резиновые тесемки на ее ветвях (рис. 2, в). Очень важно, чтобы разрез легочной артерии про ходил строго по верхнему краю, а не по передней поверхности. В последнем случае происходит скручивание артерии вдоль ее оси. Непрерывный шов выполняют изнутри легочной артерии 7/0 по липропиленовой нитью (рис. 2, г). Перед завязыва нием концов нити сначала ослабляют тесемки на ветвях, затем снимают зажим с легочной артерии для вытеснения воздуха. Связывают концы нити.
Модифицированный левосторонний анастомоз BlalockñTaussig (левосторонняя дуга аорты)
При левосторонней дуге применение класси ческого анастомоза Blalock–Taussig сопряжено с вероятностью перегиба левой подключичной ар
терии в месте отхождения от аорты. Именно поэ тому классический анастомоз стали выполнять с противоположной стороны от аорты. Использова ние сосудистого протеза из тетрафлюороэтилена (Gore Tex) позволяет наложить анастомоз с любой стороны.
Модифицированный левосторонний анасто моз (со вставкой из протеза) технически аналоги чен классическому. Левостороннюю торакотомию производят через III или IV межреберный проме жуток. Выделяют места разрезов подключичной и легочной артерий (на рис. 3, а показаны пункти ром). Сосудистый протез из Gore Tex вначале анастомозируют с подключичной артерией «конец в бок». Начало линии шва начинают с середины и ведут латерально в обе стороны изнутри (рис. 3, б). Этот прием помогает избежать надрывов тонко стенных сосудов. Тщательно примеряют длину протеза, чтобы он был ни длинным, ни коротким. Дистальный анастомоз выполняют аналогичным образом. Зажим на подключичной артерии остав ляют до завершения анастомоза (рис. 3, в).
а
б
в
Рис. 3. Модифицированный левосторонний анастомоз Blalock–Taussig при левосторонней дуге аорты

Глава 17. ПАЛЛИАТИВНЫЕ И ЭТАПНЫЕ ОПЕРАЦИИ |
221 |
|
|
|
|
Рис. 4. Способ выполнения аортального конца анастомоза «бок в бок»
Центральный анастомоз между восходящей аортой и стволом легочной артерии
При выраженной гипоплазии ветвей легочной артерии подключично легочные анастомозы трудновыполнимы и с гемодинамической точки зрения малоэффективны. Вследствие малой ско рости кровотока высока вероятность тромбоза анастомоза. Центральный анастомоз выполняют между аортой и легочным стволом из срединного доступа. При наличии развитого коллатерального кровообращения и атрезии на уровне клапана ствол изолируют, перекрывая турникетами ветви легочной артерии. Часть просвета ствола может быть отжата сосудистым зажимом. Место предпо лагаемого анастомоза с аортой изолируют боко вым отжатием. Аортальным перфоратором созда ют отверстия в обоих сосудах. Артерии соединяют сосудистым протезом из Gore Tex, диаметр кото рого обязательно подбирают с учетом короткого расстояния между аортой и легочной артерией.
Недостатком описанной выше техники являет ся вероятность возникновения двух осложнений:
перегиба сосудистого протеза и обкрадывания ко ронарного кровотока. Эти проблемы могут быть решены двумя путями: более дистальным распо ложением аортального конца анастомоза вдали от устьев коронарных артерий и наложением аор тального анастомоза «бок в бок» с ушиванием кон ца протеза (рис. 4).
СУЖИВАНИЕ ЛЕГОЧНОЙ АРТЕРИИ
Первоначально суживание легочной артерии применяли в эксперименте на животных для изу чения гипертрофии. В 1952 г. Muller и Dammann
(4) внедрили эту процедуру в клинику для умень шения избыточного легочного кровотока. В тече ние многих лет суживание легочной артерии было популярным для паллиативного лечения больных с ДМЖП и другими пороками с увеличенным ле гочным кровотоком, что позволяло детям достичь возраста, безопасного для осуществления анато мической коррекции. Развитие кардиохирургии для новорожденных и младенцев привело к воз можности проведения ранней анатомической
