
4 курс / Акушерство и гинекология / Гинекология_Национальное_руководство_Савельева_Г_М
.pdf
ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ 9 3 93
зовать цервикальную слизь высокого качества, которую рекомендуется получать у пациенток при проведении инсеминации спермой в естественном цикле или после стимуляции овуляции гонадотропинами.
Тест Курцрока–Миллера должен проводиться в течение часа после сдачи спермы. Значение рН цервикальной слизи определяют сразу после забора, оно должно находиться в интервале от 7 до 8,5, поскольку при рН менее 7 подвижность сперматозоидов резко снижается, что приводит к негативным результатам теста. Существенно снизить рН образца может попадание вагинального содержимого. Также нужно учитывать, что рН экзоцервикального пула существенно ниже, чем эндоцервикального.
При проведении теста рекомендована предварительная оценка качества цервикальной слизи, описанная выше для ПКТ.
Забор цервикальной слизи осуществляется как для ПКТ. На предметное стекло наносится капля цервикальной слизи, накрывается покровным стеклом. Толщина зазора между стеклами контролируется с помощью специального парафинового геля, содержащего стеклянные бусы диаметром 100 мкм, чтобы зазор не был слишком узким. Рядом с краем покровного стекла наносится капляспермы, после чего формируется четко видимая граница между цервикальной слизью и семенной жидкостью.
Тест Курцрока–Миллера является качественным из-за невозможности стандартизации. Тест считается положительным, когда сперматозоиды проникают в цервикальную слизь и 90% из них подвижны. Тест считается несостоявшимся, если сперматозоиды проникают в цервикальную слизь не более чем на 500 мкм (расстояние, равное суммарной длине 10 сперматозоидов). Тест считается отрицательным при отсутствии сперматозоидов в цервикальной слизи, в случае быстрого обездвиживания сперматозоидов при их проникновении в цервикальную слизь, при наличии только колеблющихся сперматозоидов.
В том случае, если тест отрицательный, скопления сперматозоидов на стороне спермы могут свидетельствовать о наличии АСАТна поверхности сперматозоидов или в цервикальной слизи.
Таким образом, нарушения в иммунной системе являются важным звеном в патогенезе различных форм эндометриоза, а также бесплодия неясного генеза, ассоциированном с наличием антиспеpмальных антител, антифосфолипидным синдpомом, в патогенезе идиопатического привычного выкидыша и привычного выкидыша, ассоциированном с целым перечнем аутоиммунных антител.
Иммунологические методы необходимы для оценки эффективности новых диагностических и лечебных технологий, включающих патогенетически обоснованную индивидуально подобранную иммунотерапию с учетом особенностей иммунной системы конкретного пациента.
СПИСОК ЛИТЕРАТУРЫ
1.КречетоваЛ.В.,ХачатрянН.А.,ТетруашвилиН.К.,ВторушинаВ.В.,Степанова Е.О., Николаева М.А., Сухих Г.Т. Особенности фенотипа лимфоцитов периферической крови женщин с привычным выкидышем // Акушерство и гинекология, 2014.
№ 10. С. 27–33.
2.Меньшиков В.В. Критерии оценки методик и результатов клинических лабораторных исследований. Справочное пособие. М.: Лабора, 2011. 328 с.
3.Сидельникова В.М., Сухих Г.Т. Невынашивание беременности: Руководство для практикующих врачей. М.: ООО «Медицинское информационное агентство», 2011. 516 с.
4.Petrikova J., Lazurova I. Ovarian failure and polycystic ovary syndrome // Autoimmunity Reviews, 2012. N 11. A471–A478.
5 ГЛАВА

РАЗДЕЛ 1
94 МЕТОДЫДИАГНОСТИКИ
5.4.МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ
ВПРАКТИКЕ ГИНЕКОЛОГА
Нуклеиновые кислоты (ДНК и РНК) присутствуют в клетках всех живых организмов и обеспечивают хранение, передачу и реализацию наследственной информации. Выявление и идентификация нуклеиновых кислот широко используется в клинической лабораторной диагностике.
Полимеразная цепная реакция (ПЦР), позволяющая за короткое время получить огромное количество копий целевого фрагмента ДНК для его идентификации, является основным методом молекулярной диагностики в рутинной клинической практике благодаря высокой аналитической чувствительности и специфичности в сочетании с технологичностью и финансовой доступностью. Новейшие методы, такие как геномная гибридизация и высокопроизводительное секвенирование, обладая рядом несомненных преимуществ, пока еще слишком дороги, поэтому ПЦР по-прежнему остается самым массовым молекулярно-генетическим методом исследования.
В основе ПЦР лежит естественный процесс репликации (копирования) ДНК, необходимый для деления клеток. ДНК состоит из двух полимерных цепей, удерживаемых водородными связями между азотистыми основаниями и образующих двойную спираль. При этом водородные связи образуются только между определенными (комплементарными) основаниями, поэтому нуклеотидные последовательности обеих цепей однозначно соответствуют друг другу. Ключевым ферментом, осуществляющим репликацию, является ДНК-полимераза, которая синтезирует новую цепочку ДНК, используя имеющуюся в качестве шаблона. В 1983 г. Кэри Муллису впервые удалось воспроизвести этот процесс в пробирке. Ключевой особенностью ДНК-полимеразы является то, что фермент не способен сам начать репликацию с любого места одноцепочечной ДНК-матрицы. Для запуска репликации необходимо наличие небольшого фрагмента ДНК (праймера), комплементарного ДНК-матрице. Только в этом случае ДНК-полимераза способна синтезировать новую цепь, последовательно добавляя нуклеотиды к концу праймера. Таким образом, способность праймера связываться с определенным участком ДНК-мишени («узнавать» его), обусловленная их комплементарностью, обеспечивает начало синтеза новой копии ДНК. Искомый фрагмент может быть частью очень сложной смеси нуклеиновых кислот, полученной из разных клеток, но реакция начнется, только если в этой смеси имеется участок, комплементарный праймеру. Это обеспечивает очень высокую специфичность реакции. Использование комбинации нескольких специально подобранных праймеров позволяет одновременно определять сразу несколько мишеней в одной пробирке (мультиплексная ПЦР). При этом вновь синтезируемая цепочка ДНК, будучи комплементарной матрице, также становится матрицей в следующем цикле. Проведение нескольких таких циклов позволяет получить большое количество копий определенного фрагмента ДНК, поэтому подобные технологии получили название метода амплификации нуклеиновых кислот (МАНК). Благодаря амплификации достигается высочайшая чувствительность: исходным материалом для ПЦРможетбытьдаже единственнаямолекулаДНК.
«Классическая» ПЦР с регистрацией результата по окончании реакции (как правило, с помощью электрофореза) не предполагает количественной оценки, так как количество копий ДНК, полученное в результате большого количества циклов амплификации, практически не зависит от исходного количества ДНК-мишени, а определяется количеством реагентов, находящихся в пробирке и расходуемых в процессе реакции до полного истощения. Метод ПЦР с детекцией
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
|
|
|
|
|
|
ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ 9 5 93 |
||
|
|
|
|
|
|
|
|
ГЛАВА5 |
|
|
|
|
|
|
Качественный |
||
|
|
|
|
|
|
анализ |
||
копий |
1000 |
|
|
|
|
|
|
|
800 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Количество |
600 |
|
|
|
|
|
|
|
400 |
|
|
|
|
|
|
анализ |
|
|
|
|
|
|
|
|
|
|
|
200 |
|
|
|
|
|
|
Количественный |
|
|
|
|
|
|
|
|
|
|
0 0 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
|
Номер цикла |
|
|
|
|
||
|
|
амплификации |
|
|
|
|
||
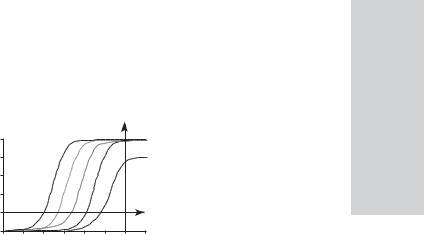
Рис. 5.1. Кинетиканакопленияпродуктовамплификациивзависимостиотисходнойконцентрации |
||||||||
ДНК-мишени |
|
|
|
|
|
|
|
|
результатов в режиме реального времени, когда количество ДНК копий измеряется после каждого цикла амплификации, позволяет оценить кинетику реакции и определить — на каком цикле амплификации начинается экспоненциальный рост количества продуктов реакции (пороговый цикл). Чем больше исходно было ДНК-мишени, тем быстрее начинается экспоненциальный рост и тем меньше значение порогового цикла (рис. 5.1).
Для определения РНК с помощью ПЦР используется другой фермент — обратная транскриптаза (ревертаза или РНК зависимая ДНК полимераза), который обеспечивает синтез ДНК на матрице РНК в процессе, называемом обратной транскрипцией. После обратной транскрипции синтезированная комплементарная ДНК (кДНК) может быть исследована с помощью стандартной ПЦР с получением качественного или количественного результата. Определение РНК необходимо для выявленияРНК-содержащихвирусовиоценкиактивности(экспрессии)генов.
Обследование пациенток с патологическими выделениями
Одной из основных причин обращения пациенток к акушеру-гинекологу являются патологические выделения из половых путей, которые чаще всего ассоциированы с такими заболеваниями, как бактериальный вагиноз или вагиниты различной этиологии.
ВЫЯВЛЕНИЕ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ
Основой диагностики специфического вагинита являются различные методы выявления и идентификации микроорганизмов. Основное требование для диагностических систем в этом случае — максимальная аналитическая чувствительность и специфичность. ПЦР оптимально отвечает этим требованиям. Важно отметить, что количественных оценок при этом не требуется, так как лечение необходимо проводить при любых формах заболевания вне зависимости от наличия или отсутствии клинических проявлений и количества выявленного возбудителя. Критерием излеченности считают полную элиминацию возбудителя из организма и отсутствие клинических симптомов. При этом отсутствие возбудителя при диагностике имеет первостепенное значение, так как при хроническом течении клинические проявления могут быть крайне незначительными или вовсе отсутствовать.

РАЗДЕЛ 1
96 МЕТОДЫДИАГНОСТИКИ
ВЫЯВЛЕНИЕ ДИСБИОТИЧЕСКИХ НАРУШЕНИЙ
Причиной неспецифического вагинита и бактериального вагиноза является условно-патогенная микрофлора, представители которой встречаются и у клинически здоровых женщин, поэтому, в отличие от специфического вагинита, само по себе выявление того или иного микроорганизма не является достаточным основанием для постановки диагноза. Как следствие, те подходы, которые прекрасно зарекомендовали себя для специфических вагинитов, для неспецифического вагинита практически не работают. Попытки использовать в качестве диагностического критерия абсолютное количество того или иного микроорганизма существенно не повысили точность лабораторной диагностики, поскольку как общая обсемененность влагалища, так и количество отдельных микроорганизмов может колебаться в достаточно широких пределах, как у больных, так и у здоровых женщин.
Первые клинико-лабораторные критерии диагностики БВ были предложены в работе R. Amsel и соавт., но поскольку критерии Amsel обладали невысокой диагностической чувствительностью, R. Nugent и соавт. предложили свои, чисто лабораторные критерии диагностики бактериального вагиноза. В основе критериев Nugent лежит оценка соотношения трех бактериальных морфотипов в мазке из влагалища. Таким образом, Amsel и Nugent впервые начали рассматривать влагалищную флору как экосистему.
Понимание того, что влагалищная микрофлора — это компонент биоценоза, второй составляющей которого является эпителий влагалища, активно поддерживающий определенный видовой состав обитающих на его поверхности микроорганизмов, позволило по-новому подойти к лабораторной диагностике. В качестве диагностического критерия используются соотношения различных групп микроорганизмов. Изменение состава и количественных соотношений различных представителей микрофлоры, в норме заселяющей полые органы, сообщающиеся с окружающей средой, называется дисбиозом. До сих пор нет однозначного ответа, что является причиной дисбиоза: снижение количества нормофлоры и, как следствие, бесконтрольный рост УПМ и соответствующая реакция со стороны влагалища или наоборот — нарушение механизмов локальной защиты в эпителии иподлежащихтканях,приводящее кпотере контролянадУПМ,которыевытесняют лактофлору. Возможно, имеют место оба варианта. В любом случае изменение количественного соотношения между лактобактериями и УПМ является высокоинформативным диагностическим критерием.
Однако технически оценить это соотношение крайне сложно. Микроскопический, точнее бактериоскопический, метод не обладает достаточной точностью, так как не позволяет провести видовую идентификацию, ограничиваясь только морфотипами. Бактериологические методы не всегда достаточно эффективны, поскольку многие микроорганизмы, ассоциированные с влагалищным дисбиозом, плохо культивируются, что не позволяет получить полную картину структуры микрофлоры. Молекулярные методы исследования обладают рядом преимуществ, но при традиционном подходе, когда микроорганизмы идентифицируются до вида, количественная оценка всех компонентов вагинальной микрофлоры будет крайне дорогой, так как видовое разнообразие очень велико и количество потенциальных мишеней исчисляется сотнями. Решением этой проблемы являетсяпереходотвидовой идентификации кгрупповой,когдаспомощьюодной ПЦР-реакции определяется суммарное количество целой группы микроорганизмов, играющих сходную рольво влагалищном биоценозе. Практика показала, что с клинической точки зрения полнота охвата всех представителей УПМ гораздо важнее, чем точная идентификация отдельных видов. Предлагаемый подход,
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ 9 7 93
заключающийся в определении широких групп микроорганизмов и использовании мультиплексной системы детекции, позволяет при сохранении высокой технологичности и умеренной стоимости исследования достичь высокой информативности, поскольку полностью количественно описывает биоценоз влагалища 95–98% женщин, что является основой широкого использования его для целей клинической лабораторной диагностики.
Оценка экспрессионного профиля мРНК
Склинической точки зрения дифференциальная диагностика вагинитов и БВ крайне важна, так как в зависимости от диагноза будет меняться тактика ведения пациентки. При этом наличие белей и дисбиотические нарушения влагалищной флоры в большей степени являются общими признаками и мало подходят для дифференциальной диагностики. Несмотря на то что внешний вид выделений различается при различных заболеваниях, на практике этот критерий не обладает достаточной специфичностью и зачастую приводит к диагностическим ошибкам. Выявление возбудителей специфических вагинитов позволяет однозначно поставить соответствующий диагноз, но несмотря на то, что много написано об ассоциации определенных представителей УПМ с БВ, нет оснований считать, что при наличии,например, Gardnerellavaginalisили Atopobiumvaginaeдисбиотический процесс всегда будет протекать без воспалительной реакции. Таким образом, после исключения специфического вагинита ключевым признаком, позволяющим отличить БВ от неспецифического вагинита, является наличие воспалительной реакции.
Клинические признаки воспаления влагалища, выявляемые при осмотре в зеркалах, связаны с развитием стандартного комплекса сосудистых и тканевых изменений. Однако в связи с высокой частотой стертых и бессимптомных форм заболеванийэтот критерий не обладает достаточной чувствительностью.Поэтому для оценки воспалительной реакции необходимо проведение лабораторных исследований.
Сточки зрения лабораторной диагностики основным симптомом локальной воспалительной реакции является миграция и скопление лейкоцитов во влагалище.
Подсчет лейкоцитов должен проводиться с нормировкой на количество обнаруженных эпителиальных клеток в том же препарате. В норме соотношение составляет до 10 лейкоцитов на одну эпителиальную клетку. Тем не менее на практике чаще всего определяют только абсолютное количество лейкоцитов в поле зрения светового микроскопа. Метод обладает низкой диагностической чувствительностью и характеризуется низкой точностью и воспроизводимостью при высокой доле субъективизма.
Одной из ключевых составляющих врожденного иммунитета является цитокиновая система, которая обеспечивает согласование действий иммунной, эндокринной и нервной систем в развитии реакции воспаления. Подобно многим другим медиаторам, цитокины служат для межклеточной сигнализации при развитии воспалительного процесса. Преимущество цитокинов в качестве биомаркеров связано с тем, что большинство этих молекул не депонируется в клетке и их секреция всегда связана с синтезом de novo,что, в свою очередь, подразумевает появление в клетке большого количества специфической мРНК, которая может быть идентифицирована с помощью молекулярно-генетических методов. мРНК извлекается из клеток, после чего преобразуется в кДНК, которая может быть амплифицирована
иколичественно оценена методом ПЦР с детекцией результатов в режиме реального времени. Эта методика более точная и технологичная, чем исследование самих цитокинов.
5 ГЛАВА

РАЗДЕЛ 1
98 МЕТОДЫДИАГНОСТИКИ
Показано, что локальная воспалительная реакция слизистой оболочки влагалища сопровождается выраженным изменением экспрессии генов иммунного ответа. Наблюдается как повышение, так и снижение экспрессии ряда генов при развитии воспаления. На основании этого разработана молекулярно-генетическая диагностическая система для оценки локальной воспалительной реакции во влагалище
ицервикальном канале (ИммуноКвантэкс). Поскольку изменения цитокинового профиля предшествуют клиническим проявлениям и развитию лейкоцитарной инфильтрации, диагностическая чувствительность молекулярного метода выше, чем традиционная диагностика. Полное исключение субъективной оценки (анализ транскрипционного профиля проводится специальным программным обеспечением в полностью автоматическом режиме) позволяет стандартизировать исследование.
Дополнительным преимуществом данного метода является то, что используется та же технологическая платформа, что и для выявления дисбиоза. Все молекулярногенетические маркеры, используемые в клинической лабораторной диагностике заболеваний нижних отделов женского репродуктивного тракта (транскрипты генов иммунной системы и нуклеиновые кислоты микроорганизмов), могут быть идентифицированы в одном и том же образце с использованием единого метода — полимеразной цепной реакции, что позволяет сократить время диагностики
иснизить нагрузку на лабораторию. Таким образом, использование современных молекулярно-генетических методов исследования дает врачу-клиницисту мощный инструмент комплексной диагностики заболеваний, связанных с патологическими выделениями.
Скрининг наонкологические заболевания женской репродуктивной сферы
Молекулярно-генетический скрининг широко используется для профилактики рака шейки матки (РШМ) и наследственной формы рака молочной железы и яичников. Включение в программы диспансеризации подобных исследований может способствовать сохранению здоровья и качества жизни населения при снижении затрат на медицинскую помощь.
РАК ШЕЙКИ МАТКИ
РШМ — практически единственное онкологическое заболевание, полностью удовлетворяющее всем рекомендованным ВОЗ условиям для популяционного скрининга. Анализ принципов организации скрининга в разных странах продемонстрировал, что ключевым фактором, определяющим снижение заболеваемости РШМ, является полнота охвата скринингом женского населения. В тех странах, где отмечалось существенное снижение заболеваемости и смертности, охват скринингом женского населения, подлежащего обследованию, достигал 75–90%. Первымметодом,который использовалсяивходилвовсе скрининговые программы цервикального рака, — цитологическое исследование.
Открытие роли вируса папилломы (ВПЧ) человека в развитии РШМ позволило по-новому подойти к проблеме скрининга. Генетический материал вируса — прекрасная мишень для лабораторной диагностики, что позволило использовать в том числе и для скрининга современные молекулярно-генетические методы. Высокая частота выявления неопластической трансформации у женщин с ВПЧ позволяет рассматривать таких пациенток как группу высокого риска развития РШМ. ВПЧ-положительные женщины обязательно нуждаются в цитологиче-
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ 9 9 93
ском обследовании для установления степени неопластической трансформации и выбора соответствующей тактики ведения. Гораздо важнее с практической точки зрения, что ВПЧ-отрицательные пациентки не нуждаются в цитологическом исследовании, поскольку вероятность наличия у них интрацервикальной неоплазии незначительна. Однако действующий Порядок оказания акушерскогинекологической помощи не позволяет заменить один метод другим. Проведение так называемого одномоментного скрининга, когда всем пациенткам сразу проводится и молекулярно-генетическое, и цитологическое исследование, нецелесообразно, поскольку не обеспечивает лучшей результативности, но существенно перегружает лабораторию.
ПРОФИЛАКТИКА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И ЯИЧНИКОВ
Рак молочной железы и рак яичников представляют собой важную социальномедицинскую проблему в связи с высокой заболеваемостью и смертностью среди женского населения. От 5 до 10% случаев РМЖ, от 10 до 17% случаев РЯ являются наследственными. Среди наследственных форм ведущей причиной являются мутации в генах BRCA1 и BRCA2. Оба этих гена являются классическими опухолевыми cупрессорами — кодируемые ими белки играют основную роль в репарации двухцепочечных разрывов ДНК. При наследственных формах РМЖ и РЯ для инициации опухолевого роста, помимо наличия унаследованной мутации в одной копии гена, необходима инактивация второго аллеля, которая происходит в соматической клетке. Причиной инактивации могут служить как соматическая мутация, так и ряд эпигенетических событий, таких как аномальное метилирование.
Наличие мутаций в генах BRCA1 и BRCA2 связано с высоким риском наследственного рака молочной железы и яичников. Частота РМЖ, развившегося на фоне беременности и лактации, достоверно выше среди пациенток с наследственной предрасположенностью; в 17,5% РМЖ, диагностированного на фоне второй и последующих беременностей и в процессе грудного вскармливания, обнаружены герминальные мутации в гене BRCA1. У больных РМЖ носителей мутаций в генах BRCA1 и BRCA2 кумулятивный риск развития опухолей контралатеральной молочнойжелезычерез25 летпослепостановкипервичного диагноза в 1,6 раза выше у носителей мутаций в гене BRCA1. В этой группе больных при манифестациипервичного РМЖввозрастедо40летриск развитиядвустороннего поражения составляет 62,9%.
Онкологически отягощенный семейный анамнез является бесспорным и самым важным показанием к генетическому тестированию. Однако в связи с малым размером семей и отсутствием достоверной информации в отношении родственников пациента использование только этого критерия недостаточно. При медико-генетическом консультировании пациенток с выявленной мутацией в гене BRCA1/BRCA2 показано, что более чем у 20% носительниц в семье не было отмечено случаев злокачественных новообразований.
Таким образом, выявление мутаций в генах BRCA1 и BRCA2 позволяет выявить пациенток, нуждающихся в пристальном диспансерном наблюдении, для возможно более раннего выявления начальных стадий онкозаболевания. Также BRCAстатус может быть использован при выборе химиотерапевтического лечения.
В панель для первичного генетического скрининга в группах риска с наследственной предрасположенностью к РМЖ и/или РЯ должны быть включены наиболее распространенные в российской популяции мутации в генах BRCA1 и BRCA2. В 70% случаев при РМЖ и в 60% случаев при РЯ встречается мута-
5 ГЛАВА

РАЗДЕЛ 1
100 МЕТОДЫДИАГНОСТИКИ
ция5382insC,частовстречаютсямутации4153delA,Cys61Gly,185delAG,2080delA,
также отмечены мутации 3819delGTAAA, 3875delGTCT в гене BRCA1 и мутация
6174delT в гене BRCA2.
Исследование генома
ВЫЯВЛЕНИЕ МАРКЕРОВ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ
Наследственные болезни — заболевания, главным этиологическим фактором которых является генная, хромосомная или геномная мутация. Они занимают значительную долю в структуре детской заболеваемости и смертности. Большинство наследственных заболеваний характеризуются прогрессирующим течением, высоким риском повторного появления в семьях, отсутствием эффективного лечения, снижением фертильности и значительным снижением продолжительности и качества жизни. Тяжесть заболеваний и ограниченные возможности терапии заставляют сконцентрировать внимание на профилактике. Основными профилактическими методами являются медико-генетическое консультирование семьи и скрининг.
Для большинства наследственных болезней характерно аутосомно-рецессивное наследование. Это означает, что мутантные аллели могут в течение нескольких поколений передаваться к детям от родителей, при этом никак клинически не проявляясь. Но в браке двух носителей дефектного гена вероятность появления ребенка с аутосомно-рецессивным заболеванием составляет 25%. При этом пара, планирующая беременность, в большинстве случаев даже не подозревает о потенциальной опасности рождения больного ребенка, и данные для медикогенетического консультирования отсутствуют.
Имеющиеся программы биохимического скрининга направлены на выявление заболеваний у плода (пренатальный скрининг), а также на выявление больных детей среди новорожденных (неонатальный скрининг). Неонатальный скрининг не относится к профилактическим мероприятиям, но позволяет начать своевременное лечение. Однако, несмотря на проводимое лечение, существенно снижается качество жизни как самих пациентов, так и членов их семей.
Ранний пренатальный скрининг относится к мерам вторичной профилактики, так как позволяет прервать беременность по желанию родителей, предотвращая рождение больного ребенка. К сожалению, это может нанести вред здоровью матери и неоднозначно с этической точки зрения.
Для большинства широко распространенных на территории Российской Федерации аутосомно-рецессивных заболеваний выявлены мутации, являющиеся причиной болезни, что используется при диагностике. При этом можно выделить так называемые мажорные мутации, которые встречаются наиболее часто в данной популяции. Примерами являются делеция delF508 в гене CFTR при муковисцидозе или замена R408W в гене PAH при фенилкетонурии. Относительная частота delF508 при муковисцидозе составляет от 43 до 53%, а популяционная встречаемость варьирует от 0,5 до 0,8%. Частота R408W при фенилкетонурии у российских больных составляет около 60%, а встречаемость среди здорового населения достигает 0,7%. Наличие «мажорных» мутаций является благоприятной ситуацией, позволяющей сконцентрировать на них диагностический поиск. Использование ДНК-скрининга позволяет не только выявить больных, но и идентифицировать здоровых носителей, у которых потенциально может родиться
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ |
101 |
больной ребенок. ДНК-диагностика «мажорных» мутаций, обладающая высокой чувствительностью, является относительно дешевым и легко осуществимым методом преконцепционного скрининга, позволяющим предотвратить зачатие и рождение больного ребенка.
Преконцепционный скрининг — это массовый скрининг будущих родителей на этапе планирования семьи (до зачатия). В случае выявления носительства «мажорной» мутации у одного из партнеров, пара должна быть направлена на медико-генетическое консультирование для решения вопроса об углубленном обследовании второго партнера на носительство редких мутаций, вызывающих соответствующее заболевание. Преконцепционный скрининг относится к методам первичной профилактики наследственных заболеваний, поэтому в ходе подготовки к беременности целесообразно рекомендовать обследование на носительство мутаций, вызывающих наиболее распространенные наследственные болезни (муковисцидоз, фенилкетонурия и др.).
ВЫЯВЛЕНИЕ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К МНОГОФАКТОРНЫМ ЗАБОЛЕВАНИЯМ
Мультифакторные болезни (болезни с наследственной предрасположенностью) — заболевания, которые развиваются в результате взаимодействия определенных комбинаций генетических маркеров и специфических воздействий факторов окружающей среды. При этом именно особенности генотипа определяют тип реакции на внешние воздействия и устойчивость к этим воздействиям. Генотипирование позволяет оценить риски развития заболевания, наиболее значимые факторы риска и выбрать оптимальный метод профилактики или внести коррективы в тактику лечения.
Основное значение в акушерско-гинекологической практике имеет генетически обусловленная предрасположенность к нарушениям в системе гемостаза — склонность к тромбофилии или кровотечениям. Основными генетическими маркерами высокого риска тромбофилии являются дефекты генов II и V факторов свертывания крови (мутация гена протромбина и лейденская мутация). Согласно рекомендациям ВОЗ, наличие этих генетических маркеров является абсолютным противопоказанием для назначения оральных контрацептивов и гормональной заместительной терапии, поэтому генотипирование целесообразно проводить при выборе метода контрацепции. Также описаны генетические маркеры, определяющие переносимость гормональных препаратов.
Таким образом, выбор в качестве технологической платформы для рутинных исследований метода ПЦР в режиме реального времени позволяет обеспечить качественной молекулярной диагностикой широкие слои населения по приемлемой цене. Использование универсального оборудования для различных областей диагностики позволяет существенно сократить затраты на организацию лаборатории.
СПИСОК ЛИТЕРАТУРЫ
1.Бурменская О.В., Байрамова Г.Р., Непша О.С., Донников А.Е. Цитокиновый профиль иммунокомпетентных клеток влагалища при хроническом рецидивирующем вульвовагинальном кандидозе // Уральский медицинский журнал, 2011. № 3 (81).
С. 44–49.
2.Любченко Л.Н., Батенева Е.И. Медико-генетическое консультирование и ДНКдиагностика при наследственной предрасположенности к раку молочной железы и раку яичников: Пособие для врачей. М.: ИГ РОНЦ, 2014. 74 c.
5 ГЛАВА

|
102 |
МЕТОДЫДИАГНОСТИКИ |
1 |
3. |
Новик В.И. Скрининг рака шейки матки // Практическая онкология, 2010. Т. 11. |
РАЗДЕЛ |
|
№ 2. С. 66–73. |
|
|
|
|
4. |
Сухих Г.Т., Трофимов Д.Ю., Бурменская О.В. и др. Профиль экспрессии мРНК |
|
|
генов цитокинов в вагинальных мазках женщин репродуктивного возраста при |
|
|
неспецифическом вагините и бактериальном вагинозе // Акушерство и гинеколо- |
|
|
гия, 2011. № 7–2. С. 33–38. |
|
5. |
Borges S., Silva J., TeixeiraP. The role of lactobacilli and probiotics in maintaining vaginal |
|
|
health // Archives of gynecology and obstetrics, 2014. Vol. 289. N 3. P. 479–489. |
|
6. |
Lazenby G.B., Soper D.E., Nolte F.S. Correlation of leukorrhea and Trichomonas |
|
|
vaginalis infection // J Clin Microbiol, 2013. Vol. 51. N 7. P. 2323–2327. |
|
7. |
Mendling W. Vaginal Microbiota // Adv Exp Med Biol, 2016. Vol. 902. P. 83–93. |
|
8. |
Ronco G., Dillner J., Elfstrom K. M., at al. Efficacy of HPV-based screening for prevention |
|
|
of invasive cervical cancer: follow-up of four European randomised controlled trials // |
|
|
Lancet, 2014. Vol. 383. N 9916. P. 524–532. |
5.5. ЦИТОЛОГИЧЕСКИЙ МЕТОД В ДИАГНОСТИКЕ ЗАБОЛЕВАНИЙ ШЕЙКИ МАТКИ
Цитологический метод в диагностике заболеваний шейки матки [мазок на онкоцитологию, мазок по Папаниколау (Пап-тест)] — микроскопическое исследованиеклеток, полученныхс поверхности шейкиматкиицервикального канала, с целью выявленияих морфологических особенностей, указывающих на неопластические изменения.
ПОКАЗАНИЯ
Скрининг РШМ.
ПОДГОТОВКА К ИССЛЕДОВАНИЮ
В течение 24 ч перед исследованием необходимо воздержаться от половых контактов, спринцевания, использования вагинальных препаратов и тампонов. Нельзя брать материал для исследования во время менструации.
МЕТОДИКА ПОЛУЧЕНИЯ МАТЕРИАЛА
Материал из шейки матки должен брать врач-гинеколог или хорошо обученная медицинская сестра. Шейку матки обнажают в «зеркалах», при наличии большого количества слизи ее аккуратно снимают ватным тампоном. Для традиционного мазка материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и эндоцервикальной щетки. Полученный материал тонким слоем наносят на чистое сухое предметное стекло и в зависимости от метода последующего окрашивания мазка высушивают на воздухе или обрабатывают специальным фиксатором. Подсушенный мазок маркируют.
Для монослойного мазка (метод жидкостной цитологии) материал получают одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала с помощью специальной щетки. Центральную часть щетки вводят в цервикальный канал, боковые щетинки при этом распределяются на влагалищной части шейки матки. Слегка надавливая в направлении шейки матки, поворачивают щетку по часовой стрелке 3–5 раз, что обеспечивает гарантированное получение достаточного количества клеточного материала. Съемную головку щетки вместе с собранным материалом помещают в виалу со стабилизирующим раствором.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
