
Неорганическая химия / Астахов М.В. Теория химической связи
.pdfные» газы, которые при охлаждении под давлением сжижаются и (кроме гелия) затвердевают. Силы, действующие при этом между молекулами, называют дисперсионными. Они играют большую роль при взаимодействии молекул всех типов. В отличие от электростатического (ориентационного) и индукционного, дисперсионное взаимодействие нашло объяснение только в рамках квантовой механики. Электроны в атомах и молекулах можно уподобить колеблющимся около ядра частицам — осцилляторам. Согласно квантовомеханическим представлениям электронный осциллятор даже при абсолютном нуле совершает колебания с так называемой нулевой энергией:
Ε= ½ hν0, |
(240) |
где ν0,,— частота колебаний осциллятора.
При сближении двух осцилляторов возникает чисто квантовомеханический эффект — понижение суммарной нулевой энергии осцилляторов на величину, называемую дисперсионной энергией:
U |
дис |
= −( |
3hν |
0 ) × |
|
α2 |
= |
3 |
αI |
1 |
|||||||||||
|
4 |
|
r6 |
4 |
r6 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
где I — потенциал ионизации молекулы. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Для неодинаковых частиц |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
U |
дис |
= −( |
3hν0 |
) × |
|
|
α1α2 |
|
|
I |
I |
|
1 |
||||||||
|
|
I1 + I |
|
2 r6 |
|||||||||||||||||
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
1 |
|
|||||||
В общем виде |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Uдис -С/r6, |
|
|
|
|
|
|
|
|
|
||||||
где С — константа Лондона; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C = |
3 |
α α |
|
I1I2 |
|
|
|
|
|
|
|
|
||||||
|
|
|
2 |
|
I1 + I2 |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
1 2 |
|
|
|
|
|
|
||||||||
(241)
(242)
(243)
(244)
Энергия дисперсионного взаимодействия так же, как ориентационного и индукционного, обратно пропорциональна шестой степени расстояния.
Особенностью дисперсионного взаимодействия является его всеобщность, так как во всех молекулах есть движущиеся электроны. Дисперсионное взаимодействие для неполярных молекул — главный и практически единственный источник сил Ван-дер-Ваальса. Дисперсионное взаимодействие вносит известный вклад также в энергию ионной связи в молекулах и кристаллах.
Другой важной особенностью, отличающей дисперсионное взаимодействие от ориентационного и индукционного, является его аддитивность. Например, если имеются три частицы, то общая энергия их взаимодействия (U123 ) слагается из энергий парного взаимодействия
U12, U23, U31)
U123= U12+U23+U31 |
(245) |
Упрощая, эту аддитивность можно объяснить как результат согласованного (в такт) движения электронных осцилляторов, которое понижает общую нулевую энергию системы.
81
Аддитивность дисперсионных сил проявляется в адсорбции, в процессах, связанных с конденсацией газа и др. Дисперсионные силы играют большую роль при взаимодействии не только отдельных молекул, но и макроскопических частиц, например коллоидных.
Таковы три основных типа сил Ван-дер-Ваальса, «ответственных» за притяжение между молекулами. Силы притяжения Ван-дер-Ваальса — дальнодействующие, энергия притяжения спадает с расстоянием медленно, пропорционально третьей — шестой степени расстояния. На коротких расстояниях заметными становятся силы отталкивания, возникающие при перекрывании замкнутых электронных оболочек молекул (обменные силы, «силы Паули», ан-дер-ваальсово отталкивание. Они возрастают при сближении очень быстро. Их называют короткодействующими. Энергию отталкивания аппроксимируют эмпирическими уравнениями:
Uотт =Aexp{-r/ρ} или Uотт= Br -n |
(246) |
где А и ρ (или В и n) — константы, определяемые из опыта; обычно n = 12
Энергия межмолекулярного взаимодействия слагается из энергии притяжения Uпр и отталкивания Uотт. На больших расстояниях преобладает притяжение, на очень коротких — отталкивание. Равновесное расстояние между молекулами в жидкости и кристалле устанавливается в результате баланса сил притяжения и отталкивания. Зависимость энергии межмолекулярного взаимодействия от расстояния r выражается потенциальной кривой (рис. 26). Глубина потенциальной ямы ε (ван-дер-ва-альсова энергия взаимодействия на равновесном расстоянии r0) мала: ~1÷5 кДж/моль (~ в 100 раз меньше энергии химической связи), равновесное расстояние между центрами молекул в жидкости или кристалле 3·10-10÷5·10-10 м (~ 3 ÷ 5 А) значительно превышает межъядерное расстояние в молекулах. Однако «китайской стены» между химическим и ван-дер-ваальсовым взаимодействием нет, природа взаимодействия одна и та же, электрическая. Аналитическое выражение для потенциальной кривой межмолекулярного взаимодействия можно представить следующими выражениями:
U = −( |
2 |
μ4 |
+2αμ2 + |
3α2 |
I )s−6 + Aexp{−s / ρ} |
(247) |
|||
|
4 |
||||||||
|
3 kT |
|
|
|
|
||||
U = −(2 |
μ4 |
+ 2αμ2 + |
3α2 |
I )s−6 + Bs−n |
(248) |
||||
|
4 |
||||||||
|
|
3 kT |
|
|
|
|
|||
82

Рис.31. Потенциальная кривая взаимодействия двух молекул
(r— расстояние между центрами молекул) U= Uпр+Uотт=(Uор + Uинд +Uдис )+Uотт
Анализ формулы (247) для U показывает, что ориентационная энергия значительна только для полярных молекул, имеющих большой дипольный момент, индукционная энергия обычно очень мала, и наиболее важным слагаемым в (247) является дисперсионная энер-
гия . Как уже было отмечено ранее показатель степени n в уравнении (247) имеет значение равное 12. В этой связи это уравненик может быть переписано в другом виде:
|
σ 12 |
−( |
σ |
6 |
|
(249) |
|
U = 4ε ( |
s |
) |
s |
) |
|
||
|
|
|
|
|
|
||
где σ и ε — постоянные; о равна тому значению r, при котором U=0 (диаметр столкновений); ε —максимальная энергия взаимодействия (или глубина потенциальной ямы). Часто это уравнение называют Леннард-Джонса или уравнением «6-12», («потенциалом 6—12»)
Параметры ε и σ находят из опыта. Межмолекулярное взаимодействие играет большую роль в свойствах газов и жидкостей и в химических процессах: в реакциях, протекающих в растворах, на поверхностях, в каталитических реакциях.
Поскольку энергия межмолекулярного взаимодействия во многих случаях не превышает 1000— 2000 Дж/моль, соединения за счет сил Ван-дер-Ваальса обычно не образуются. Этому препятствует тепловое движение (U«kТ). Однако при низких температурах, если U0»kТ, удается обнаружить комплексы, такие, как гидраты благородных газов, частицы типа Аг2, Хе2, АrНС1, АrN2 и др. Такие молекулы, образовавшиеся за счет ван-дер-ваальсового взаимодействия, называют ван-дер-ваальсовыми. Для них характерны большие равновесные расстояния и очень малые энергии связи. В принципе ван-дер-ваальсово соединение могут образовывать любые две молекулы, если U0»kТ.
4.2 Ионно-молекулярное взаимодействие.
Взаимодействие иона с молекулой — один из видов неспецифического взаимодействия, в основном близкий к электростатическому. Можно приближенно считать, что в основе связи ион — молекула лежит электростатическое, индукционное и дисперсионное взаимо-
–––––––––
Однако формулы для ван-дер-ваальсова взаимодействия неточны для коротких расстояний, сравнимых с размерами самих молекул
83
действие. Энергию электростатического и индукционного взаимодействия иона с полярной молекулой рассчитывают по формуле
U |
эл.инд |
= −( |
eμ |
+ |
αe2 |
) |
(250) |
|
r2 |
2r4 |
|||||||
|
|
|
|
|
где α —поляризуемость молекулы. В (250) пренебрегли поляризуемостью катиона. Из (250) видно, что основная компонента энергии еμ/r2 спадает пропорционально только расстоянию во второй степени, т. е. значительна даже на больших расстояниях. Для системы однозарядный ион — молекула воды на расстоянии 3·10-10м (3Ǻ) она приблизительно равна 40 кДж/моль. Поэтому ион — дипольное взаимодействие играет большую роль в растворах электролитов в полярных растворителях, где образуются относительно стабильные продукты взаимодействия иона с несколькими молекулами растворителя — сольваты (гидраты в водных растворах). Первичные гидратные комплексы для Li+, Nа+ и К+ содержат, согласно квантовохимическим расчетам, от 5 до 7 молекул воды на ион.
Между ионом и неполярной молекулой в растворе осуществляется в основном индукционное и дисперсионное взаимодействие:
U |
инд.−дисп |
= − |
α e2 |
− |
c |
(251) |
|
2r4 |
r6 |
||||||
|
|
|
|
Если у неполярной молекулы имеются легко поляризуемые электроны, например, π- электроны у бензола, возможно образование соединений с ионом металла путем частичного переноса π-электронного заряда на свободную орбиталь катиона (комплексы с переносом заряда, например Аg+ • С6Н6).
4.3 Водородная связь
Давно уже известно, что атом водорода может одновременно взаимодействовать с двумя различными атомами и поэтому имеет координационное число два. В этом случае атом водорода служит мостом между двумя частицами и его можно рассматривать как причину связи между атомами. Получающаяся связь намного слабее ковалентной, тем не менее, водородная связь имеет довольно большое значение. Это видно по многим физическим и структурным свойствам веществ. Кроме того, водородная связь имеет особое значение в физиологических процессах. Образование водородной связи можно представить следующим образом:
X — Н+У X — Н--У
где X и У — разные атомы.
Эта формула показывает, что атом водорода связан одновременно с обоими атомами X и У. Кроме того, подразумевается, что связь с У несколько отличается от связи с X. Это справедливо для всех случаев, кроме иона FНF . Структуру водородной связи можно понять на примере димера муравьиной кислоты (рис.32).
84
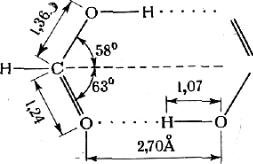
Рис.32. Образование водородной связи между двумя молекулами муравьиной кислоты
В этом случае водородный атом связан с двумя атомами кислорода, но длины связей указывают на то, что связи неодинаковы. Связь О—Н сохранилась, но ее длина увеличилась от 0,97Ǻ в мономере до 1,07Ǻ в димере.
Природу водородной связи пытались объяснить по-разному. Если допустить, что атом водорода может быть двухвалентным, то потребуется использование 1s-орбитали для одной связи и 2s-или 2p-орбитали для второй связи. Вследствие очень большого различия в энергии состояний 1s и 2s или 2р двухвалентность водорода мало вероятно. Вторая гипотеза предполагает существование резонансных структур; третья — предлагает рассматривать связь как электростатическую. Все эти три гипотезы были серьезно рассмотрены, и в настоящее время обычно считают, что водородную связь можно удовлетворительно объяснить с точки зрения электростатического взаимодействия.
Если считать водородную связь по происхождению только электростатической, то для описания ее характера как раз подходят ван-дер-ваальсовы силы. При этом наибольшая доля приходится на взаимодействие диполь — диполь, а диполь — индуцированный диполь и дисперсионные силы имеют небольшое значение.
Эти основные представления подтверждаются тем, что водородная связь образуется в том случае, когда X и У сильно электроотрицательные атомы: F, О, N и С1. Удивительно большая величина диполь — дипольного взаимодействия может быть объяснена малым размером атома водорода и отсутствием у него внутренних электронных уровней. Эти условия позволяют второму атому приблизиться на столь малое расстояние, которое невозможно при взаимодействии с другими положительными ионами, например ионами лития или натрия.
Хотя водородную связь обычно рассматривают только как электростатическое взаимодействие, с точки зрения теории валентных связей в ней есть признаки резонанса структур:
X —Н :Y (а)
X : -H+: Y (б)
X : -H — : Y+ (в)
Можно ожидать, что наиболее важной является структура (а), в которой есть нормальная связь X—Н. В структуре (в) связь Н—Y и прочность ковалентной связи будет незначительной. Так, в структуре льда, в которой X и У — атомы кислорода, величина связи О—Н несколько отличается от величины нормальной связи О—Н; длинная связь приблизительно на 0,80Ǻ больше нормальной связи О—Н. На этом основании было показано, что относи-
85
тельные количества этих структур соответственно равны 61, 34 и 5%14, а, следовательно, вполне законно считать водородную связь по существу электростатической.
Однако есть случаи, когда, по-видимому, все три резонансные структуры входят в конечное состояние системы в равной мере. Это наблюдается, когда расстояние Х...Х уменьшается больше чем обычно. Так обстоит дело в р-форме щавелевой кислоты, где расстояние О...О приблизительно 2,5Ǻ, но особенно верно это в исключительном примере иона FНF, имеющегося в соединении КНF2. В этом ионе атом водорода находится на равном расстоянии от обоих атомов фтора, и расстояние Н—F, как было найдено на опыте, только на 0,21Ǻ больше, чем в изолированной молекуле НF. Оба эти факта показывают, что все три резонансные структуры:
F : -Н — F (а)
F—H: F- (б)
F:- H + : F- (в)
в равной степени участвуют в связи. В этом особом случае энергия водородной связи в восемь раз больше, чем обычно, и имеет порядок 40 ккал/моль.
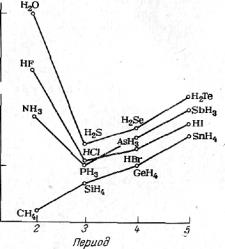
О сравнительной способности атомов к образованию водородной связи можно судить по точкам кипения водородных соединений. На рис. 31 показаны точки кипения водородных соединений элементов четырех групп неметаллов. Согласно изменению молекулярной массы и ван-дер-ваальсовых сил, имеет место ожидаемый ход кривой для СН4, SiН4, GеН4 и SnН4, а также для трех более тяжелых членов остальных трех групп. Для легких элементов каждой из последних трех групп обнаружено аномальное поведение.
Рис. 33. Влияние образования водородной связи на точки кипения водородных соединений неметаллов.
Необычно высокие точки кипения для НF, NН3 и Н2О указывают на наличие между молекулами этих веществ водородных связей. Интересно, что наиболее прочная водородная связь у НF, а самая высокая точка кипения у воды. Это можно объяснить образованием молекулой воды двух водородных связей, а молекулой фтористого водорода только одной. До сих пор были рассмотрены только межмолекулярные водородные связи, но существуют и
86
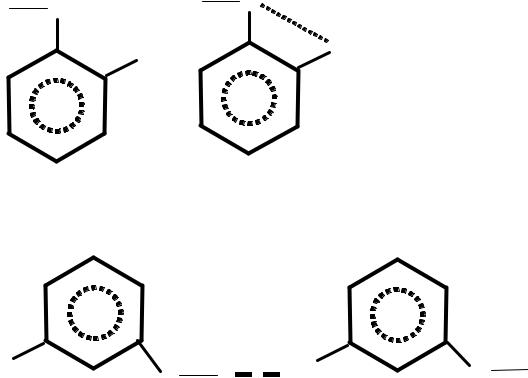
внутримолекулярные водородные связи, если они образуются между двумя атомами одной и той же молекулы. Этот тип водородной связи довольно распространён и также оказывает заметное влияние на химические и физические свойства вещества. В качестве примера можно рассмотреть три изомера хлорфенола. Для орто-изомера можно ожидать существования молекул и в цис-, и в транс-форме:
Рис.34.Строение цис- и транс-формы хлорфенола
Цис-форма будет устойчивее транс-формы вследствие образования внутримолекулярной водородной связи, обусловленной малым расстоянием между атомами водорода и хлора. Это действительно обнаружено на опыте. Спектральное изучение о-хлорфенола в четыреххлористом углероде показало, что содержится 91 % цис-формы и 9% транс-формы. Возможность образования водородной связи отражается также и на физических свойствах хлорфенолов (рис.34). Например, точка кипения о-хлорфенола равна 176°С, тогда как для мета- и параизомеров она значительно выше. Это объясняется тем, что у двух последних изомеров межмолекулярная водородная связь играет более важную роль, чем в ортоизомере.
87

88
89
90
