
Неорганическая химия / Астахов М.В. Теория химической связи
.pdf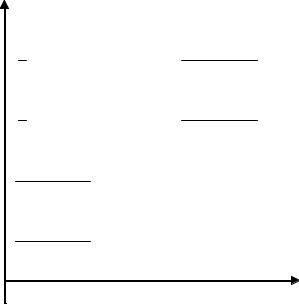
1. Спектроскопические методы исследования структуры молекул
Основным постулатом квантовой теории является предположение о дискретности энергетических уровней атомов и молекул. Спектры появляются при испускании или поглощении определенного кванта излучения вследствие переходов между определенными уровнями энергии. На рис. 1 схематически представлены некоторые уровни энергии молекулы (пока без указания характера этих уровней). На вертикальной оси отложены единицы энергии в произвольной шкале. Переход от состояния, обозначенного А, в состояние, помеченное В, происходит при поглощении кванта излучения. Если обозначить разность энергий между состояниями А и В через
E=hν
D
C
B
A
Рис. 1 Некоторые уровни энергии молекулы.
Е, то частота кванта передается соотношением Планка
v = Е / h, |
(1) |
где h — постоянная Планка, равная 6,6251710~27 эрг·сек. Переход из состояния D в состояние С происходит с испусканием кванта энергии. Несмотря на то что абсолютные значения энергии молекулы во всех четырех состояниях различны, величины этих двух квантов одинаковы и частоты идентичны, поскольку разности энергий состояний А—В и С—D одинаковы. Спектроскопические методы состоят в измерении таких квантов, и, следовательно, с помощью этих методов можно определять разности энергий двух энергетических уровней.
В атоме уровни энергии соответствуют различным разрешенным состояниям электронов. Молекула также может поглощать или испускать энергию вследствие переходов между различными электронными уровнями энергии. Но энергия молекулы может изменяться благодаря переходам еще двух типов, которые у атомов происходить не могут. Молекула может поглотить квант энергии и увеличить свою колебательную энергию, или же поглотить квант
11
энергии и увеличить свою вращательную энергию. Кванты, связанные с этими тремя типами уровней энергии — электронным, колебательным и вращательным, — сильно различаются по величине. В хорошем приближении их можно рассматривать независимо друг от друга и считать, что полная энергия Еп складывается из трех частей:
Еп = Еэл + Екол + Евр |
(2) |
Вобщем случае разность между электронными уровнями составляет по порядку величины —100 ккал/моль; между колебательными уровнями—~5 ккал/моль и между вращательными — ~0,01 ккал/моль. Поскольку средняя тепловая кинетическая энергия молекулы при комнатной температуре равна приблизительно 1 ккал/моль, из закона распределения Больцмана следует, что молекула при этих условиях должна находиться на низшем колебательном уровне основного электронного состояния, но может находиться на различных уровнях, связанных с вращательной энергии. Переходы между различными электронными уровнями вызывают появление спектров в видимой или ультрафиолетовой области; такие спектры называются электронными.
Переходы между колебательными уровнями в пределах одного электронного уровня приводят к появлению колебательных спектров в близкой инфракрасной области. Переходы между различными вращательными уровнями в пределах одного колебательного уровня порождают спектры в далекой инфракрасной или микроволновой области; эти спектры извест-
ны как вращательные.
Вдействительности переход между двумя электронными уровнями, как правило, сопровождается изменениями в колебательном и вращательном квантовых числах, так что электронные спектры, на самом деле, являются спектрами электронно-колебательно- вращательными. Аналогично колебательные спектры фактически являются колебательновращательными, и их обычно так и называют. Спектры, соответствующие наименьшим изменениям энергии, известны как чисто вращательные спектры.
На рис.2 представлена диаграмма, иллюстрирующая распределение различных уровней энергии. Показаны два электронных уровня Е' и Е". Нижний уровень Е" включает ряд колебательных уровней, обозначенных колебательным квантовым числом ν" = 0, 1, 2, ..., а каждый колебательный уровень имеет свои собственные вращательные уровни, обозначенные вращательным квантовым числом J" = 0, 1, 2 ... . Точно так же верхний электронный уровень Е' включает колебательные уровни ν΄= 0, 1, 2, ... и каждый колебательный уровень имеет вращательные уровни J' = 0, 1, 2 ... .
1.1 Кривые потенциальной энергии
Некоторые представления предыдущего раздела станут, вероятно, более понятными после рассмотрения кривой потенциальной энергии двухатомной молекулы. Такая молекула состоит из двух положительно заряженных ядер и некоторого числа электронов. Устойчивому состоянию молекулы соответствует минимум потенциальной энергии системы. Этот минимум появляется в результате равновесия между отталкиванием двух положительно заряженных ядер и притяжением электронов к ядрам, обусловливающим связь.
12
Р и с. 2 Электронные, колебательные и вращательные энергии двухатомной молекулы.
Отталкивание проявляется на малых расстояниях между ядрами r, но очень быстро растет при дальнейшем уменьшении r. Притяжение слабее зависит от r и действует на больших расстояниях. Результат сложения этих двух сил изображен схематически на рис. 3.
При стремлении r к бесконечности сила притяжения асимптотически стремится к ну-
лю. За нуль потенциальной энергии принимается потенциальная энергия двух атомов, отстоящих друг от друга на бесконечно большое расстояние. В действительности сила при-
тяжения проявляется лишь на расстоянии в несколько ангстрем.
Будем считать, что один атом жестко закреплен на вертикальной оси, в то время как другой колеблется около положения минимума на кривой, так что межатомное расстояние меняется в соответствии с ходом кривой. Колебательная энергия квантуется; это изображено горизонтальными линиями с колебательным квантовым числом ν = 0,1,2 ... .
13
0
re |
r |
Рис. 3. Кривая потенциальной энергии двухатомной молекулы
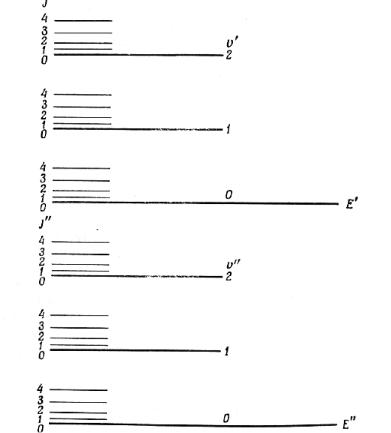
При небольших отклонениях атомов от положений равновесия, определяемых минимумом на кривой, возвращающая сила пропорциональна смещению, и атомы совершают колебания, которые можно рассматривать как простое гармоническое движение в соответствие с законом Гука. Поэтому нижняя часть кривой имеет форму параболы. При больших колебательных энергиях сжать молекулу становится труднее, чем вытянуть, и кривая уже не является параболой — колебания становятся ангармоническими. При достаточно больших значениях колебательной энергии молекула диссоциирует.
Следует отметить, что значение энергии в минимуме кривой не совпадает с энергией основного колебательного состояния с ν = 0. Иными словами, даже если отнять у молекулы все кванты колебательной энергии, охладив ее до абсолютного нуля, молекула все же будет колебаться. Это следует из принципа неопределенности Гейзенберга, гласящего, что
х• р ~ h |
(3) |
где х — неопределенность координаты частицы, а р — неопределенность ее импульса. Таким образом, положение частицы можно определить совершенно точно только при условии, что её импульс бесконечен и, наоборот, точно узнать импульс можно лишь при полной неопределенности в значении координаты. В минимуме на кривой межъядерное расстояние точно известно и импульс частицы равен нулю, так что принцип неопределенности нарушается. Поэтому минимум представляет собой лишь гипотетическое состояние молекулы, и даже в состоянии с наименьшей колебательной энергией молекула продолжает совершать колебания. Разность энергий между минимумом на кривой и низшим колебательным состоянием при n = 0 называется нулевой энергией колебания.
Гипотетическое межъядерное расстояние, соответствующее минимуму на кривой, известно как равновесное межъядерное расстояние r. Расстояние от асимптоты до минимума дает нам спектроскопическую теплоту диссоциации De.
Химической теплотой диссоциации D0 называется расстояние от асимптоты до основного колебательного состояния при n = 0.
14
1.2 Равновесное межъядерное расстояние rе и кажущееся межъядерное расстояние r0
В некоторых простых случаях и можно найти величину равновесного межъядерного расстояния r, в действительности чаще всего определяют межъядерное расстояние в основном колебательном состоянии молекулы, так как при комнатной температуре большинство молекул находится в этом состоянии. Здесь, однако, возникают трудности, поскольку в низшем колебательном состоянии молекула колеблется, а, следовательно, межъядерное расстояние непрерывно меняется. Обозначим мгновенное расстояние между двумя ядрами молекулы в основном колебательном состоянии в данный момент времени r и предположим, что под r0 подразумевается величина, называемая часто «межъядерным расстоянием в основном колебательном состоянии». Чтобы получить точное выражение для r0, необходимо каким-то образом определить r0 как среднее значение r. Вопрос, однако, заключается в том, какое именно среднее значение следует выбрать. На первый взгляд может показаться, что надо просто условиться о выборе среднего значения для этой цели. Но вопрос не ограничивается просто номенклатурой, и трудность имеет гораздо более фундаментальный характер. Теория, лежащая в основе каждого экспериментального метода, обязательно приводит к выбору своей средней величины, и не все эти средние величины совпадают. Так, например, в спектроскопических методах определяется средняя величина 1/r2, так что спектроскопическое среднее выражается как
1 |
|
1 |
1/ 2 |
|
|
= |
|
|
(4) |
r0 |
|
|||
r2 |
ср |
|
||
Из теории ядерного магнитного резонанса для твердых тел следует, что эта же величина может быть определена из полученных с его помощью экспериментальных данных. Формула для расчета этой величины будет иметь следующий вид:
1 |
|
1 |
1/ 6 |
|
|
= |
|
|
(5) |
r0 |
|
|||
r6 |
ср |
|
||
Трудности усугубляются тем, что величина, определяемая с помощью дифракционных методов, вообще, является не межъядерным расстоянием, а усредненным по времени расстоянием между центрами тяжести двух электронных облаков. Тем не менее конечный результат, полученный каждым из этих методов, называют величиной rо, для того чтобы отличить r0 от r,. Величины r0, определенные с помощью разных экспериментальных методов, мало отличаются друг от друга. Следует, однако, помнить, что разные методики определяют r0 не совсем одинаково; если сравнить длину одной и той же связи, полученную двумя различными путями, то в действительности это две несколько отличающиеся величины. Для того чтобы подчеркнуть такую неопределенность r0, называют кажущимся межъядерным расстоянием.
1.3 Инфракрасная спектроскопия и спектры комбинационного рассеяния
Молекулярные спектры, как правило, наблюдаются при поглощении. Так, например, в инфракрасной спектроскопии пучок инфракрасного излучения, испускаемый телом, нагре-
15
тым до красного каления, проходит через образец исследуемого вещества и затем разлагается с помощью призмы или решетки. С помощью детектора и последующего анализа находят зависимость интенсивности излучения от частоты и затем, путем сравнения с исходным спектром источника, находят частоты, при которых интенсивность уменьшилась, после прохождения через образец. Эти частоты и соответствуют частотам поглощения молекулы.
Необходимо рассмотреть и другой эффект — комбинационное рассеяние света, которое часто используют в качестве дополнения к описанному выше явлению. При комбинационное рассеяние света преобразование первичного светового потока сопровождается обычно переходом рассеивающих молекул на другие колебательные и вращательные уровни, причём частоты новых линий в спектре рассеяния являются комбинациями частоты падающего света и частот колебательных и вращательных переходов рассеивающих молекул.
1.4Применение спектроскопии
Втабл. 1 приведены три типа наблюдаемых спектров и величины, которые можно найти из исследований в каждой области электромагнитного спектра. Здесь подчеркнуты некоторые существенные вопросы. Во-первых, если можно исследовать вращательную тонкую структуру спектров, то это позволяет определить параметры молекулы, что можно сделать во всех трех рассматриваемых областях. Во-вторых, данные о симметрии молекул также можно выявить из исследований во всех трех частях спектра.
Спектроскопия в ультрафиолетовой области не имеет большого значения для изучения строения молекул. Но она может дать ценную информацию о составе больших молекул, связи между цветом и составом, размерах и форме осколков молекул, электронном строении молекул и форме кривых потенциальной энергии, т. е. о многом, что редко удается определить из чисто вращательных или колебательно-вращательных спектров.
Таблица 1. Типа наблюдаемых спектров и величины, которые можно найти из исследований в каждой области электромагнитного спектра.
Спектр |
Уровни энергии |
Величины, которые можно оп- |
|
ределить |
|||
|
|
||
Чисто вращательный |
Вращательные |
Симметрия молекулы |
|
Параметры молекулы |
|||
|
|
||
|
Вращательные |
Симметрия молекулы |
|
Колебательно-вращательный |
Параметры молекулы |
||
|
|||
|
Колебательные |
Симметрия молекулы |
|
|
Вращательные |
Симметрия молекулы Пара- |
|
Электронный |
метры молекулы |
||
|
|||
Колебательные |
Симметрия молекулы |
||
|
|||
|
Электронные |
|
1.5 Правила отбора
Из сказанного выше можно было бы заключить, что переходы могут происходить между любыми уровнями энергии. На самом деле это не так. Точно так же, как атом может переходить из состояния s в состояние p, а из p в d, но не прямо из s в d, существуют ограничения для изменения состояния молекул. Эти ограничения известны как правила отбора. Различают два вида правил отбора. Условия, определяющие изменения отдельных квантовых
16
чисел, как в только что приведенном примере для атомов, называются частными правилами отбора; они используются при рассмотрении различных типов спектров.
Имеются также общие правила отбора, с помощью которых можно определить, даст ли вообще молекула колебательный или вращательный спектр. Общих правил отбора, относящихся к видимой или ультрафиолетовой области, не существует, поэтому все молекулы имеют электронные спектры. С другой стороны, гомоядерные двухатомные молекулы, такие, как Cl2, не могут дать колебательный спектр в инфракрасной области вследствие действия общих правил отбора. Оба типа правила отбора основаны на симметрии, и фундаментальных отличий между ними нет.
Если ограничиться двухатомными молекулами, то ознакомиться качественно с общими правилами отбора весьма легко. Когда колеблется гетероядерная молекула, такая, как HCI, происходит результирующее колебательное смещение заряда. Молекула ведет себя как изолированный колеблющийся заряд и может взаимодействовать с электрической компонентой любого падающего излучения. Колебание разрешено и активно в инфракрасной области. В гомоядерной двухатомной молекуле типа Сl2, наоборот, вследствие симметрии любое смещение одной половины молекулы сбалансируется равным по величине и противоположным по знаку изменением в другой половине. Поэтому результирующего смещения заряда здесь не происходит, а значит, не возникает и взаимодействия с падающим излучением. Колебание не активно в инфракрасной области.
В действительности вследствие конечной скорости света и, следовательно, конечного времени, необходимого для передачи возмущения от одной половины молекулы к другой, ни один переход не является абсолютно запрещенным, и любое вращательное и колебательное движение взаимодействует в некоторой степени с падающим излучением. Однако интенсивность разрешенных переходов приблизительно в I08 раз превосходит интенсивность запрещенных переходов.
Эти соображения также применимы к многоатомным молекулам, с той только разницей, что для них нужно рассматривать не одно колебание, а несколько. Каждую частоту колебания можно ассоциировать с различными движениями ядер. Для того чтобы колебание было активным в инфракрасной области, движение ядер должно приводить к изменению дипольного момента молекулы. Это не значит, что у молекул (за исключением двухатомных) должен быть постоянный дипольный момент, так как колебание может вызвать изменение дипольного момента от нуля до конечного значения. Общее правило отбора можно, поэтому сформулировать следующим образом: для проявления частоты в инфракрасной области должно выполняться условие
dμ |
≠ 0 |
(6) |
|
dq |
|||
|
|
где (μ— дипольный момент молекулы, a q — одна или несколько координат, определяющих движение ядер).
Аналогично можно показать, что молекула будет иметь вращательный спектр в далекой инфракрасной или микроволновой области, если ее дипольный момент меняется относительно направления падающего излучения при вращении молекулы. Для этого молекула
17
должна обладать постоянным дипольным моментом. Поэтому общее правило отбора для появления чисто вращательного спектра записывается в виде
μ≠0 |
(7) |
Применительно к комбинационному рассеянию общее правило отбора для колебательного спектра гласит, что движение ядер должно приводить к изменениям поляризуемости молекулы
dα |
≠ 0 |
(8) |
|
dq |
|||
|
|
где α — поляризуемость молекулы.
Поскольку поляризуемость гомоядерных двухатомной молекулы всегда изменяется при изменении длины связи, у такой молекулы должен наблюдаться колебательный спектр комбинационного рассеяния. Наконец, для появления вращательного спектра комбинационного рассеяния молекулы необходимо, чтобы поляризуемость молекулы перпендикулярно к оси вращения была различной в разных направлениях и чтобы при вращении молекулы поляризуемость менялась относительно на правления падающего излучения. Любая молекула, обладающая осью вращения с порядком три или выше, не дает линии по вращательном спектре комбинационного рассеяния, соответствующих вращению вокруг главной оси, поскольку поляризуемость в любых направлениях, перпендикулярных к главной оси, одинакова. Так, бензол не дает вращательного спектра комбинационного рассеяния, соответствующего вращению вокруг оси шестого порядка. Такой спектр появляется у бензола только в результате вращения вокруг осей, лежащих в плоскости молекулы. Общие правила отбора суммированы в таблице 2.
Таблица 2. Общие правила отбора, определяющие активность в инфракрасном спектре и спектре комбинационного рассеяния
Спектр |
Общие правила отбора |
|
Колебательный инфракрасный |
Колебание должно происходить с изменением дипольно- |
|
го момента молекулы |
||
|
||
Колебательный спектр комбинацион- |
Колебание должно происходить с изменением поляри- |
|
ного рассеяния |
зуемости молекулы |
|
|
|
|
(Вращательный инфракрасный) |
Молекула должна обладать постоянным дипольным мо- |
|
Микроволновой |
ментом |
|
Вращательный спектр комбинацион- |
Поляризуемость перпендикулярно к оси вращения долж- |
|
ного рассеяния |
на быть анизотропной |
1.6 Единицы и номенклатура
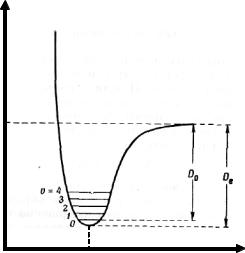
Электромагнитным спектр охватывает огромную область частот, и спектроскописты, работающие в различных областях спектра, сочли удобным цвести свои собственные единицы измерения. Эти единицы выбирались обычно таким образом, чтобы числа имели разумные величины, и не приходилось включать число 10 в высоких степенях. В рентгеновской, ультрафиолетовой и видимой области, спектроскописты пользуются длиной волны излучения и измеряют ее в ангстремах. В ближней и дальней инфракрасной области для измерения длины волны используют микроны. Однако в инфракрасной области часто оказывается
18
удобнее иметь дело с волновым числом (ω), т. е. числом длин волн в одном сантиметре.
Волновое число равно частному от деления истинной частоты на скорость света. Единицей измерения волнового числа служит обратный см-1.
На рис. 4 приведен электромагнитный спектр от рентгеновских лучей до микроволн. Шкала длин волн на рис. 4 логарифмическая; в соответствующих областях спектра указаны некоторые часто встречающиеся единицы.
Рис. 4. Электромагнитный спектр от рентгеновских лучей до микроволн
1.7 Вращательные спектры двухатомных молекул
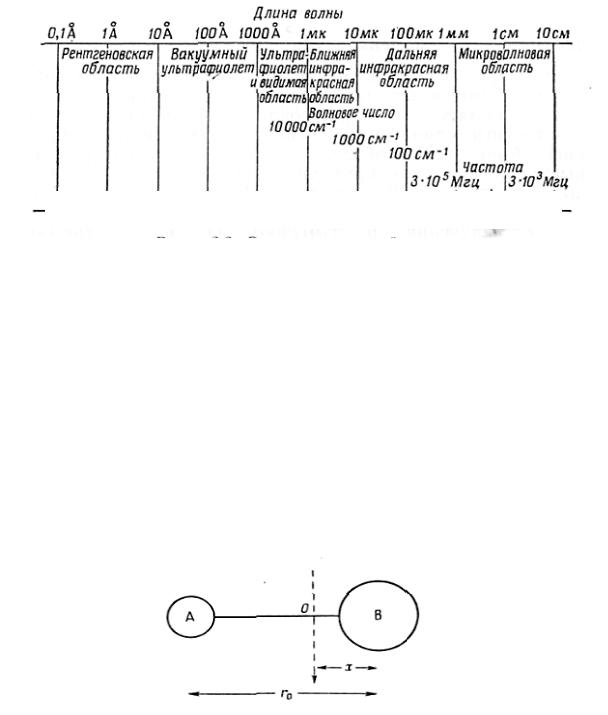
Исследование чисто вращательных спектров является мощным методом определения молекулярных параметров простых молекул, которые можно получать в газовой фазе. Для того чтобы молекула могла дать чисто вращательный спектр, должно выполняться общее правило отбора, т. е. молекула должна обладать постоянным дипольным моментом. В качестве подходящей модели для интерпретации чисто вращательных спектров можно выбрать два атома А и В с массами mA и mB, находящихся па фиксированном расстоянии rо друг от друга (рис. 5). Такая система называется жестким ротаторам. Если подобная молекула вращается вокруг оси, проходящей через центр тяжести 0 перпендикулярно к линии, соединяющей ядра, то
Рис. 5 Двухатомная молекула АВ
выражение для момента инерции (I0) имеет вид
19
I |
0 |
= m |
(r − x)2 |
+ m |
x2 |
(9) |
|
A |
0 |
B |
|
|
где х—расстояние от атома В до центра тяжести молекулы. Если записать выражение для моментов относительно центра тяжести О, то
|
|
mA (r0 − x) = mB x |
|
|
|
|
(10) |
|||||||||||||
Отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x = |
|
mAr0 |
|
|
|
|
(11) |
|||||||||
|
|
|
|
mA + mB |
|
|
|
|
|
|
|
|||||||||
Следовательно, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
2 |
|
mAmB |
|
2 |
|
||
|
|
mAr0 |
|
|
|
|
mAr0 |
|
|
|
||||||||||
I0 = mA r0 |
− |
|
|
|
+mB |
|
|
|
|
|
|
= |
|
r0 |
(12) |
|||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
mA +mB |
|
|
|
mA +mB |
mA +mB |
|
|
|||||||||||
Приведенная масса М молекулы выражается как |
|
|
|
|
|
|||||||||||||||
|
|
|
1 |
= |
1 |
+ |
|
1 |
|
|
|
|
|
|
|
(13) |
||||
|
|
|
M |
|
|
mB |
|
|
|
|
||||||||||
|
|
|
|
|
mA |
|
|
|
|
|
|
|||||||||
Тогда из равнения (13) следует, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
I |
0 |
|
= Mr |
2 |
|
|
|
|
|
|
|
(14) |
|||
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
||||
Это означает, что молекулу, вращающуюся вокруг своего центра тяжести, можно рассматривать как одну частицу с массой М, описывающую круг радиуса r0. Движение частицы по кругу — задача, хорошо известная в квантовой механике, и для нее можно найти точное решение уравнения Шредингера. Здесь, как и всюду, оказывается, что энергия системы может принимать только некоторые дискретные значения; эти значения передаются выражением
E |
вр |
= |
h2 J (J +1) |
= |
h2 J (J +1) |
= B hJ (J +1) |
(15) |
||||
2Mr2 |
|
2I |
|
|
|
||||||
|
|
|
|
0 |
|
0 |
|||||
|
|
|
0 |
|
|
|
|
|
|
||
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B0 = |
h |
|
|
|
(16) |
||
|
|
|
|
2I |
0 |
|
|
||||
|
|
|
|
|
|
|
|
|
|||
Величина В0 называется вращательной постоянной; индекс при ней показывает, к какому колебательному состоянию эта константа относится. Вращательное квантовое число J может принимать целочисленные значения, включающие нуль. При J=0, Евр,=0 и вращательная энергия отсутствует. Иными словами, у вращательного движения не существует нулевой энергии. Таким образом, принцип Гейзенберга нарушен не будет. Здесь rо кажущиеся межъядерное расстояние.
20
