
Неорганическая химия / Астахов М.В. Теория химической связи
.pdf
Аналогично
∂Ψ2 |
|
= −b2 |
3 cosθ − |
2 |
sinθ = 0 |
(155) |
|
|
∂θ |
|
3 −12b2 |
|
|||
|
b2 |
|
|
|
|
|
|
Из этих двух уравнений можно определить угол θ и b2 параметр. Если произвести преобразования то получим sinθ=1/3, b2=1/2√3.
Теперь можно вычислить новую гибридную орбиталь и найти ее угол по отношению к первой гибридной орбитали. После подстановки найденных значений для θ и b2 в уравнение (153) получим
Ψ2=2.
Получилась та же величина, что и для Ψ1, значит обе связи одинаковы по прочности. Что касается угла θ, то для sinθ =1/3 θмакс будет равен 19°28' или 160°32'. Первая величина соответствует положительному знаку при d2. Так как необходимо, чтобы угол φ был равен 180°, очевидно, что по отношению к первой связи угол θ будет 90°+19°28' = 109°28'.
Подобными расчетами можно определить углы и величины остальных двух связей. В общем виде волновые функции четырех орбиталей следующие:
|
|
|
Ψ = 1ψ |
s |
+ |
|
3 |
ψ |
px |
|
|
|
(156а) |
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
1 |
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Ψ = |
|
1ψ |
s |
− |
|
1 |
|
ψ |
|
|
+ |
|
2 |
ψ |
pz |
(156б) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
2 |
|
2 |
|
2 |
|
|
3 |
|
|
px |
|
3 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Ψ = 1ψ |
s |
− |
|
|
1 |
|
ψ |
|
|
+ |
|
|
1 |
ψ |
|
− |
1ψ |
(156в) |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
3 |
2 |
|
2 |
3 |
|
|
|
px |
|
|
2 |
|
|
|
p y |
6 |
pz |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Ψ = 1ψ |
s |
− |
|
|
1 |
|
|
ψ |
|
|
− |
|
|
1 |
ψ |
|
− |
1ψ |
(156г) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
4 |
2 |
|
2 |
3 |
|
|
|
px |
|
|
2 |
|
|
|
p y |
6 |
pz |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Все углы равны 109°28', а относительные величины связей — 2. В молекуле метана, как известно, все четыре связи равноценны и углы НСН равны 109°28'.
Рис.17 sp3 – гибридные орбитали атома углерода.
Таким образом, теория валентных связей оказалась в состоянии дать удовлетворительное объяснение тетраэдрическому атому углерода. Тетраэдрические гибридные связи образуются из одной s- и трех р-орбиталей, поэтому их называют sp3-гибридами.
51

Структуры с двойной связью объясняют посредством образования sр2-гибридных орбиталей. Для такой молекулы, как этилен, можно изобразить схематично скелетную структуру С2Н4
Рис. 18 Схема, показывающая образование химических связей в молекуле С2Н4
Рис. 19. Перекрывание σ- и π-орбиталей в молекуле этилена
Рис.20. Расположение электронных облаков при sp2-гибридизации
52
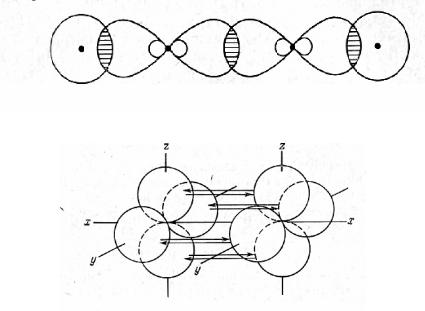
Как видно, у каждого атома углерода есть три σ-связи. Они получаются из 2s- и двух 2рэлектронов атома углерода, образуя sр2-гибридизацию. При гибридизации каждой из этих трех орбиталей получаются три равноценные связи, лежащие в одной плоскости под углом 1200. Длина этих связей по отношению к длине s-орбитали больше в 1,991 раза, что меньше, чем для sр3-гибридной орбитали, но значительно больше, чем для чистой s- или чистой р- орбиталей. Это показано на рис. 19. Перекрывание sр2-гибридных орбиталей ведет к образованию σ-связей, а перекрывание р-орбиталей — к образованию π-связи. Рисунок показывает, почему вокруг двойной связи затруднено вращение: чтобы один из атомов углерода вращался вокруг оси, соединяющей центры двух атомов углерода, необходимо нарушить перекрывание π-орбиталей. Наконец, для ацетиленового типа связи скелетная структура будет
Н─С─С─Н
Эта структура требует для образования гибридной связи только 2s- и одну из 2рорбиталей. В этом случае по два р-электрона у каждого атома углерода не участвуют в образовании σ-связей. Расчет пространственного расположения и относительной прочности двух равноценных sр-гибридных связей согласуется с определенной на опыте структурой молекулы. Обе связи одинаковой прочности и расположены линейно. Характер тройной ацетиленовой связи обусловлен перекрыванием двух р-орбиталей, оставшихся у каждого атома углерода - (рис. 21).
Рис.21 Образование тройной связи в молекуле ацетилена
Кроме успешного объяснения стереохимии соединений углерода, теория валентных связей, также успешно объяснила строение координационных соединений. В этом случае обычно необходимо принимать во внимание влияние d-орбиталей. Наиболее часто получаются dsр2-гибридные связи, обусловливающие плоскую квадратную структуру, и dsр3- гибридные связи, приводящие к октаэдру. В таблице-2 приведена геометрическая модель и относительная прочностью (прочность чистой s-орбитали принята за единицу) для некоторых типов связей.
53

Строение молекул воды, аммиака и аналогичных им соединений было рассмотрено раньше в предположении образования чистой р-связи. При этом было рассчитано, что угол НХН должен быть равен 90°, т. е. величине, значительно отклоняющейся от опытных данных, как для воды, так и для аммиака. Строение этих соединений можно рассмотреть, предположив наличие гибридизации связей.
В таблице 8 приведены относительная прочность и угловые распределения связывающих орбиталей, как видно из этих данных, наибольшую прочность связи из трех при гибридизации s- и p атомных орбиталей имеет sp3.
Таблица 8. Относительная прочность и угловые распределения связывающих орбиталей
Координационное |
Заселенные |
Угловое |
Относительная |
число |
орбитали |
распределение |
прочность связи |
1 |
s |
|
1,000 |
3 |
p |
|
1,432 |
2 |
sp |
линейное |
1,932 |
3 |
sp2 |
плоское |
1,991 |
4 |
sp3 |
тетраэдрическое |
2,000 |
4 |
dsp |
плоское квадратное |
2,694 |
6 |
d2sp3 |
октаэдрическое |
2,923 |
3.5 Метод молекулярных орбиталей (ММО)
Для ВС характерно допущение, что атомы в молекуле в значительной степени сохраняют свою индивидуальность. Предполагается, что электроны в молекуле описываются функциями, построенными из неизменных атомных функций ϕа и ϕв. Это приближение справедливо только при больших расстояниях, т.к. возмущение, вносимое вторым атомом на расстояниях 10-8 см, настолько мало, что оно не должно искажать атомные орбитали.
Другой способ рассмотрения предложил Гунд, Милликен, Леннард-Джонсон и др. Их подход носит название МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ. Они подошли к молекуле, как к атому. Электроны двигаются в поле нескольких ядер и находятся в определенных состояниях. Можно найти состояния электронов, т.е. эти молекулярные орбиты. Но решить уравнение Шредингера в этом случае не удается, мы с этими трудностями уже встречались при рассмотрении многоэлектронных атомов. Они могут быть преодолены, если рассмотреть простой атом водорода, как прототип атома, затем распространить найденные закономерности на другие элементы. Аналогичный подход ими был развит и для молекул.
В качестве прототипа двухатомных молекул можно взять простейшую молекулу Н2+, т.е. электрон и два протона. Если мы найдем возможные состояния (уровни) для одного электрона, то многоэлектронные молекулы можно построить, распределив электроны по этим уровням. Задача усложняется, если ядра имеют разные заряды. Предположим, что мы имеем два голых ядра без электронов. Отличие от атома заключается лишь в том, что мы удерживаем эти два положительно заряженных ядра на месте на определенном расстоянии. Будем последовательно заполнять МО в порядке возрастания энергии с учетом принципа Паули. Взаимодействием электронов друг с другом учитывать не будем. Вопрос об устойчивости молекулы решается очень просто, если энергия такой системы меньше, чем энергия разъединенных атомов, то молекула устойчива. С этим мы уже встречались в ВС. Это другой подход к проблеме химической связи, со своими приближениями, но не исключающий метод валентных связей, а дополняющий его. Метод ВС объясняет образование молекулы за
54
счет обменной энергии двух электронов, т.е. пары электронов с разными спинами. Этот метод был бы полностью хорош, если бы не молекулы типа NO, NO2, ClO2 и т.д., радикалы и даже O2. Последняя молекула вроде бы хорошо должна описываться методом ВС, но эксперимент (магнитные измерения) утверждает, что в молекуле присутствуют два электрона с одинаково направленными спинами, что не может быть описано в рамках этого подхода. МО исходит из волновых функций для всех валентных электронов в молекуле, т.е. считает, что каждый электрон находится на своей молекулярной орбите, описываемой своей волновой функцией. Каждой орбите соответствует своя энергия. На одной орбите не могут находиться более двух электронов, при этом они должны иметь разные спины. Волновую функцию, описывающую все электроны в системе, можно представить в виде произведения отдельных волновых функций для каждого электрона этой системы.
ψ=ϕ1 ϕ2 ϕ3 ϕ4 ϕК |
(157) |
В методе МО находят приближенные выражения для указанных одноэлектронных функций.
Таким образом, если говорить об этом методе, то в его основу положена, аналогичная модели атома, модель орбитального приближения:
1.Молекула рассматривается как целое, а не совокупность отдельных атомов, каждый электрон принадлежит молекуле в целом и движется в поле, создаваемом всеми ядрами и электронами.
2.Состояние каждого электрона в молекуле описывается одноэлектронной волновой функцией его координат ϕК характеризуемой определенным набором квантовых чисел. (Одноэлектронная волновая функция – собственная функция, являющаяся решением уравнения Шредингера для системы с одним электроном). Эта функция называется молекулярной орбиталью (МО). В отличие от атомной орбитали, она многоцентровая, т.к. число ядер в молекуле не может быть меньше двух.
3.|ϕк|2 – определяет плотность вероятности нахождения электрона или плотность электронного облака. Волновая функция, учитывающая и спин электрона, называют молекулярной спин-орбиталью.
4.Каждой МО соответствует определенная энергия электрона, приближенно характеризующаяся потенциалом ионизации с заданной орбиты. (Теорема Купиенса).
5.Энергия электронов на МО есть сумма его кинетической и потенциальной, которая складывается из энергии притяжения его ко всем ядрам εпр и отталкивания от всех остальных электронов εот.
6.Совокупность МО в молекуле, занятых электронами, называется ее электронной конфигурацией. Электронная конфигурация молекулы строится на основе двух фундаментальных положений: принципа наименьшей энергии и принципа Паули. Для описания электронной конфигурации основного состояния молекулы с 2n или 2n-1 электронами требуется n МО. При размещении электронов на вырожденных МО соблюдается правило Гунда.
7. Координатная волновая функция основного состояния молекулы в нулевом приближении задается в виде произведения одноэлектронных волновых функций, занятых электронами молекулярных орбиталей (уравнение 157).
55
Электронная энергия системы при этом приближении равна сумме орбитальных энергий, занятых электронами МО минус энергия усредненного отталкивания электронов.
Εэл=2ΣЕк - Еуср |
(158) |
Епол=Еэл+Еот.яд |
(159) |
8.Волновая функция должна строиться в виде определителя подобно тому, как это было сделано для многоэлектронного атома, только с использованием не атомарных, а молекулярных спин-орбиталей.
9.При переходе хотя бы одного электрона молекулы с занятой на более высокую свободную МО, молекула переходит из основного в возбужденное состояние. Волновая функция возбужденного состояния в нулевом приближении строиться аналогично, с учетом занятой возбужденным электроном орбиталью. Энергия возбужденного состояния рассчитывается по уравнению:
Εэл=ΣνiЕi - Еуср |
(160) |
ν=1 или 2, в зависимости от заполнения уровня. Еi – орбитальная энергия занятой МО. Для молекулы существует строго определенный набор дозволенных состояний ϕмол 1 ϕмол 2 ϕмол К, которым отвечает определенная энергия. Переход между этими состояниями происходит с поглощением или излучением квантов энергии, что обуславливает электронный спектр каждой молекулы.
Наиболее точные расчеты в орбитальном приближении для молекул выполнены методом самосогласованного поля (ССП). Но при этом удается лишь частично учесть взаимодействие электронов, т.к. в нашем приближении допускается возможность одновременного присутствия электронов в одной точке пространства. Это можно учесть, введя некоторую корреляционную функцию.
Молекулярные орбитали, вычисленные методом ССП, наиболее близко описывают свойства молекул и называются орбиталями Хартри-Фока или спектроскопическими.
Метод МО имеет много вариантов, которые приближенно описывают свойства молекул. Основная задача состоит в том, чтобы грамотно построить молекулярную функцию, поскольку она является решением уравнения Шредингера, т.е. с ее помощью находят энергию молекулы, а, следовательно, и все другие ее характеристики. Для построения волновой молекулярной функции очень часто используют наиболее простой для вычислений метод. В этом методе волновую молекулярную функцию представляют в виде линейной комбинации атомарных функций атомов, участвующих в образовании молекулы.
ψмол=С1ϕАО1 +С2ϕАО2 +С3ϕАО3 + + СКϕАОК |
(161) |
СКϕАОК – волновая функция (атомные орбитали) электронов атомов, из которых образована данная молекула, а С – коэффициенты .
Это приближение основано на учете того, что энергия несвязанных между собой атомов гораздо больше, чем энергия связи между ними ЕА+ЕВ>>ЕА-В. Все изменения могут быть учтены с помощью СК.
Наиболее простой случай МО образования из двух атомных орбиталей одинаковых атомов:
56
ψмол=С1ϕАО1 +С2ϕАО2 |
(162) |
3.6Молекулярный ион водорода в ММО.
Вкачестве примера рассмотрим простейшую возможную частицу —молекулярный ион водорода. Для определения основного энергетического состояния этой частицы можно построить предполагаемую волновую функцию как линейную комбинацию 1s орбиталей атомов водорода. Предполагают, что ядра находятся бесконечно далеко одно от другого, что эквивалентно системе
HH
(a)(Ь)
Пусть электрон находится у атома а, и основное состояние молекулярной орбитали будет выражено атомной орбиталью атома а. Теперь примем, что основным состоянием молекулярной орбитали будет атомная орбиталь атома b , что указывает на связь электрона только с атомом b. При взаимодействие атомов возникает молекулярная орбиталь, которую можно представить в виде сумму двух атомарных орбиталей атома а и атома b. Такое приближение метод построения молекулярных орбиталей называют линейной комбинации атомарных орбиталей (ЛКАО). Поэтому можно считать, что одноэлектронная молекулярная орбиталь для электрона равна
Ψ1 = С1ψa+ С2ψb |
(163) |
В этом частном случае молекула имеет только один электрон и общая волновая функция Ψa+Ψb. Для молекулы водорода пространственная волновая функция будет
Ψмо = Ψ1 Ψ2= {С1Ψа(1)+ С2Ψb (1)}{С3Ψa(2)+ С4Ψb(2)} |
(164) |
где Ψa(1)— волновая функция электрона 1 атома а; Ψa(2)— волновая функция электрона 2 атома а и т. д.
Вследствие симметрии молекулы водорода все коэффициенты С по абсолютной величине одинаковы.
Так как молекулярная орбиталь одного электрона в молекулярном ионе водорода выражена посредством линейной комбинации двух независимых членов, детерминант векового уравнения будет равен, как уже было показано выше, будет иметь следующий вид
Haa − ESaa |
Hab − ESab = 0 |
(165) |
Hba − ESba |
Hbb − ESbb |
|
Он может быть еще упрощен, если иметь в виду симметрию молекулы. Так как атомы водорода, а, следовательно, и основные атомные орбитали одинаковы, то
Наа = Нbb |
(166а) |
Наb = Нba |
(166б) |
и |
|
Sab=Sba=S |
(166в) |
57
Если пользоваться нормированными волновыми функциями, то Saa=Sbb =1. Следовательно, детерминант векового уравнения еще упростится
Haa − E |
Hab − ES |
= 0 |
(167) |
Hba − ES |
Hbb − E |
||
что ведет к выражению* |
|
|
|
(Haa-E)2-(Hba-SE)2=0 |
(168), |
||
Если это выражение преобразовать и решить квадратное уравнение относительно Е, то получаются два корня:
E |
= |
Haa + Hba |
(169а) |
||
|
|
||||
c |
|
|
1+ S |
|
|
|
|
|
|
||
и |
|
|
|
|
|
E |
= |
Haa − Hba |
|
(169б) |
|
|
|||||
ac |
|
|
1− S |
|
|
|
|
|
|
||
где Ес и Eас — энергии симметричного и антисимметричного состояний соответственно. Исходное энергетическое состояние 1s в обоих атомах водорода вырождено, но при соединении атомов в молекулу оно расщепляется на два новых энергетических состояния: одно с более низкой, а другое с более высокой энергией, чем исходное атомное состояние 1s. По терминологии теории молекулярных орбиталей, орбиталь, которой соответствует меньшая энергия, называется связывающей, орбиталь с большей энергией называется разрыхляющей†. На обеих орбиталях может поместиться по два электрона, но в первую очередь будет заполняться связывающая орбиталь, так как ей соответствует меньшая энергия. Поэтому в молекулярном ионе водорода электрон находится на связывающей орбитали. В более сложных системах заполнение разрыхляющих орбиталей очень важно для оп-
ределения характера связи.
На обеих орбиталях может поместиться по два электрона, но в первую очередь будет меньшая энергия. Поэтому в молекулярном ионе водорода электрон находится на связывающей орбитали. В более сложных системах заполнение разрыхляющих орбиталей очень важно для определения характера связи.
Наряду с энергетическими состояниями интересно распределение электрона в молекулярном ионе водорода, как в симметричном, так и в антисимметричном состоянии. Из уравнения (5-20) видно, что волновая функция для молекулярного иона водорода имеет вид
ΨМО = С1ψa+ С2ψb |
(170) |
Так как получается два энергетических состояния, то можно сделать вывод, что долж- |
|
ны быть и две волновые функции. В принятых теперь новых обозначениях это будет |
|
(Наа -Е)С1 + (Нbа – ЕSbа) С2 = 0 |
(171) |
––––––––– |
|
* Часто это уравнение дают с другими обозначениями: Haa=Еa, Hbb=Eb Hab=β |
|
† Обычно разрыхляющие орбитали отмечают индексом*.
58

Для получения решения, соответствующего симметричному состоянию, надо в этом уравнении вместо Е поставить Ес, а для антисимметричного состояния заменить Е на Eас. После замены и решения уравнения получится соответственно:
С1=С2, С1=-С2
что приведет к двум волновым функциям молекулярных орбиталей; |
|
Ψс=Сс(ψа + ψb) |
(172а) |
Ψac=Сac(ψа - ψb) |
(172б) |
где С — нормирующий множитель.
Чтобы получить окончательные волновые функции, необходимо нормировать функции Ψс и Ψac. Это можно показать на симметричной функции, используя условия нормирования:
∫ Ψс Ψс dτ=1 |
(173а) |
Или |
|
∫Сс2 (ψа + ψb)* (ψа + ψb) dτ=1 |
(173б) |
После раскрытия скобок получим |
|
Сс2 (∫ψа2 +2 ψbψа + ψb2) dτ=1 |
(173в) |
Комплексно-сопряженная форма здесь может быть отброшена, так как и ψа и ψb дей- |
|
ствительныевеличины. Еслиψа и ψb нормированные волновые функции, то |
|
∫ψа2 dτ= ∫ψb2 dτ=1 |
(174) |
а по определению ∫ψа ψb dτ=Sab Отсюда уравнение (175) принимает вид:
Сс2 (1+2 Sab +1)=1
или
Сc = |
|
|
1 |
|
|
|
|
||||
|
|
+ 2Sab |
|
|
|
||||||
|
|
|
2 |
|
|
|
|||||
Аналогично |
|
|
|
|
|
|
|
|
|
||
Сac = |
|
1 |
|
|
|
||||||
|
−2Sab |
|
|
|
|||||||
|
|
|
2 |
|
|
|
|||||
И получить нормированные функции |
|
|
|
|
|
|
|
|
|
||
Ψc = |
|
|
1 |
|
|
(ψa |
+ψb ) |
||||
|
|
|
|
|
|
|
|||||
2 |
+2Sab |
|
|
|
|||||||
и |
|
|
|
|
|
|
|
|
|
||
Ψac = |
|
1 |
|
|
(ψa |
|
−ψb ) |
||||
|
|
|
|
|
|
|
|||||
2 |
−2Sab |
|
|
|
|||||||
(175)
(176а)
(176б)
(177а)
(177б)
59

По волновым функциям можно определить распределение электронного заряда в молекуле, а из выражений для энергетических состояний вычислить энергию молекулярных уровней. Рассмотрим сначала распределение заряда, можно видеть, что если Sab достаточно мало, то
Ψс2 = ½( ψа2 + ψb2 + 2 ψbψа) |
(178а) |
и |
|
Ψс2 = ½( ψа2 + ψb2 - 2 ψbψа) |
(178б) |
Отсюда видно, что симметричная функция ведет к увеличению плотности электронного заряда в области перекрывания между двумя атомами по сравнению с тем, что имеет место у индивидуальных атомов, описываемых функциями ψа2 и ψb2. С другой стороны, антисимметричная функция ведет к уменьшению плотности заряда. Это изображено графически на рис. 22.
а
б
Рис. 22. Электронная плотность вдоль ядерной оси для симметричного (а) и антисимметричного (6) состояния молекулярного иона водорода.
Пунктирные линии изображают плотность заряда у индивидуальных атомов, удаленных один от другого на бесконечно большое расстояние, а сплошная линия изображает распределение электронного зарядa в молекулярном ионе водорода вдоль линии, соединяющей ядра (ядерной оси). Очевидно, что связывающая орбиталь благоприятствует такому распределению заряда, при котором он концентрируется между ядрами, в то время как раз-
60
