
Неорганическая химия / Астахов М.В. Теория химической связи
.pdf
имеет h корней. Решение дает h орбиталей (ψ1 ψ2….. ψh) с энергиями E1, E2,… Eh. Рассмотрим простой случай, когда в образовании связи участвуют одинаковые атомы С, и орбитали — рz-орбитали атомов углерода. В методе МОХ вводятся предположения, упрощающие решение.
1. Все диагональные матричные элементы определителя Нhh =∫ψhĤψhdτ называемые кулоновскими интегралами, равны между
H11=H22=H33= …….=Hhh=α |
(3) |
Постулируется, что интеграл α равен энергии электрона на атомной орбитали свободного атома.
2. Недиагональные элементы Hij = ∫ψiĤψjdτ, называемые резонансными интегралами, принимаются равными нулю, если ψi и ψj — атомные орбитали несоседних атомов. Это означает пренебрежение перекрыванием атомных орбиталей несоседних атомов, которое вообще невелико из-за большого расстояния между ними:
Hij(несосед)=0 |
(4) |
3. Постулируется взаимное равенство и постоянство всех резонансных интегралов для пар соседних атомов:
Hij(сосед)=β |
(5) |
4. Постулируется равенство нулю всех интегралов перекрывания: |
|
Sij = 0 |
(6) |
Для соседних атомов из-за их близости это слишком грубое приближение. |
|
5.Интегралы Shh = 1 для нормированных АО.
6.В основном состоянии 2π электронов молекулы занимают n наиболее низких молекулярных орбиталей. Полная электронная энергия молекулы принимается равной сумме орбитальных энергий всех электронов:
i=n |
|
Емол = 2∑Еi |
(7) |
i=1
В зависимости от конкретного вида атомов значения Hhh и Hih даны в табл. I.
Таблица I. Значения Нhh и резонансных интегралов Нij для различных атомов и пар ближайших атомов
h i |
C |
N |
P |
O |
S |
Hhh |
C |
β |
β |
β |
β√2 |
β√2 |
α |
N |
β |
β |
β |
β |
β |
α+ β |
P |
β |
β |
β |
β |
β |
α+ β |
O |
β√2 |
β |
β |
- |
- |
α+ 2β |
S |
β√2 |
β |
β |
- |
- |
α+ 2β |
Величина α и β отрицательны.
101
После подстановки значений Sih и Нih в определитель (2) раскрывают этот определитель и решают полученное алгебраическое уравнение. В результате находят дозволенные значения энергии как функции α и β .
Следующий этап выполнения задачи - поиск коэффициентов Сi для каждой молекулярной волновой функции. В случае системы однородных уравнений коэффициенты Сi пропорциональны алгебраическим дополнениям к элементу определителя, стоящему в первой строке и i-ок столбце. Коэффициенты пропорциональности находят из условия нормировки данной волновой функции.
Таким образом, задача сводится к нахождению собственных чисел и собственных векторов матрицы резонансных интегралов характеризующих энергию обменного взаимодействия.
В методе МОХ при объяснении свойств молекулы и химической активности отдельных ее участков используют понятия электронной плотности q, заряда на атомах ζ, порядка связи P и индекса свободной валентности F.
2.1. Электронная плотность у атома.
Молекулярная орбиталь в методе МОХ описывается выражением
Ψ=c1ψ1+c2ψ2+c3ψ3+…..+chψh =Σcrψr
Электронная плотность на атоме r равна
qr=Σnjcjr2
где r — номер атома; i — номер МО; n - заселенность орбитали (n = 1 или 2). Сумма электронной плотности по всем атомам равна общему числу электронов. Часто рассматривают только π-электронную плотность (qπr). Понятие электронной плотности на атоме имеет условный характер. Так, q1 = q2 = 1 не означает, что плотность равна единице в области ядер 1 и 2, а между ними она отсутствует. Электронная плотность имеется и в межъядерном пространстве и достигает максимума вблизи ядер. Равенство q1 = q2 = 1 указывает только на то, что плотность симметрично распределена на связи между двумя ядрами, как в молекуле Н2.
Заряды на атомах. Если атом участвует в образовании связи одним электроном, атому можно приписать определенный заряд ζ:
ζ=1-qr |
(8) |
Порядок связи.
Порядком связи между атомами r и s называют величину Prs, определяемую как сумму произведения коэффициентов Сjr и Cjs молекулярной орбитали на число электронов, находящихся на орбитали (сумму берут по всем занятым орбиталям):
j =m |
|
Prs = ∑n j c jr c js |
(9) |
j =1
Порядок σ-связи С — С во всех углеродных соединениях считают равным единице, поэтому основное внимание уделяют порядку π-связей.
Физический смысл порядка связи понятен из следующего: чем больше произведение CjrCjs, входящее в (9), тем более полно перекрываются атомные орбитали ψ2 и ψ3 и тем прочнее связь. Чем прочнее ковалентная связь, тем она короче.
102
Зависимость длины связи С—С от порядка связи часто используют для расчета ее длины, если известен порядок, и наоборот. Порядок связи есть характеристика ее длины, прочности и реакционной способности.
Индекс свободной валентности.
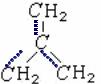
При объяснении реакционной способности соединений с π-связью используют индекс свободной валентности. Можно показать, что максимальное число π-связей (вернее сумма порядков связей), в которых может участвовать атом углерода Nmах = 1,732. Такая возможность реализуется в радикале триметиленметана, у которого центральный атом углерода связан с каждой группой СН2 помимо σ – связи, еще и π-связью.
Рис.2 Строение радикала триметиленметана
Если у атома углерода сумма порядков связей Nr<Nmax, то у него имеется свободная валентность, индекс которой
Fr=Nmax-Nr=1,732-Σ Prs(π) |
(10) |
Для атома углерода в этилене, где Fr = 1, имеем Fr=1,732 - 1 = 0,732. Индекс свободной валентности 0,732 указывает на высокую способность молекулы этилена к присоединению атомов по месту двойной связи. Чем выше Fr тем более высока активность в реакциях присоединения нейтральных атомов. Индексы Fr > 1 обычно характерны для свободных радикалов.
Молекулярные диаграммы.
Рассчитанные в приближении метода МОХ электронные плотности, заряды на атомах, порядки связей и индексы свободной валентности принято наносить на соответствующие места при изображении, а структурной формулы молекулы, вместе с которой они составляют так называемую молекулярную диаграмму. Примером может служить молекулярная диаграмма, на которой стрелкой указан индекс свободной валентности атома углерода (из соображений симметрии нет надобности указывать его на обоих атомах С) и порядок связи С— С. Так как атомы С этилена электронейтральны, то на диаграмме ни заряды, ни электронная плотность не указаны.
103
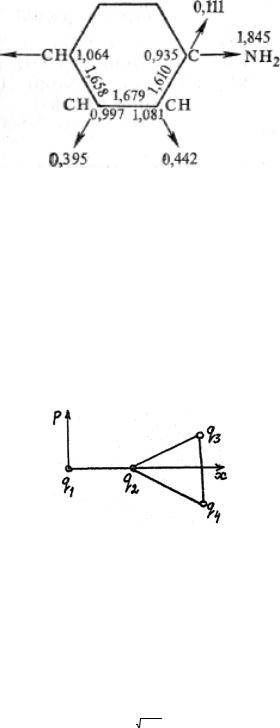
Рис.3 Молекулярные диаграммы анилина .
Рассчитанные здесь величины q, ζ, P и F — условные характеристики, так как метод МОХ — приближенный, и коэффициент сi волновой функции зависит от принятого приближения. При сравнительном анализе отдельных связей внутри молекулы и молекул в одном ряду эти понятия могут быть полезны, но считать их однозначными характеристиками реакционной способности нельзя.
Дипольный момент молекулы находят по формуле;
Дипольный момент молекулы может быть рассчитан на основании следующих, известных из физики принципов. Для произвольной четырехатомной молекулы
Рис.4 Диаграмма распределения заряда на атомах в произвольной молекуле
r |
h |
(11а) |
px = |
∑qi xi |
|
|
i |
|
r |
h |
(11б) |
py = |
∑qi yi |
|
|
i |
|
| Pr |= |
px2 + py2 |
(11в) |
Все межатомные расстояния для атомов углерода принимаются равными 1,5Å. Обычно дипольный момент молекулы выражают в единицах Дебая (1деб = 10-18 ед.
СГСЭ ×см).
Длина волны максимума поглощения определяется по формуле:
λ = |
сh |
(12) |
|
E |
|||
|
|
где Е есть расстояние между верхним занятым и ближайшим незанятым уровням энергии коллективизированных электронов, h - постоянная Планка, c - скорость света.
3. Пример расчета по методу ЛКАО МОХ для молекулы бутадиена.
104

Энергию π-электронов молекулы бутадиена можно рассчитать, полагая, что остов σ- связей дает возможность перекрыванию параллельных 2рz-орбит электронов.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
в |
|||
Рис. 5 Структурная формула молекулы бутадиена.
а-с локализованными π-связями, в- с делокализованными π-связями.
Волновая функции для π-электронов молекулы бутадиена будет иметь следующий вид:
ψ I |
= c ϕ |
1 |
+ c ϕ |
2 |
+ c ϕ |
3 |
+ c ϕ |
4 |
(13) |
MO |
1 |
2 |
3 |
4 |
|
где φ1, φ2, φ3 и φ4 –волновые функции 2рz- электронов, локализованных на соответствующих атомах углерода. Для нахождения возможных значений энергии π-электронов молекулы бутадиена и коэффициентов, входящих в ΨМО, необходимо составить вековой определитель и решить его. В случае делокализованной связи (Рис. а), он будет иметь следующий вид:
H11 − E |
H12 |
H13 |
H14 |
|
|
|
|
||||
H21 |
H22 − E |
H23 |
H24 |
= 0 |
(14) |
H31 |
H32 |
H33 − E |
H34 |
|
|
H41 |
H42 |
H43 |
H44 − E |
|
|
Отсутствие в нем Sih связано с тем обстоятельством, что Sih равно нулю в случае i≠h и равно 1, если i=h. Значение кулоновских Hhh (α) и резонансных интегралов Hih (β) выбирают из таблицы
|
α − Е |
β |
0 |
0 |
|
|
|
|
|
|
|||||
|
β |
α − Е |
β |
0 |
= 0 |
(15) |
|
|
0 |
β |
α − Е |
β |
|||
|
0 |
0 |
β |
α − Е |
|
|
|
Чтобы упростить выражение, разделим почленно его на β, получим следующую мат-
рицу:
x |
1 |
0 |
0 |
|
|
|
1 |
x |
1 |
0 |
= 0 |
(14) |
|
0 |
1 |
x |
1 |
|||
|
||||||
0 |
0 |
1 |
x |
|
|
|
|
|
|
|
|
|
где x = α β− E
105

Решить такое и более сложное векового уравнения можно с помощью различных методов. Наиболее просто это сделать на компьютере, используя программу «Mathcad» или любую другую.
Численные значения х будут следующими:
х1=-1,618, х2=-0,618, х3=0,618 и х4=1,618.
Наименьшей будет обладать уровень с Е1 =α+1,62β, для которого х1 равен 1,618, поскольку значения α и β всегда меньше нуля. На каждом уровне энергии могут находиться в соответствие с принципом Паули два электрона.
Е
Е4 = α-1,62β Е3 =α-0,62β Е2 =α+0,62β Е1 =α+1,62β
(15)
Последнее уравнение следует из условий нормировки молекулярных волновых функций электронов (ΨМО). Решить такую систему можно также с помощью компьютерных программ, в частности «Mathcad». Подставляя в эту систему найденные ранее значения х для каждого уровня энергии, найдем ΨМО соответствующие каждому энергетическому уровню.
Так для х1=-1,618, значения коэффициентов будут иметь следующие значения
С1=0,372, С2=0,602, С1=0,602, С1=0,372,
а сама волновая функция запишется следующим образом
1. Ψ I |
= 0,372 ϕ + 0,602 ϕ |
2 |
+ 0,602 ϕ |
3 |
+ 0,372 ϕ |
4 |
MO |
1 |
|
|
для х2=-0,618,
2.ΨMOII = 0,6ϕ1 + 0,37ϕ2 −0,37ϕ3 −0,6ϕ4 для х3=0,618
3.ΨMOIII = 0,6ϕ1 −0,37ϕ2 −0,37ϕ3 + 0,6ϕ4
106
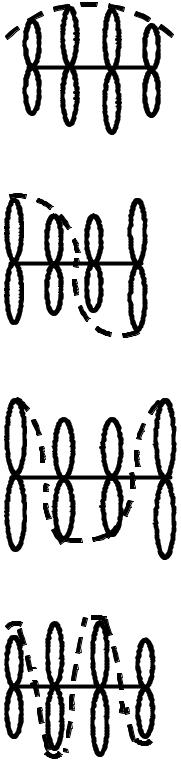
и для х4=1,618.
4. ΨMOIV = 0,37ϕ1 −0,6ϕ2 + 0,6ϕ3 −0,37ϕ4
Схематически молекулярные волновые функции ΨМО для молекулы бутадиена можно изобразить следующим образом:
связывающая орбиталь
Ψ I |
= 0,372 ϕ + 0,602 ϕ |
2 |
+ 0,602 ϕ |
3 |
+ 0,372 ϕ |
4 |
MO |
1 |
|
|
частично связывающая
ΨMOII = 0,602 ϕ1 + 0,372 ϕ 2 − 0,372 ϕ3 − 0,602 ϕ 4
частично разрыхляющая
ΨMOIII = 0,602 ϕ1 − 0,372 ϕ2 − 0,372 ϕ3 + 0,602 ϕ4
разрыхляющая:
ΨMOIV = 0,372 ϕ1 − 0,602 ϕ 2 + 0,602 ϕ3 − 0,372 ϕ 4
107

Поскольку вероятность нахождения электрона пропорционально |ΨМО|2 то вероятность прибывания электронов у каждого из ядер в первом случае везде не равна нулю. Во всех остальных – она может быть нулевой т.к. коэффициенты в этих функциях имеют разные знаки. Точки, где происходит изменение знака на противоположной называют узловыми, в них вероятность нахождение электрона равна нулю.
Рассчитанная величина энергии электронов на орбитали возравстает с увеличением числа узлов. Самая высокая по уровню энергия орбиталь является разрыхляющей орбитой для каждой пары ядер. Самая низкая орбиталь не имеет ни одного узла и является «полностью» связывающей.
Порядок связи.
Порядок σ-связи С — С во всех углеродных соединениях считают равным единице. Поэтому основное внимание уделяют порядку π-связей.
Порядок связи между 1 и 2, 3 и 4 атомами углерода в молекуле бутадиена в соответствие с уравнение 9 будет равен
Р12=Р34
Ρ12 = 2 0,372 0,602 + 2 0,602 0.372 = 0,894
между 2 и 3 атомами углерода
Ρ23 = 2 0,602 0,602 +2 0,372 (−0.372) = 0,447
На молекулярной диаграмме порядок связи записывается следующим образом:
0,894 0,447 0,894
С ——— С ——— С ——— С
Как следует из полученных результатов расчета, связь между 2 и 3 атомами углерода менее прочная, чем между 1и 2, 3 и 4.
Индекс свободной валентности.
В соответствие с уравнением (10) индекс свободной валентности вычисляется для каждого атома углерода.
Для первого и четвертого атомов углерода в молекуле бутадиена индекс свободной валентности будет равен
F1 =1,732 −0,894 = 0,838 = F4
Для 2 и 3:
F2 =1,73 −0,894 −0,447 = 0,390 = F3
На молекулярной диаграмме эти значения обозначаются следующим образом:
108

0,84 |
0,39 |
0,39 |
0,84 |
С ——— С ——— С ——— С
qr = ∑Nici2 = 2 0,3722 −2 0,6022 =1
i
Электронная плотность у атома.
Сумма электронной плотности по всем атомам равна общему числу электронов. Расчеты, проведенные по уравнению (11) для бутадиена, дают следующие значения заряда на каждом атоме углерода:
q1 = q4=(nC12)φ1+(nC12)φ2=2(0,372)2+2(0,602)2=1,000
и
q2 = q3=(nC12)φ2+(nC12)φ3=2(0,602)2+2(0,372)2=1,000
Таким образом, избыточный заряд на этих атомах будет равен нулю. На молекулярной диаграмме избыточный заряд записывается следующим образом:
С ——— С ——— С ——— С
ζ1=0 |
ζ2=0 |
ζ3=0 |
ζ4=0 |
Полная молекулярные диаграммы молекулы бутадиена.
Полная запись молекулярной диаграммы будет иметь следующий вид:
|
0,84 |
0,39 |
0,39 |
0,84 |
|
0,89 |
0,45 |
0,89 |
|
С ——— С ——— С ——— С |
|
|||
ζ1=0 |
ζ2=0 |
ζ3=0 |
ζ4=0 |
|
Дипольный момент молекулы
Спектр поглощения.
Длина волны максимума поглощения определяется по формуле (12). Для молекулы бутадиена расстояние между верхним занятым и ближайшим незанятым уровнями энергии коллективизированных электронов равно
Е=Е3-Е2=-1,236β
Величина резонансного интеграла β для связи С - С составляет 18 ккад/моль связей. Длину волны линии поглощения (λ ) при переходе одного электрона со второй на третью орбиту можно рассчитать, исходя из следующего уравнения
Е=hν= hc/λ
λ = hcE
109
Поскольку оптический интервал длин волн заключен в пределах от 0,4 (фиолетовые) до 0,8 (красные) мкм, то поглощение при оптических переходах π-электронов бутадиена начинается в инфракрасной области.
4.Содержание задания
Расчет выполняется для молекулы, содержащей 4 или 6 электронов, коллективизированных между, соответственно, четырьмя или шестью атомами в молекуле. Обычно это так называемые π-электроны. В процессе выполнения задания необходимо составить вековое уравнение (алгебраическое уравнение 4-ой или 6-ой степени), найти его корни и затем вычислить коэффициенты молекулярных волновых функций. С помощью полученных волновых функции вычисляют далее характеристики прочности связей, индексы свободной валентности, локализацию зарядов на атомах, дипольный момент молекулы, длину волны поглощения, обусловленного переходами коллективизированных электронов. Построить молекулярную диаграмму для данной молекулы.
5.Порядок выполнения домашнего задания
I.Вариант задания следует выбрать из таблицы вариантов в соответствии с номером студента в списке группы (первые тридцать вариантов предназначены для группы I, остальные - для группы 2).
2. Для заданной молекулы составляется определитель векового уравнения (2). Значения резонансных интегралов Hhh. и Нij выбирают из табл. I.
3. Определитель почленно делится на β. Вводится переменная x, связанная с Е, α и β (см. пример расчета для молекулы бутадиена).
4. Для получения собственных чисел и собственных векторов матрицы резонансных интегралов следует решить соответствующие уравнения, как показано на примере молекулы бутадиена.
5. На основании полученных результатов записываются волновые функции для всех орбиталей Ψ-электронов молекулы. Дается характеристика полученных орбиталей и их схематическое изображение.
6. По формулам (5) - (9) рассчитываются порядки связей, индексы свободной валентности, локализация зарядов на атомах, дипольный момент и длина волны максимума поглощения (см. пример расчета для молекулы бутадиена).
Отчет по домашнему заданию должен содержать:
а) схематическое изображение молекулы, для которой выполняется расчет; б) анализ характера связей между атомами в молекуле и формы молекулы (в том числе
валентных углов); в) определитель векового уравнения, записанный сначала в общем виде, затем опреде-
литель для заданной молекулы, полученный с учетом "конкретных значений Hhh и Hih , и этот же определитель, записанный через переменную х , связанную с величинами Е, α и β ;
г) подробные и обоснованные расчеты порядков связей, индексов свободных валентностей, локализации зарядов на атомах, дипольного момента и длины волны поглощения, обусловленного переходами коллективизированных электронов;
д) Анализ достоверности получаемых результатов, учитывая приближенность метода ЛКАО МОХ.
110
