
Неорганическая химия / Астахов М.В. Теория химической связи
.pdf
Тест 6
Какое из приведенных ниже выражений является оператором Гамильтона для иона молекулы водорода?
1. |
Нˆ = − |
h2 |
|
2 − e2 |
|
− e2 |
|
+ |
e2 |
|
|
|
|
|||||||||||||
2m |
rab |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
ra |
|
rb |
|
|
|
|
|
|||||||||||
2. |
Нˆ = − |
h2 |
|
|
а2 |
− |
h2 |
|
b2 − |
e2 |
|
− |
e2 |
+ |
e2 |
|||||||||||
2m |
2m |
r |
|
r |
r |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
b |
|
ab |
||
3. |
Нˆ = − |
h2 |
|
|
а2 |
− |
h2 |
|
b2 − |
e2 |
|
− |
e2 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
2m |
|
|
|
|
2m |
|
|
|
r |
|
|
|
r |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
b |
|
|
|||
4. |
Нˆ = − |
h2 |
|
|
а2 |
− e2 − e2 |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
2m |
|
|
|
|
r |
|
r |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
b |
|
|
|
|
|
|
|
|
|
|
||
5. |
Нˆ = −e2 |
− e2 |
+ |
e2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
rab |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
ra |
|
|
|
rb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2. Какое уравнение описывает энергию основного состояния иона молекулы водорода?
1.E = Haa − Hba
1+ S
2.E =1H+aaS
3.E = H aa + Hba
1+ S
4.E = Haa −+ Hba
1S
5.E = Haa −− Hba
1S
3. Какая из приведенных ниже волновых функций описывает молекулярную орбиталь в ионе молекулы водорода в основном состоянии?
1. |
Ψ = |
|
1 |
(ψa +ψb ) |
|
− 2Sab |
|||
|
2 |
|
||
2. |
Ψ = |
|
1 |
(ψa −ψb ) |
|
+2Sab |
|||
|
2 |
|
||
3. Ψ = |
1 |
(ψa +ψb ) |
|
2Sab |
|||
|
|
131
4. |
Ψ = |
|
|
1 |
(ψ a |
+ψ b ) |
||
2 |
+ 2Sab |
|||||||
|
|
|
|
|||||
5. |
Ψ = |
|
1 |
|
(ψa +ψb ) |
|
||
2 |
|
|||||||
|
|
|
|
|
||||
4. Какая из приведенных ниже волновых функций описывает молекулярную орбиталь иона молекулы водорода в возбужденном состоянии?
1. |
Ψ = |
|
1 |
(ψa +ψb ) |
|
−2Sab |
|||
|
2 |
|
||
2. |
Ψ = |
|
1 |
(ψa −ψb ) |
|
−2Sab |
|||
|
2 |
|
||
3. |
Ψ = |
|
|
1 |
|
(ψa +ψb ) |
||
|
|
|
|
|
||||
|
|
|
|
|
2Sab |
|||
4. |
Ψ = |
|
|
|
1 |
|
|
(ψ a +ψb ) |
|
|
|
|
|
||||
|
2 |
+ 2Sab |
||||||
5. |
Ψ = |
|
1 |
|
(ψa +ψb ) |
|||
|
2 |
|
||||||
|
|
|
|
|
|
|
|
|
5. Какая молекулярная функция используется для нахождения энергии связи в молекуле иона водорода?
1.Ψ1 =ψa(1s)+ψb(2s)
2.Ψ1 = C1ψa(2s)+ C2ψb(1s)
3.Ψ1 =ψa(1s)+ψb(1s)
4.Ψ1 = C1ψa(1s)+ C2ψb(2s)
5.Ψ1 =C1ψa(1s)+ C2ψb(1s)
6.Какой вид будет иметь уравнение Шредингера для случая молекулы иона водорода?
1.{ h2 2m
2.{ h2 2m
3.{ h2 2m
4.{ h2 2m
2 − e2 ra
2 − e2 ra
2 − e2 ra
2 + e2
rab
|
e2 |
e2 |
|
|
|
|
|
− |
+ |
|
}(ψa +ψb ) = E(ψa +ψb ) |
|
|
||
|
|
|
|||||
|
rb |
rab |
|
|
|
|
|
|
e2 |
e2 |
|
|
|
|
|
− |
+ |
|
}(C ψ |
×C ψ |
) = E(C ψ |
×C ψ |
) |
|
|||||||
|
rb |
|
1 a |
2 b |
1 a |
2 b |
|
|
rab |
|
|
|
|
||
−e2 + e2 }(C1ψa ) = E(C1ψa )
rb rab
}(C1ψa +C2ψb ) = E(C1ψa +C2ψb )
132

5. |
{ |
h2 |
2 − e2 |
− e2 |
+ |
e2 |
}(Cψ |
+C ψ |
) = E(Cψ |
+C ψ |
) |
|
|
||||||||||
|
2m |
r |
r |
|
r |
1 a |
2 b |
1 a |
2 b |
|
|
|
|
|
a |
b |
|
ab |
|
|
|
|
|
7. Какое уравнение описывает энергию возбужденного состояния иона молекулы водорода?
|
E = |
H |
− H |
|||
1. |
|
aa |
|
ba |
||
|
1− S |
|||||
|
|
|
||||
2. |
E = |
|
Haa |
|
||
1+S |
||||||
|
|
|||||
H + H
3.E = 1+ S
4.E = Haa −+ Hba
1S
5.E = Haa +− Hba
1Saa ba
8. Какой из интегралов для случая иона молекулы водорода обозначают Наа?
1. |
∫Ψ1sa [− |
h2 |
2 |
− e2 |
+ e2 ]Ψ1sa dτ |
|||||
2m |
||||||||||
|
|
|
|
|
|
ra |
|
R |
||
2. |
∫Ψ1sa [− |
h2 |
2 |
− e2 |
− e2 ]Ψ1sa dτ |
|||||
2m |
||||||||||
|
|
|
|
|
|
ra |
|
rb |
||
3. |
∫Ψ1sa [E0 − e2 |
+ e2 |
]Ψ1sa dτ |
|||||||
|
|
|
|
|
|
rb |
R |
|
||
4. |
∫ |
1 |
Ψ1sa Ψ1sb dτ |
|
|
|
||||
r |
|
|
|
|||||||
|
|
b |
|
|
|
|
||||
5. |
e2 ∫ |
1 |
Ψ1sa Ψ1sa dτ |
|
|
|||||
r |
|
|
||||||||
|
|
|
b |
|
|
|
|
|||
9. Какой из интегралов для случая иона молекулы водорода обозначают Наb?
1. |
∫Ψ1sa [E0 |
− e2 |
+ e2 |
]Ψ1sa dτ |
|
|
rb |
R |
|
133
2. |
∫Ψ1sa [E0 |
− e2 ]Ψ1sa dτ |
|||
|
|
|
|
rb |
|
|
|
|
e2 |
e2 |
|
3. |
∫Ψ1sa [ r + R ]Ψ1sa dτ |
||||
|
|
|
b |
|
|
4. |
∫Ψ1sa [E0 |
− e2 |
+ e2 ]dτ |
||
|
|
|
|
rb |
R |
5. |
∫ |
1 |
Ψ1sa Ψ1sb dτ |
|
|
r |
|
||||
|
|
b |
|
|
|
10. Какой интеграл в случае иона молекулы водорода называют Sab?
1. ∫Ψ1saΨ1sbdτ
2. |
e2 ∫ |
1 |
Ψ1sa Ψ1sa dτ |
|
|
|||
r |
|
|
||||||
|
|
b |
|
|
|
|
|
|
3. |
∫Ψ1sa |
[E0 − e2 |
+ e2 |
]Ψ1sa dτ |
||||
|
|
|
|
|
rb |
|
R |
|
4. |
∫Ψ1sa |
[EH |
− e2 |
+ e2 |
]Ψ1sa dτ |
|||
|
|
|
|
|
rb |
|
R |
|
5. |
∫Ψ1sa |
[EH |
− e2 e2 |
]dτ |
||||
|
|
|
|
|
rb |
R |
|
|
Тест 7
1. Какое из приведенных ниже уравнений применяется в методе валентных связей для расчета энергии связи молекулы водорода?
1.Ψвс = С1ϕ1sa (1)ϕ1sb (2) + С2ϕ1sa (2)ϕ1sb (1)
2.Ψвс =ϕ1sa (1)ϕ1sb (2)
3.Ψвс =ϕ1sa (2)ϕ1sb (1)
4.Ψвс = С1ϕ1sa (1)ϕ1sb (1) + С ϕ1sa (1)ϕ1sb (1)
5.Ψвс = С1ϕ1sa (2)ϕ1sb (2) +С ϕ1sa (2)ϕ1sb (2)
134

2. Какое из приведенных ниже уравнений является оператор Гамильтона для молекулы водорода
|
|
h2 |
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
e2 |
|
|
|
|
|
|
e2 |
|
|
|
|
|
|
|
|
e2 |
|
|
|
|
|
|
|
e2 |
|
|
|
|
|
|
e2 |
|
|
|
|||||||||||||||
1. H = − |
|
|
|
( |
1 |
+ |
2 |
) |
− |
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
− |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
2m |
|
|
|
|
|
|
|
|
rb |
|
|
|
|
ra |
|
|
|
|
rb |
|
|
|
|
r12 |
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ra |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
h2 |
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
e2 |
|
|
|
e2 |
|
|
|
|
|
|
e2 |
|
|
|
|
|
|
e2 |
|
|
|
e |
2 |
|
|
|
e2 |
|||||||||||||||||||||||||
2. H = − |
|
|
( |
1 |
|
+ |
2 |
) − |
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
+ |
|
|
|
||||||||||||||||||
2m |
|
|
|
|
|
rb |
|
ra |
|
|
|
rb |
r12 |
|
R |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ra |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
h2 |
|
|
2 |
|
|
|
e2 |
|
|
|
e2 |
|
|
|
|
|
e |
2 |
|
|
|
|
|
|
e2 |
|
|
|
|
|
e2 |
|
|
e |
2 |
|
|
|
|
|
|||||||||||||||||||||||||
3. H = − |
|
|
|
|
1 |
|
− |
|
|
|
|
|
− |
|
|
|
|
− |
|
|
|
|
|
|
|
− |
|
|
|
|
+ |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
2m |
|
|
ra |
|
|
rb |
|
|
ra |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
rb |
|
|
|
|
|
r12 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
h2 |
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
e2 |
|
|
|
|
|
|
|
|
e |
2 |
|
|
|
|
|
|
e2 |
|
|
|
|
|
e2 |
|
|
|
|
|
|
|
|
|
||||||||||||||
4. H = − |
|
|
|
|
|
( |
1 |
+ |
2 |
) |
− |
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
8π 2 m |
r |
|
|
|
|
r |
|
|
|
|
|
r |
|
|
|
|
R |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
h2 |
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
e2 |
|
|
|
|
|
|
|
|
e |
2 |
|
|
|
|
|
|
e2 |
|
|
|
|
|
e2 |
|
|
|
|
|
|
e2 |
|
|
|
|||||||||||||
5. H = − |
|
|
|
|
|
( |
1 |
+ |
2 |
) |
− |
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
− |
|
|
|
|
+ |
|
|
|
|
|
|
|||||||||||||||||||
|
8π 2 m |
|
r |
|
|
|
|
|
r |
|
|
|
|
|
r |
|
|
|
r |
|
|
|
R |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
|
|
|
|
a |
2 |
|
|
|
|
|
|
b |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
3. Какое из приведенных ниже уравнений соответствует наименьшему значению энергии молекулы водорода
1.Eс = H11++H12
1S12
2.Eс = H11++H 22 1 S12
3. |
Eс |
= |
|
H11 +H 12 |
|
|||
|
1− S12 |
|||||||
|
|
|
|
|
||||
4. |
Eс |
= |
H11 −H 12 |
|
||||
|
|
|||||||
|
|
|
|
|
1+ S12 |
|||
5. |
Eс |
= |
H 21 +H 12 |
|
||||
|
||||||||
|
|
|
|
1+ S12 |
||||
4. Совпадают ли расчетное и экспериментальное значение энергии связи для молекулы |
||||||||
водорода при |
|
использовании волновой функции Ψвс =ϕ1sa (1)ϕ1sb (2) +ϕ1sa (2)ϕ1sb (1) |
||||||
для расчета? |
|
|
|
|
|
|||
1.Да |
|
|
|
|
|
|
|
|
2.Расчетное значение больше, чем экспериментальное.
3. Экспериментальное значение больше, чем расчетное
4.Оба значения очень близки.
5.Расчет энергии связи с помощью этой функции не возможен
135
5.Какое из приведенных ниже уравнений описывает энергию электронов в молекуле водорода, находящихся в возбужденном состоянии?
1. |
Eас = |
H11 −H12 |
|
1+ S12 |
|
||
|
|
|
|
2. |
Eас = |
H11 +H12 |
|
1+ S12 |
|
||
|
|
|
|
3. |
Eас = |
H11 +H12 |
|
1− S12 |
|
||
|
|
|
|
4. |
Eас = |
H11 −H 12 |
|
1− S12 |
|
||
|
|
|
|
5. |
Eас = |
H11 −H12 |
|
S12 |
|
||
|
|
|
6.Какое из приведенных ниже уравнений учитывает возможность вклада ионной связи
вмолекуле водорода?
1.Ψвс = С1ϕ1sa (1)ϕ1sb (2) +С2ϕ1sa (2)ϕ1sb (1) +С3ϕ1sa (1)ϕ1sb (1)
2.Ψвс = С1ϕ1sa (1)ϕ1sb (2) +С2ϕ1sa (2)ϕ1sb (1) +С3ϕ1sa (2)ϕ1sb (2)
3.Ψвс = С1ϕ1sa (1)ϕ1sb (2) + С2ϕ1sa (2)ϕ1sb (1)
4.Ψвс = С1ϕ1sa (1)ϕ1sb (2) +С2ϕ1sa (2)ϕ1sb (1) +С3ϕ1sa (1)ϕ1sb (1)
5.
Ψвс =С1ϕ1sa (1)ϕ1sb (2) +С2ϕ1sa (2)ϕ1sb (1) +С3ϕ1sa (1)ϕ1sа (2) +С3ϕ1sb (1)ϕ1sB (2)
7. Из каких атомарных орбиталей строится молекулярная волновая функция для молекулы водорода?
1.1sa и 1sb
2.1sa и 2sb
3.2sa и 1sb
4.2sa и 2sb
5.1pa и 1sb
Тест 8
1.Что такое σ-связь?
1)связь s-электрона с ядром;
2)связь, при которой перекрытие атомных волновых функций осуществляется вдоль линии, соединяющей ядра атомов;
3)чисто ионная связь;
4)неполярная связь;
136

5) связь, обусловленная боковым перекрытием атомных волновых функций.
2. Что такое π-связь?
1)связь s-злектрона с ядром;
2)связь, при которой перекрытие атомных волновых функций осуществляется вдоль их осей симметрии;
3)чисто ионная связь;
4)неполярная связь;
5)связь, обусловленная боковым перекрытием р-атомных волновых функций.
3.Какой вид гибридной орбитали представлен на рисунке?
sр-гибридная орбиталь sр2-гибридная орбиталь sр3-гибридная орбиталь dsр2-гибридная орбиталь dsр3-гибридная орбиталь
4.Какой вид гибридной орбитали представлен на рисунке?
1.sр-гибридная орбиталь
2.sр2-гибридная орбиталь
3.sр3-гибридная орбиталь 4.dsр2-гибридная орбиталь 5.dsр3-гибридная орбиталь
5.Чем можно объяснить четырехвалентность углерода ?
1. Один из 2s-электронов переходит на пустую 2рz- 2.Возникновением гибридных атомарных орбиталей. 3.Изменением числа валентных электронов.
4.Один из 1s-электронов переходит на пустую 2рz
5.Один из 2р-электронов переходит на пустую 2рz
137
Уравнения Ψ1=a1ψs+b1ψpx и Ψ2=a2ψs+b2ψpx позволяют описать гибридизацию sр
sр2 sр3 dsр2 dsр3
6.Какой значение будет иметь угол между связями О−Н в молекуле воды
1.1800
2.900
3.00
4.Меньше 900
5. 104°
7.Как изменяется угол между водорода атомами в молекулах Н2О Н2S, Н2Sе и Н2Те.
1.Остается постоянным.
2.Увеличивается
3.Уменьшается.
4.Меняется немонотонно.
5.Может принимать любые значения
8.Какие электроны атома принимают участие в образовании sр3–гибридной орбитали в молекуле метана?
1.sр
2.sр2
3.sр3 4.dsр2 5.dsр3
9.Какую гибридную связь могут образовать электроны в атоме углерода в молекле
СН4?
1.1800
2.900
3.00
4.Меньше 900
5. 120°
10. Какой вид гибридизации представлен на рисунке?
138
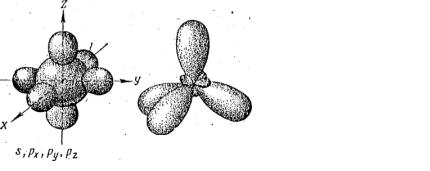
1sр
2sр2
3sр3
4dsр2
5dsр3
ТЕСТ 9
С помощью какой волновой функции описывается состояние электрона в методе МО?
1.Состояние каждого электрона описывается его атомарной волновой функцией
2.Состояние каждого электрона описывается с помощью совокупности атомарных функций атомов, входящего в состав молекулы.
3.Состояние каждого электрона в молекуле описывается одноэлектронной волновой
функцией его координат ϕК характеризуемой определенным набором квантовых чисел
4.Состояние всех электронов в молекуле описывается с помощью нескольких атомарных орбиталей
5.Состояние каждого электрона описывается с помощью атомарной функции, с учетом атомарных функций других атомов, входящих в состав молекулы
2.Чем определяется энергия электронов на молекулярной орбитале?
1.Суммой его кинетической и потенциальной, которая складывается из энергии
притяжения его ко всем ядрам εпр, отталкивания от всех остальных электронов εот и ядер атомов
2.Суммой его кинетической и потенциальной, которая складывается из энергии притяжения его ко всем ядрам εпр
3.Суммой его кинетической и потенциальной, которая складывается из энергии оттал-
кивания его от всех остальных электронов εот
4.Суммой его кинетической и потенциальной, которая складывается из энергии притяжения его ко всем ядрам εпр и отталкивания от всех остальных электронов εот
5.кинетической энергией электрона и энергии притяжения его ко всем ядрам εпр
3. Сколько молекулярных орбиталей (МО) потребуется для описания электронной конфигурации основного состояния молекулы с 2n или 2n-1?
1. n
139
2.2n
3.2n-1
4.2n+1
5.n-1
4.Какие принципы определяют электронную конфигурацию молекулы?
1.Принцип наименьшей энергии
2.Принцип Паули
3.Принцип наибольшего пересечения атомарных орбиталей электронов
4.Принцип подбора наилучших атомарных волновых функций
5.Принципа наименьшей энергии и принципа Паули
5.Каким образом задается координатная волновая функция основного состояния молекулы в нулевом приближении
1.в виде произведения атомарных волновых функций, атомов входящих в состав мо-
лекулы
2.в виде произведения одноэлектронных волновых функций, занятых молекулярных орбиталей
3.в виде суммы одноэлектронных волновых функций, занятых молекулярных орбита-
лей
4.в виде произведения одноэлектронных волновых функций, занятых молекулярных орбиталей, на сумму атомарных волновых функций
5.в виде произведения одноэлектронных волновых функций, занятых молекулярных орбиталей, минус сумма атомарных волновых функций
6.Какое из приведенных ниже уравнений описывает электронную энергию молекулы?
1.Εэл=ΣЕк - Еуср
2.Εэл=2ΣЕк - Еуср
3.Εэл=2ΣЕк – 1/2Еуср
4.Εэл=2ΣЕк
5.Εэл=2ΣЕк / Еуср
7.Какое из приведенных ниже уравнений описывает координатную волновую функцию основного состояния молекулы в нулевом приближении
1.ψ=ψ1+ψ2+ψ3+ψ4+….+ψi
2.ψ=ψ1-ψ2-ψ3-ψ4-….-ψi
3.ψ=ψ(1)·ψ(2) ψ(3) ψ(4) …. ψ(i)
4.ψ=ψ1·ψ2 ψ3 ψ4 …. ψi
5.ψ=ψ(1)+ψ(2)+ψ(3)+ψ(4)+….+ψ(i)
8.Какая энергия приближенно соответствует энергия электрона на молекулярной ор-
битали?
140
